宮頸液基細胞學檢查結果與宮頸癌前病變高危型HPV感染的關系分析
胡水紅 張彩紅 金維圍 馮曉華 周萍
【摘要】? 目的? ? 探究宮頸液基細胞學檢查(TCT)結果與宮頸癌前病變高危型HPV(HR-HPV)感染的關系。方法? ? 選取2019年6月—2021年6月肇慶市中醫院收治的已確診為宮頸癌前病變的78例患者作為研究對象,均行HR-HPV檢查和TCT檢查。分析患者的HR-HPV陽性檢出率及具體分型,并根據其是否感染高危型HPV分為感染組和非感染組。收集患者的基線資料及TCT檢查結果,采用Logistic多因素回歸模型分析TCT檢查結果與宮頸癌前病變HR-HPV感染的關系。結果? ? 78例宮頸癌前病變患者中,HR-HPV感染的陽性率為58.97%,其中HPV16,18,31,38,58型及其他型的陽性率分別為24.36%,15.38%,7.69%,3.85%,5.13%及2.56%。單因素分析結果顯示,TCT檢查結果細胞學病變程度、生育史、陰道炎癥史、性伴侶個數、陰道不規則出血是宮頸癌前病變患者HR-HPV感染的影響因素(P<0.05)。Logistic回歸分析結果顯示,TCT檢查結果細胞學病變程度高、有陰道炎癥史、性伴侶個數多是宮頸癌前病變患者HR-HPV感染的獨立危險因素(P<0.05)。結論? ? 宮頸癌前病變患者高危型HPV感染率較高,以HPV16,18感染為主,其中TCT檢查結果細胞學病變程度越高,患者感染HR-HPV的概率越大。
【關鍵詞】? 宮頸液基細胞學檢查; 宮頸癌前病變; 高危型人乳頭瘤病毒; 相關性
中圖分類號:R711? ? ? ? 文獻標識碼:A
文章編號:1672-1721(2023)17-0063-03
DOI:10.19435/j.1672-1721.2023.17.021
宮頸癌是導致婦女惡性腫瘤死亡的重要原因,全球每年約有27.5萬名女性死于宮頸癌,嚴重危害婦女生命健康。臨床實踐發現,從宮頸癌前病變進展為浸潤性宮頸癌的潛伏期較長,約有10~15年,且宮頸癌前病變具有可逆性[1]。但多數宮頸癌前病變患者由于無明顯癥狀而容易被忽視,因此宮頸癌前病變的早期診斷和合理干預對于宮頸癌防治工作具有重要意義。目前,臨床主要采取宮頸液基細胞學檢查(thinprep cytologic test,TCT)對宮頸癌前病變進行早期篩查,TCT法診斷準確性較高,可以診斷大部分癌前病變,尤其對宮頸癌細胞的檢出率可達100%[2]。而人乳頭瘤病毒(human papilloma vorus, HPV)是一種特異性雙鏈環狀DNA病毒,可誘導宿主子宮頸細胞異常病變。有研究表明,持續性高危型HPV感染是導致宮頸癌發生的危險因素[3]。目前國內外研究多數注重宮頸癌及宮頸癌前病變與高危型HPV感染分布類型方面的報道[4],而關于TCT檢查結果與宮頸癌前病變高危型HPV感染關系的研究較少。本研究調查了宮頸癌前病變婦女的高危型HPV感染現狀,并分析其與宮頸液基細胞學檢查結果的關系,旨在為宮頸癌前病變高危型HPV感染的防治提供依據,報道如下。
1? ? 資料與方法
1.1? ? 臨床資料? ? 選取2019年6月—2021年6月肇慶市中醫院收治的已確診為宮頸癌前病變的78例患者作為研究對象。納入標準:(1)經病理診斷確診為宮頸癌前病變;(2)檢查前3 d無性生活、陰道給藥;(3)患者臨床資料完整。排除標準:(1)有婦科惡性腫瘤或宮頸手術史者;(2)合并嚴重的肝腎功能不全者;(3)有盆腔放化療治療史者;(4)哺乳期或妊娠期婦女。
1.2? ? 方法
1.2.1? ? HR-HPV分型檢測? ? 首先拭去宮頸表面過多的黏液,在距宮頸管內口1 cm處插入備好的宮頸細胞刷,扇形順時針旋轉約5圈,同時刷取宮頸口的脫落細胞。將標本置于細胞保存液中冷凍或冰箱低溫保存,應用PCR法和反應斑點雜交法進行HR-HPV檢測。采用13種高危型HPV(HPV16,18,31,33,35,38,45,51,52,56,58,59,68)分型檢測試劑盒,操作嚴格參照檢測盒說明書進行。HPV-DNA試劑盒購自杭州艾康公司(批號:20080306),PE9600PCR擴增儀購自杭州晶格科學儀器有限公司。
1.2.2? ? TCT細胞檢查? ? 樣本采集與HR-HPV分型檢測中方法相同,采集的標本置于20 mL細胞保存液中,隨后進行細胞處理,制片、閱片。采用2001年國際癌癥協會TBS診斷標準對TCT細胞檢查結果進行分類[5],主要分類為:(1)正常范圍內(NILM)。(2)鱗狀上皮細胞異常:①鱗狀上皮內病變(SIL),包括高度鱗狀細胞上皮內病變(HSIL)和低度鱗狀細胞上皮內病變(LSIL);②鱗狀細胞癌(SCC);③不典型鱗狀細胞(ASC),包括意義不明的不典型鱗狀細胞(ASCUS)、不除外上皮內高度病變的不典型鱗狀細胞(ASC-H)。(3)腺細胞異常:①腺癌(AC);②宮頸管原位癌(AIS);③傾向于腫瘤的不典型腺細胞;④不典型腺細胞(AGC)。
1.2.3? ? 臨床資料收集及分組? ? 收集患者的相關臨床資料,包括年齡、教育程度、吸煙史、生育史、陰道炎癥史、性伴侶個數、TCT細胞檢查結果等。根據是否感染高危型HPV分為感染組和非感染組,分析高危型HPV感染的流行病學特征及與TCT細胞檢查結果的關系。
1.3? ? 統計學方法? ? 應用SPSS 21.0統計學軟件分析數據,計量資料以均數±標準差(x±s)表示,采用t檢驗,計數資料以率(%)表示,采用χ2檢驗,多因素分析采用Logistic回歸分析,P<0.05為差異有統計學意義。
2? ? 結果
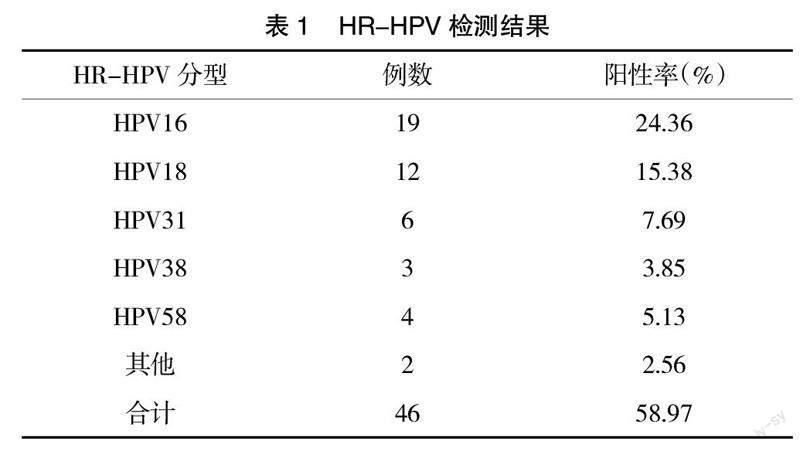
2.1? ? HR-HPV檢測結果分析? ? 78例宮頸癌前病變患者HR-HPV感染陽性率及HPV16,18,31,38,58型及其他型的陽性率,見表1。
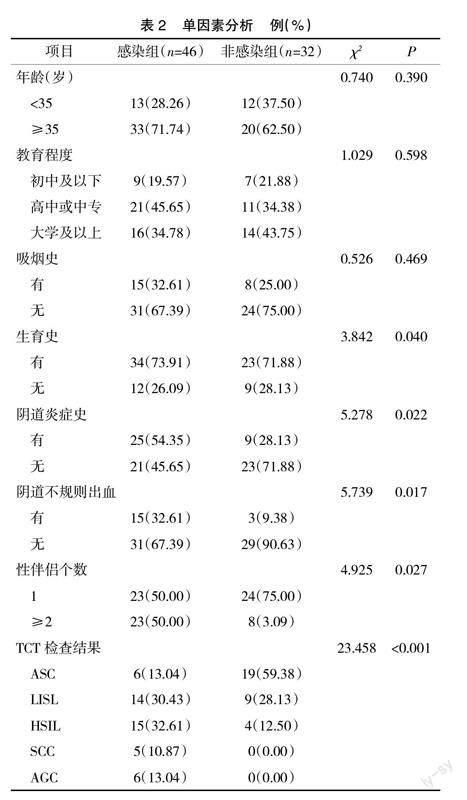
2.2? ? 單因素分析? ? 單因素分析結果顯示,TCT檢查結果細胞學病變程度、生育史、陰道炎癥史、性伴侶個數、陰道不規則出血是宮頸癌前病變患者HR-HPV感染的影響因素(P<0.05),見表2。
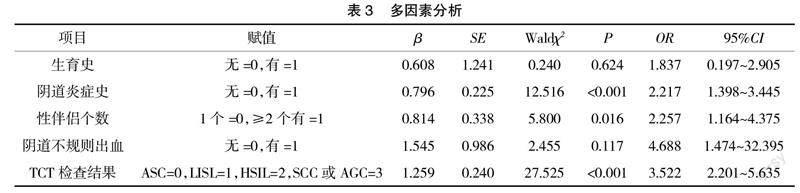
2.3? ? 多因素分析? ? Logistic回歸分析結果顯示,TCT檢查結果細胞學病變程度高、有陰道炎癥史、性伴侶個數多是宮頸癌前病變患者HR-HPV感染的獨立危險因素(P<0.05),見表3。
3? ? 討論
宮頸癌前病變主要通過傳統組織學病理活檢確認,為浸潤性宮頸癌的早期病變,是一種主要由宮頸上皮內瘤變造成的婦科疾病。近年來,其發病年齡愈趨于年輕化,需引起臨床關注[6]。臨床認為,高危型HPV持續感染是導致宮頸癌前病變進一步發生發展的主要生物學致病因素,但目前尚未明確其具體發病機制[7-8]。
本研究結果顯示,在78例宮頸癌前病變患者中,HR-HPV感染的陽性率為58.97%,其中HPV16,18,31型的陽性率最高,依次為24.36%,15.38%,7.69%。提示當地HPV致宮頸癌前病變的防護工作做得不理想,高危型HPV感染導致疾病發生仍為主要因素,建議加強健康教育及HPV疫苗接種等工作。本研究中,單因素分析結果顯示,TCT檢查結果細胞學病變程度、生育史、陰道炎癥史、性伴侶個數、陰道不規則出血是宮頸癌前病變患者HR-HPV感染的影響因素。Logistic回歸分析結果顯示,TCT檢查結果細胞學病變程度高、有陰道炎癥史、性伴侶個數多是宮頸癌前病變患者HR-HPV感染的獨立危險因素(P<0.05)。提示政府或醫療部門在關于HPV感染的防治宣教中,應對陰道炎癥、性伴侶多對于女性身體危害單獨設置知識板塊并重點宣教。本研究中,宮頸癌前病變患者的TCT檢查結果的細胞學病變程度越高,其高危型HPV感染陽性率越高,尤其在SCC/AGC細胞病變類型中的高危型HPV陽性率為100%。提示TCT檢查結果細胞病變程度與高危型HPV感染的關系高度密切,對于HPV感染的診斷有較強的提示作用,因此對于TCT檢查結果細胞病變程度高的人群應列為HR-HPV重點監測對象。有研究指出[9-10],TCT細胞學檢測技術對宮頸病變檢測的敏感度隨著宮頸病變程度的增加而增高,其TBS細胞學結果與組織病理學診斷具有良好的一致性。高危型HPV感染可促使細胞形態和結構發生改變,但其導致的細胞異常變化具有可逆性。研究表明,HR-HPV感染消失后,HR-HPV轉陰需要3~4個月的時間[11-12]。因此,建議對癌前病變患者先行TCT細胞檢查,對細胞病變高度惡性患者應進行密切追蹤,進一步行HR-HPV檢測并予以合理的治療措施。
綜上所述,宮頸癌前病變患者高危型HPV感染率較高,以HPV16,18感染為主,其中TCT檢查結果細胞學病變程度越高,患者感染HR-HPV的概率越大。應制定符合本地區情況的宣教策略,大力普及基本衛生知識,提倡健康的生活行為方式,重視TCT檢查結果的細胞惡性病變人群,進行登記隨訪并給予及時有效的治療,進而控制宮頸癌前病變,降低宮頸癌的發病率。
參考文獻
[1]? ? 徐舜,陳潔瑛,江海燕,等.宮頸癌前病變HPV感染與宮頸液基細胞早期篩查的臨床分析[J].中華醫院感染學雜志,2017,27(20):4739-4742.
[2]? ? 師曉艷,雷俠.宮頸液基細胞學檢查與高危型HPV檢測用于宮頸癌前病變并發感染早期篩查的對比研究[J].中國性科學,2017,26(1):33-35.
[3]? ? GRAHAM S V.The human papillomavirus replication cycle,and its links to cancer progression:a comprehensive review[J].Clin Sci (Lond),2017,131(17):2201-2221.
[4]? PRUSKI D,MILLERT-KALINSKA S,LEWEK A,et al.Sensitivity and specificity of HR HPV E6/E7 mRNA test in detecting cervical squamous intraepithelial lesion and cervical cancer[J].Ginekol Pol,2019,90(2):66-71.
[5]? ? 許馳,何玉,李旭.細胞學檢測與HPV檢測在宮頸疾病篩查中的應用[J].南京醫科大學學報(自然科學版),2018,38(11):1593-1597.
[6]? ? BASU P,TAGHAVI K,HU S Y,et al.Management of cervical premalignant lesions[J].Curr Probl Cancer,2018,42(2):129-136.
[7]? ? LONG W,YANG Z,LI X,et al.HPV-16,HPV-58,and HPV-33 are the most carcinogenic HPV genotypes in Southwestern China and their viral loads are associated with severity of premalignant lesions in the cervix[J].Virol J,2018,15(1):94.
[8]? ? 張一方,薛鵬,唐朝,等.評估細胞學、HR-HPV在陰道鏡檢查中發生宮頸癌前病變風險的分層研究[J].中華疾病控制雜志,2021,25(7):812-816,842.
[9]? ? 齊艷紅.宮頸病變篩查中宮頸液基薄層細胞學檢查與HPVDNA檢測的聯合應用觀察[J].山東醫藥,2016,56(19):58-59.
[10]? ? 鄒倩,濮德敏,周利平,等.液基超薄細胞技術及TBS系統檢測2 635例宮頸涂片的臨床分析[J].中國實用婦科與產科雜志,2006,22(4):268-270.
[11]? ? 余楊,付艷麗,鄒晶晶,等.HR-HPV載量聯合細胞免疫指標預測宮頸癌變進程[J].中國熱帶醫學,2018,18(3):212-216.
[12]? ? 李麗,楊亞玲,閆翠起,等.陜西地區宮頸病變患者HR-HPV感染的流行病學調查及與宮頸病變的相關性分析[J].解放軍預防醫學雜志,2018,36(9):1197-1199.
(收稿日期:2023-03-12)

