合成MRI聯合IVIM模型對宮頸鱗癌及CIN Ⅲ的診斷價值
湯倩,周柒柒,陳文,劉薇音,徐霖
1.湖北民族大學附屬民大醫院 放射影像科,湖北 恩施 445012;2.湖北醫藥學院附屬十堰市太和醫院 醫學影像中心,湖北 十堰 442000;3.GE醫療中國 磁共振科研部,北京 100176
引言
宮頸鱗癌是女性生殖系統常見的惡性腫瘤,近年來,其發病率和死亡率分別占女性癌癥的6.5%和7.7%[1]。而宮頸上皮內瘤變(Cervical Intraepithelial Neoplasia,CIN)的反復進展容易引發宮頸鱗癌。CIN Ⅲ目前被認為是高危型癌前病變,極易轉化成宮頸鱗癌[2]。合成MRI 是近年來在傳統定量MRI 基礎上開發的一種新的定量MRI[3],該技術利用多動態多回波序列,能夠在一次掃描中同時量化縱向弛豫時間(Longitudinal Relaxation Time,T1)、橫向弛豫時間(Transverse Relaxation Time,T2)以及質子密度(Proton Density,PD)等定量信息,已被廣泛應用于人體多種腫瘤的研究中[4-8]。體素內不相干運動(Intravoxel Incoherent Motion,IVIM)成像基于彌散加權成像(Diffusion Weighted Imaging,DWI)發展而來[9-10],可以同時顯示腫瘤區域的擴散與微循環[11-13],目前已被證實在鑒別宮頸腫瘤、預測腫瘤良惡性以及預測腫瘤放化療療效方面具有更高的敏感度和準確性[14-15]。已有相關研究證實了合成MRI 技術聯合表觀擴散系數值在鑒別子宮良惡性腫瘤方面的診療效能優于單個技術,但尚未有相關研究闡述合成MRI 技術聯合IVIM 模型在宮頸鱗癌中的診療作用。故本研究旨在探討合成MRI 聯合IVIM 模型對宮頸鱗癌及CIN Ⅲ的鑒別診斷價值,并找到一組診斷宮頸鱗癌最優的聯合模型圖,為未來的臨床診療提供新的思路。
1 資料與方法
1.1 一般資料
前瞻性收集2021 年5—12 月在我院就診的35 例宮頸鱗癌患者(宮頸鱗癌組)以及35 例CIN Ⅲ患者(CIN Ⅲ組)的基本資料,所有患者均簽署書面知情同意書。宮頸鱗癌組患者納入標準:① 無MRI 掃描禁忌證,也未接受過任何手術及藥物治療;② 均進行了相關序列的MRI 掃描;③ 圖像清晰,無偽影;④ 病灶最大面積>1 cm2。CIN Ⅲ組納入標準:經宮頸細胞學檢查確認為CIN Ⅲ的患者,且無其他不可控的合并癥及無MRI 掃描禁忌證。宮頸鱗癌組及CIN Ⅲ組患者排除標準:① 患者合并有其他不可控的合并癥或惡性腫瘤;② 有相關MRI 掃描禁忌證的患者;③ 臨床病理資料不完善。本研究經十堰市太和醫院醫學倫理委員會批準(2022KS013)。
1.2 檢查方法
所有患者均采用voyager MR750 1.5 T MRI(GE,美國)、8 通道腹部相控線圈進行掃描。掃描前30 min,囑患者適當排空膀胱,以減少腸道蠕動偽影及尿液電解質偽影。所有患者取仰臥位、胸式呼吸,掃描范圍:自髂前上棘至恥骨聯合下緣,以覆蓋整個子宮。掃描序列:① 常規軸位T1WI、T2WI,及矢狀位T2WI;② MAGiC序列;③ IVIM 序列,共選取5 個b 值(0、100、400、800、1500 s/mm2),掃描時間 4 min。具體掃描參數如表1 所示。
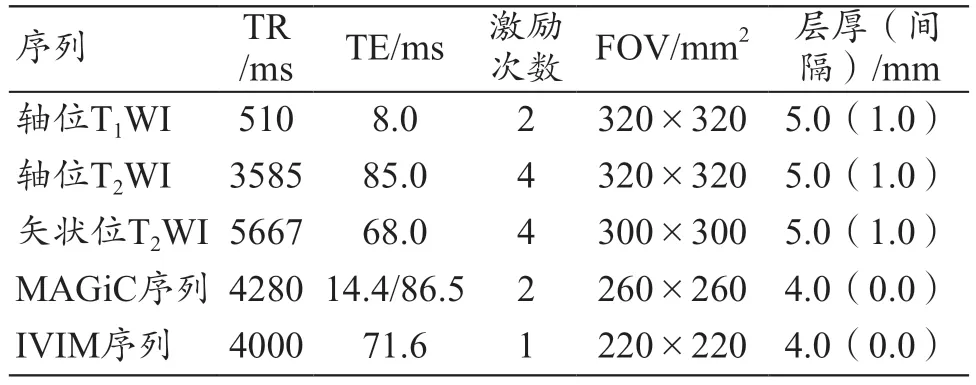
表1 MRI序列及IVIM序列參數
1.3 圖像分析
將所有患者的合成MRI 圖像傳輸至MAGiC 專用后處理軟件進行處理,生成T1mapping、T2mapping 和PD共3 組定量序列。并將IVIM 序列所得的圖像傳至GE AW 4.6 工作站,經后處理后分別得到慢擴散系數(D)、快擴散系數(D*)、灌注分數(f)值;宮頸鱗癌組的感興趣區域(Region of Interest,ROI)勾畫如下:① 由兩位至少有10 年腹部診斷放射經驗的影像科醫生采用雙盲法在Image J 軟件上先以平掃的T2軸位、矢狀位及DWI 圖像確定病變的位置、大小、范圍和邊界;② 通過Image J 軟件手動勾畫腫瘤實體部分的輪廓作為ROI,并在勾畫過程中避開血管,腫瘤出血、壞死區域。同時將該ROI 復制在同一患者的合成MRI 圖像及IVIM 模型中。經測量,勾畫的ROI 面積約為0.50~1.00 cm2。CINⅢ組的ROI 勾畫方式同宮頸鱗癌組,即同樣以T2軸位信號稍異常的層面及DWI 圖像為參照對象(若沒有明顯異常信號層面,則選取宮頸最大層面),通過Image J軟件手動勾畫最大異常層面,同一患者勾畫3 次,取平均值,ROI 大小同宮頸鱗癌組,保持在0.50~1.00 cm2范圍內。并將該ROI 同步復制在同一患者的合成MRI 圖像及IVIM 模型中。
1.4 統計學分析
使用SPSS 26.0 進行統計學分析,通過Kolmogorov-Smirnov 檢驗數據是否符合正態分布,符合正態分布的用±s表示,且組間比較采用獨立樣本t檢驗;不符合正態分布的資料使用Mann-WhitneyU檢驗,以P<0.05為差異有統計學意義。應用logistic 回歸聯合多參數繪制受試者工作特征(Receiver Operating Characteristic,ROC)曲線,并計算ROC 曲線下面積(Area Under Curve,AUC),以評價各合成MRI 定量參數以及IVIM參數在宮頸鱗癌與CIN Ⅲ中的鑒別診斷作用,并通過最大約登指數確定敏感度和特異性,且找到各自鑒別宮頸良惡性病變的最佳臨界值。
2 結果
2.1 合成MRI在宮頸鱗癌組及CIN Ⅲ組中的參數統計結果
通過對合成MRI 技術提供的相關定量標測參數圖(T1Mapping、T2Mapping、PD)進行統計學分析,發現宮頸鱗癌組的T2值、PD 值均顯著高于CIN Ⅲ組的T2值、PD 值,其差異具有統計學意義(P<0.05),兩組間T1值差異無統計學意義(P>0.05),見表2。
表2 CIN Ⅲ組與宮頸鱗癌組的合成MRI參數結果(±s)
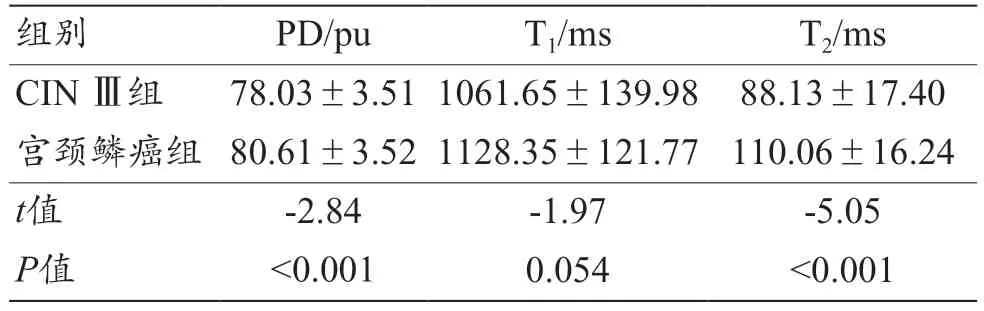
表2 CIN Ⅲ組與宮頸鱗癌組的合成MRI參數結果(±s)
注:CIN:宮頸上皮內瘤變;PD:質子密度;T1:縱向弛豫時間;T2:橫向弛豫時間。
組別PD/puT1/msT2/ms CIN Ⅲ組78.03±3.51 1061.65±139.98 88.13±17.40宮頸鱗癌組 80.61±3.52 1128.35±121.77 110.06±16.24 t值-2.84-1.97-5.05 P值<0.0010.054<0.001
2.2 IVIM成像在宮頸鱗癌組及CIN Ⅲ組中的參數統計結果
宮頸鱗癌組的D 值、f 值低于CIN Ⅲ組的D 值、f 值,差異具有統計學意義(P<0.05);兩組間D*值無統計學意義(P>0.05),見表3。
表3 CIN Ⅲ組與宮頸鱗癌組的IVIM參數結果比較(±s)
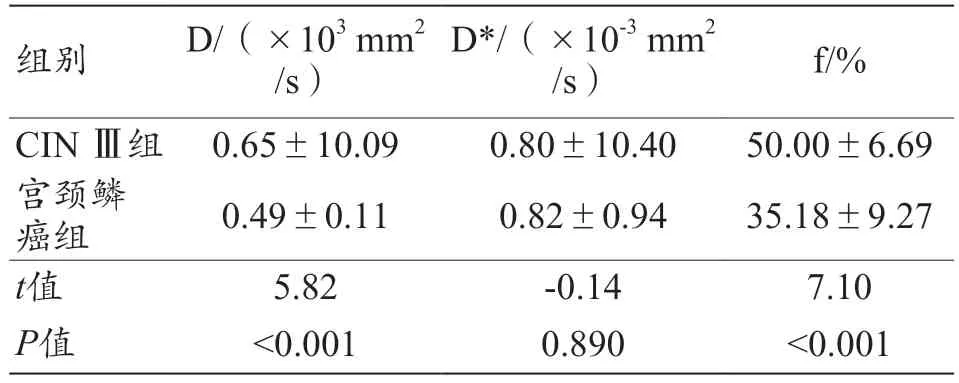
表3 CIN Ⅲ組與宮頸鱗癌組的IVIM參數結果比較(±s)
注:CIN:宮頸上皮內瘤變;D:慢擴散系數;D*:快擴散系數;f:灌注分數。
組別D/(×103 mm2/s)D*/(×10-3 mm2/s)f/%CIN Ⅲ組 0.65±10.090.80±10.4050.00±6.69宮頸鱗癌組0.49±0.110.82±0.9435.18±9.27 t值5.82-0.147.10 P值<0.0010.890<0.001
2.3 診斷效能
經合成MRI 技術相關參數診斷,T2、PD 值在鑒別診斷宮頸鱗癌組和CIN Ⅲ組的ROC 曲線結果顯示,AUC 分別為0.812、0.697,(P<0.05)。當選取T2=88.80 ms 為診斷閾值時,其敏感度和特異性分別為100%、58.1%,當選取PD=77.50 pu(pu 為單位體素內氫質子密度)為診斷閾值時,其敏感度和特異性分別為87.1%、51.6%。經IVIM 技術診斷,宮頸鱗癌組和CIN Ⅲ組的D 值和f 值的AUC 分別為:0.862、0.889,(P<0.05)。選取D= 0.50 ×10-3mm2/s 為診斷閾值時,敏感度和特異性分別為100.0%、61.3%;選取f=40.47%為診斷閾值時,敏感度和特異性分別為100.0%、77.4%。當將合成MRI 相關參數(T2、PD)與IVIM 參數(D、f)進行聯合分析時,發現T2值、PD 值聯合D 值、f 值均提高了診斷效能。其中T2與f 值聯合診斷效能達最高,其AUC 為0.956。其余各參數的ROC 曲線信息如圖1、表4 所示。合成MRI 及IVIM 參數在宮頸鱗癌患者中所生成的相關偽彩圖,見圖2。
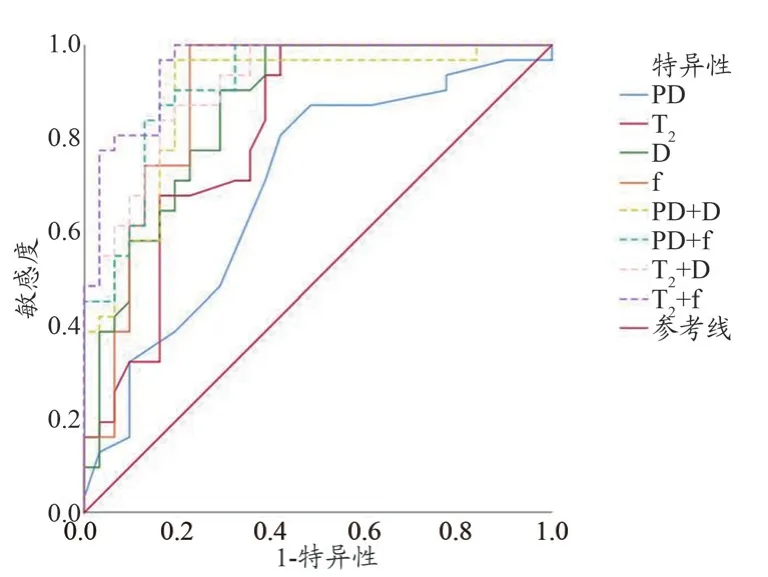
圖1 合成MRI序列及IVIM各參數單獨及聯合鑒別診斷宮頸鱗癌與CIN Ⅲ的 ROC 曲線圖
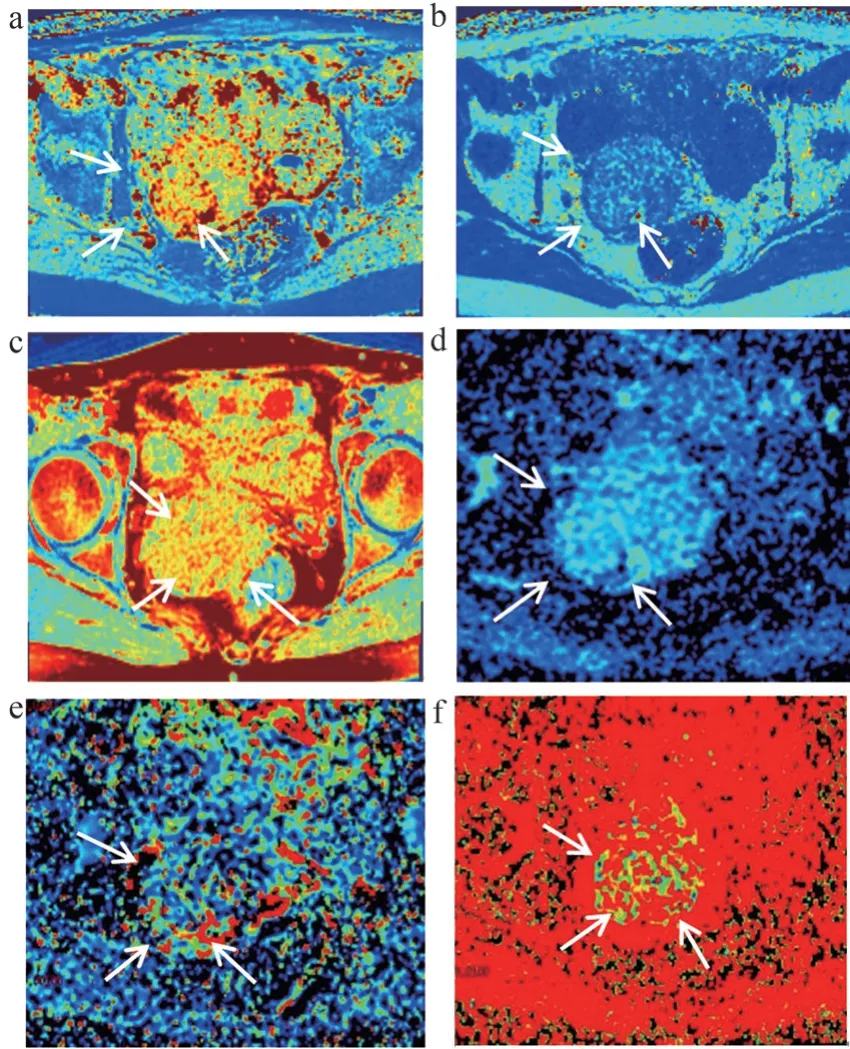
圖2 合成MRI及IVIM參數生成的偽彩圖
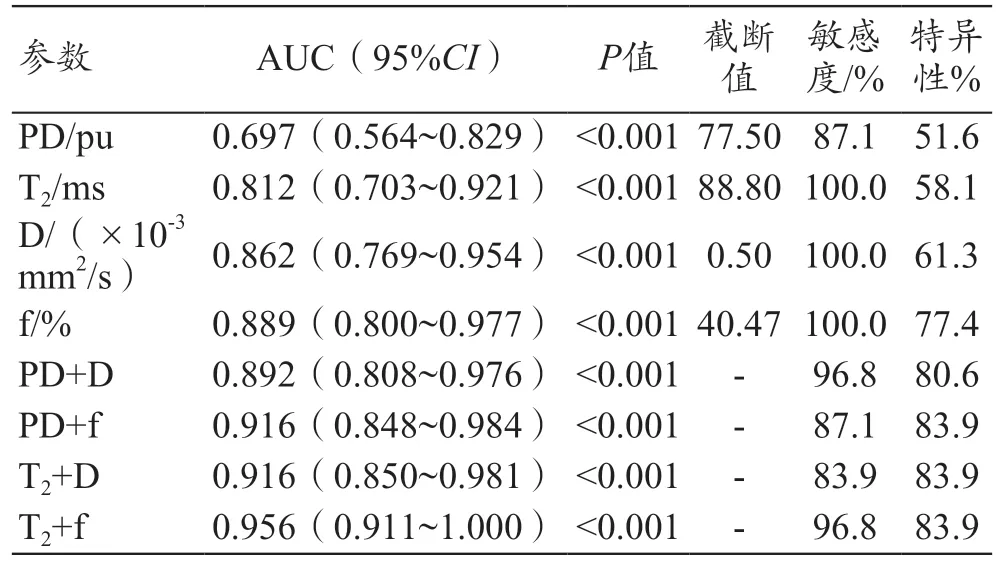
表4 合成MRI和IVIM各項參數鑒別診斷宮頸鱗癌和CIN Ⅲ 的效能
3 討論與結論
3.1 合成MRI對宮頸鱗癌及CIN Ⅲ的診斷效能
本研究討論了合成MRI 技術提供的相關定量參數圖在宮頸鱗癌及CIN Ⅲ診斷中的可行性。在本研究中,比較了合成MRI 的3 種不同定量參數圖(T1Mapping、T2Mapping、PD)分別對宮頸鱗癌和CIN Ⅲ的鑒別效能。發現合成MRI 中的PD、T2值可鑒別宮頸鱗癌與CIN Ⅲ,其中宮頸鱗癌組的T2值及PD 值均顯著高于CIN Ⅲ組的T2值及PD 值。本研究首次報道了宮頸鱗癌組與CIN Ⅲ組的T2值與PD 值在1.5 T MRI 中的差異,當選取PD=77.50 pu 為診斷閾值時,其敏感度和特異性分別為87.1%、51.6%。證實了PD 值在鑒別宮頸鱗癌與CIN Ⅲ中,其效能雖不及T2值,但仍具備一定的診斷效能。Arita 等[16]也發現前列腺癌骨轉移灶的PD 值明顯高于其他非活動性病灶;Gracien 等[17]在對腦部多發硬化癥的研究中也發現,由于多發硬化癥患者的腦組織在微結構水平上被間質液體取代,故在整個大腦皮層和所有皮質區PD 值顯著增加,以上研究均證實了PD 值的變化與組織結構損傷具有密切聯系。而本研究也得出了同樣的結果:宮頸鱗癌組的PD 值與CIN Ⅲ組不同。原因可能是PD 又稱質子密度加權成像,其參數主要提供組織中水分含量的相關信息,故對水腫以及組織結構損傷非常敏感[17-18]。由于宮頸鱗癌患者的宮頸組織結構受到惡性腫瘤細胞的侵襲程度遠遠大于CIN Ⅲ患者[19],故其內部結構受到損傷的程度也高于CIN Ⅲ患者[20],但由于CIN Ⅲ屬于高危癌前病變,其細胞層面已經發生了細微的變化,故雖宮頸鱗癌患者的PD 值高于CIN Ⅲ患者,但二者之間的差異較小。此外,研究T2Mapping 在宮頸鱗癌及CIN Ⅲ中的價值時發現,宮頸鱗癌中的T2值明顯高于CIN Ⅲ的宮頸組織(P<0.001),這與Li 等[21]在宮頸鱗癌中的研究結果類似。宮頸鱗癌的T2值較CIN Ⅲ宮頸組織高可能是由腫瘤的微觀結構特征決定的:人體內的水可分為自由水和結合水,其中自由水由于其分子較小,具有較長的橫向弛豫時間,故T2值較大[21]。惡性腫瘤組織的細胞密度較高[22-23],較CIN Ⅲ的宮頸組織細胞增殖更快,且癌組織往往伴有細胞壞死,大分子物質被釋放到細胞周圍的空間[17],由于細胞壞死,多數細胞被分解,其原本細胞內的結合水部分轉變成了游離水分布于腫瘤細胞周圍空間,致使T2值增大。而對于CIN Ⅲ的宮頸組織,幾乎很少有細胞壞死部分,細胞內水分子大多以結合水形式存在于細胞中,故導致T2值低于腫瘤細胞。此外,本研究發現T1值在宮頸鱗癌與CIN Ⅲ之間無顯著差異,原因可能是T1值表示原子核在B0 方向恢復到熱力學平衡的速度[24],該值取決于周圍分子的進動頻率,De 等[25]的研究顯示:癌組織間質與CIN 患者相比,其表達無明顯差異。故有可能導致T1值無法準確區分宮頸鱗癌與CIN Ⅲ。綜上,雖然本文研究結果顯示PD、T2值可以鑒別宮頸鱗癌與CIN Ⅲ,但二者單獨用于診斷的效能卻有限。
3.2 IVIM成像對宮頸鱗癌及CIN Ⅲ的診斷價值
IVIM 成像基于DWI 成像發展而來,可以同時顯示腫瘤區域的擴散與微循環,使得可以同時使用多個b 值和雙指數曲線來分析腫瘤中的純水擴散和微循環灌注[11]。在本研究中,宮頸鱗癌組的D、f 值均低于CIN Ⅲ組的D、f 值,而二者之間的D*值則無明顯差異。原因是因為IVIM 中的D 值是排除低b 值灌注成分,代表著腫瘤中純水分子擴散的特性,細胞的間隙越大則其擴散越快,D 值就越大[26-27]。但由于宮頸鱗癌組織相較于CIN Ⅲ的宮頸組織而言,細胞異形性明顯、體積增大,因此在顯微鏡下細胞顯示更為密集,細胞外間隙減少,細胞外水分子活動受限明顯[28],表現為D 值減低。而f 值代表宮頸腫瘤微循環灌注在DWI 信號衰減中所占的比例。雖然理論上腫瘤組織代謝增高、血流灌注豐富,f 值會增高[29],但由于f 值反映血流灌注成分在總體擴散效應中所占的百分比[30],而宮頸鱗癌細胞排列緊密,間質壓力增加,會導致病灶內毛細血管血流量減少[31]、f 值降低。這與李志森等[30]以及程楠等[32]的研究結果相同。在本研究中發現D*無法準確區分宮頸鱗癌與CIN Ⅲ,原因可能是D*值的穩定性及測量重復性差,使D*值的測量存在偏差,故導致結果存在一定爭議。
3.3 合成MRI聯合IVIM模型對宮頸鱗癌與CIN Ⅲ的鑒別診斷價值
本文首次將合成MRI 技術與IVIM 技術聯合起來應用于宮頸鱗癌與CIN Ⅲ的診療。當將合成MRI 相關參數(T2、PD)與IVIM 參數(D、f)進行聯合分析時,發現T2值、PD 值聯合D 值、f 值的診斷效能均遠遠高于單個參數的診斷效能。其中,T2與f 值聯合診斷效能達最高,其ROC 曲線下面積達0.956。原因可能是合成MRI 技術可以提供多種定量信息,而IVIM 技術則可以更好地從分子、細胞水平反映不同組織的微觀代謝變化。將兩種技術進行聯合診斷時,可以各自發揮不同的優勢,從而彌補單個技術的不足之處。此外,在本研究中,T2與f 值聯合診斷的ROC 曲線下面積高達0.956,這為今后對于宮頸鱗癌及CIN Ⅲ的鑒別診斷,提供了一個新的診療思路。
本文研究仍存在一定的局限性:① 樣本量相對較小,在納入樣本時僅選擇了部分宮頸鱗癌患者與CIN Ⅲ患者進行對照;② 由于CIN Ⅲ患者的影像學表現并不十分明顯,雖然在勾畫其ROI 時已經盡量選擇多層勾畫后取平均值,但仍有可能存在一定誤差。故在以后的研究中,有必要進行更大樣本量的進一步研究,以確定合成MRI聯合IVIM 模型在鑒別宮頸鱗癌及CIN Ⅲ中的穩健性和相關性。
綜上,本文研究初步表明:合成MRI 相關參數(T2、PD)與IVIM 參數在對宮頸鱗癌及CIN Ⅲ進行聯合鑒別診斷時,診斷效能均遠遠大于單個參數的診斷效能。其中,T2與f 值聯合診斷效能達最高,具有良好的臨床應用前景。

