電針對胰島素抵抗大鼠肝臟組織自噬相關蛋白表達的影響
易璇,陳麗,王靜芝,王雅媛,鄭紫桐,梁鳳霞
(湖北中醫藥大學,武漢 430065)
胰島素抵抗(insulin resistance, IR)是指由多種因素引起的機體對胰島素敏感性降低的一種病理狀態[1]。國內外研究表明,電針能夠有效改善IR,其機制包括減輕炎癥、調控脂質代謝、調節胰島素信號通路等環節[2-4]。肝臟是胰島素的重要靶器官之一,肝臟的脂肪浸潤程度越高,胰島素敏感性越差,降低肝臟脂肪含量能夠提高機體胰島素敏感性,改善IR[5]。且自噬是脂肪降解和儲存的重要環節[6],自噬可以維持肝臟脂質代謝穩態,并提高肝臟胰島素敏感性;而抑制肝細胞自噬,則會降低肝臟胰島素敏感性[7-9]。因此,自噬可能是調控胰島素敏感性的突破口。
有研究表明,電針具有調控自噬相關蛋白的作用[10-11],但在不同的疾病與組織中,電針對自噬的調控效應并不相同。為進一步明確電針對IR 狀態下肝臟自噬的調控作用,本研究建立IR 大鼠模型,通過電針中脘、關元、足三里和豐隆觀察胰島素敏感性與肝臟自噬水平的變化,進一步研究電針治療IR 的潛在機制。
1 材料與方法
1.1 實驗動物
40 只7 周齡Wistar 雄性大鼠,體質量(220±20)g。購于湖北省實驗動物研究中心,許可證號為SCXK(鄂)2020-0018。所有大鼠以普通飼料適應性飼養1 周。飼養于湖北中醫藥大學SPF 級動物房,大鼠自由飲食與飲水,12 h 明暗交替。實驗嚴格遵守《關于善待實驗動物的指導性意見》中的各項規定。
1.2 主要試劑與儀器
RIPA 裂解液(AS1004,ASPEN)、BCA 蛋白質濃度測定試劑盒(AS1086,ASPEN)、ECL 化學發光檢測試劑盒(AS1059,ASPEN)、磷酸化蛋白酶抑制劑(AS1008,ASPEN),β-Actin 抗 體 (TDY051, 天 德 悅 ),p62(sequestosome 1, p62)一抗(ab109012,abcam),微管相關蛋白1 輕鏈3B (microtubule-associated protein 1 light chain 3B,LC3B)一抗(43566,CST)、胰島素受體底物-1(insulin receptor substrate-1,IRS-1)一抗(2382,CST)、磷酸化胰島素受體底物 -1(phosphorylated-IRS-1, p-IRS-1) 一 抗(2385,CST)、蛋白激酶B(protein kinase B, AKT)一抗(9272,CST)、磷酸化蛋白激酶B(phosphorylated-AKT, p-AKT)一抗(4060,CST),HRP-Goat anti Rabbit二抗(AS1107,ASPEN)。電針治療儀(HANS LH202H,北京華運安特科技有限責任公司),冷凍離心機(TGL-16,湖南湘儀實驗室儀器開發有限公司),電泳儀(DYY-6C,北京市六一儀器廠),掃描儀(LiDE110, Canon),生物顯微鏡(BX53,奧林巴斯)。
1.3 模型制備及評價
適應性飼養1 周后,隨機選取10 只以普通飼料喂養,8 周后隨機選取其中8 只作為正常組,剩余30 只以高脂飼料[12]喂養8 周,制備IR 大鼠模型。將高于正常組體質量平均值20%的28 只大鼠隨機取3 只檢測其葡萄糖輸注率(glucose infusion rate, GIR),若所測大鼠的GIR 小于正常組20%則認定為造模成功。將造模成功的28只大鼠隨機進行編號,并挑選16只隨機分入模型組與電針組,每組8 只。
高胰島素-正葡萄糖鉗夾術(hyperinsulinemiceuglycemic-clamp, HEC)檢測GIR,鉗夾術前大鼠禁食8 h,在大鼠尾根部注射局麻,行尾動靜脈插管。將胰島素注射液和30%葡萄糖注射液分別連接在尾靜脈的小三通管上,兩者均以雙數字式微量注射泵泵入。取尾動脈血 0.5 m L 測基礎血糖。接著以恒定速度[0.25 μ/(kg·h)]輸入胰島素,每5 min 測1 次血糖并調整GIR。血糖須保持在基礎血糖±0.5 mmol/L 范圍內。共采血24 次,計算60~120 min 的GIR 的平均值。
1.4 干預方法
選取中脘、關元、足三里及豐隆穴進行電針干預,取穴參考《實驗針灸學》[13]。針具選擇0.30 mm×13 mm不銹鋼毫針。足三里和豐隆均直刺入3~5 mm,關元和中脘斜刺3~5 mm。頻率2 Hz,強度1 mA,連續波。同側足三里和豐隆連接同一輸出的兩個電極,關元和中脘連接另一輸出的兩個電極。隔日干預,每周干預3次,每次10 min,共干預8 周。
1.5 標本采集
干預結束后, 采用 2% 戊巴比妥鈉溶液(0.25 mL/100 g)腹腔注射麻醉。取肝臟組織并迅速放入液氮中。之后轉入-80 ℃冰箱,凍存備檢。
1.6 指標檢測
1.6.1 餐后血糖(postprandial blood glucose, PBG)及腹腔糖耐量實驗(intraperitoneal glucose tolerance test, IPGTT)血糖
干預前及干預8 周后,對各組大鼠進行尾尖取血,用快速血糖儀測定大鼠PBG。干預6 周后,行IPGTT 檢測,操作前尾尖取血測空腹血糖(0 min),根據大鼠體質量行50%葡萄糖腹腔注射,注射后30 min、60 min、90 min、120 min 尾尖取血,檢測血糖值。
1.6.2 GIR 檢測
干預8 周后,每組大鼠各取3 只行HEC 檢測GIR,測定全身胰島素敏感性。
1.6.3 大鼠肝臟組織中LC3B-Ⅱ、p62、IRS-1、p-IRS-1、AKT、p-AKT 蛋白表達檢測
取出凍存的待檢組織50 mg,提取總蛋白,測定其濃度,進行SDS-PAGE 電泳,之后進行轉膜、封閉。孵育一抗[β-actin(1:10 000),LC3B(1:1 000),p62(1:2 000),IRS-1(1:500),p-IRS-1(1:500),AKT(1:2 000),p-AKT(1:1 000)]過夜,孵育二抗1 h,暗室中曝光。以β-actin 為內參蛋白,分析目的蛋白相對表達水平。
1.6.4 GFP-LC3 熒光檢測
大鼠于處死前給予高壓尾靜脈注射GFP-LC3 腺病毒0.166 mL,給藥后飼養5 d,進行取材。取部分組織進行OCT 包埋、冰凍切片、熒光顯微鏡觀察并拍照,利用Image-Pro Plus 分析平均光密度值。
1.7 統計學方法
使用SPSS22.0 統計軟件對數據進行統計分析。符合正態分布的計量資料以均數±標準差表示,方差齊則采用單因素方差分析進行組間比較,并采用LSD法進行兩兩比較。以P<0.05 表示差異有統計學意義。
2 結果
2.1 模型評價
與正常組比較,造模后高脂組大鼠GIR 顯著下降(P<0.05),說明IR 大鼠模型制備成功。詳見圖1。

圖1 造模后正常組與高脂組大鼠GIR 的比較(±s, n=3)
2.2 3 組大鼠PBG、IPGTT、GIR 比較
與正常組比較,模型組PBG 顯著上升(P<0.01),GIR 顯著下降(P<0.01);與模型組比較,電針組PBG 顯著下降(P<0.05),GIR 顯著上升(P<0.01)。在IPGTT實驗中,各組大鼠腹腔注射葡萄糖30 min后,血糖水平迅速升高達到峰值,然后逐漸降低。模型組大鼠IPGTT血糖水平明顯高于正常組(P<0.01,P<0.05);電針組IPGTT 血糖水平明顯低于模型組(P<0.05)。詳見圖2-圖4。
2.3 3 組大鼠肝臟組織IRS-1、p-IRS-1、AKT、p-AKT蛋白表達比較
與正常組比較,模型組肝臟組織IRS-1、p-IRS-1、p-AKT 蛋白表達顯著降低(P<0.01);與模型組比較,電針組肝臟組織 p-IRS-1 蛋白表達顯著上升(P<0.05)。IRS-1、AKT、p-AKT 蛋白表達有上升趨勢,但差異無統計學意義(P>0.05)。詳見圖5。
2.4 3 組大鼠肝臟組織p62、LC3B-Ⅱ蛋白表達比較
與正常組比較,模型組肝臟組織p62 蛋白表達顯著上升(P<0.01),LC3B-Ⅱ蛋白表達顯著降低(P<0.01);與模型組比較,電針組肝臟組織p62 蛋白表達顯著降低(P<0.01),LC3B-Ⅱ蛋白表達顯著上升(P<0.01)。詳見圖6。
2.5 3 組大鼠GFP-LC3 熒光比較
與正常組比較,模型組GFP-LC3 綠色熒光蛋白熒光密度顯著降低(P<0.01);與模型組比較,電針組GFP-LC3 綠色熒光蛋白熒光密度顯著上升(P<0.01)。詳見圖7。

圖2 3 組大鼠PBG 的比較(±s, n=8)
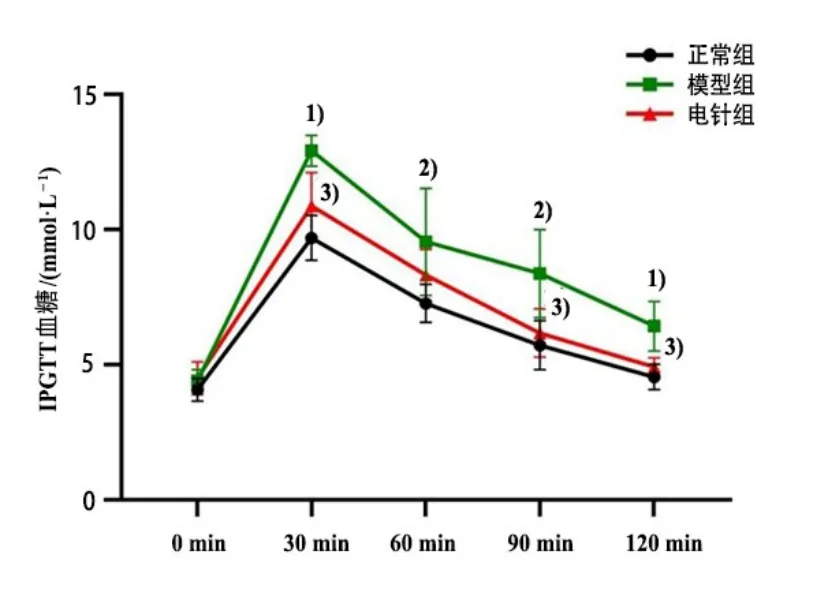
圖3 3 組大鼠IPGTT 血糖比較(±s, n=8)
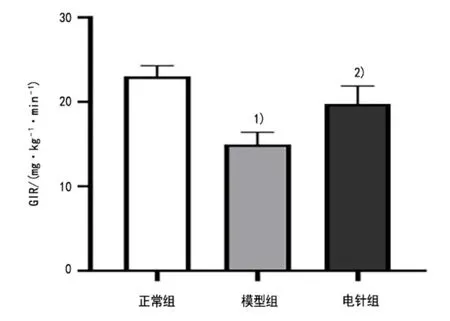
圖4 3 組大鼠GIR 的比較(±s, n=3)

圖5 各組大鼠肝臟IRS-1、p-IRS-1、AKT、p-AKT 蛋白表達比較(±s, n=8)

圖6 3 組大鼠肝臟組織p62、LC3B-Ⅱ蛋白表達比較(±s, n=8)

圖7 各組大鼠GFP-LC3 熒光的比較(±s, n=8)
3 討論
大量的臨床及動物研究[14-17]證實,電針能有效治療IR 相關疾病,并且有環保安全、無不良反應等優勢。中醫學認為IR 與痰濁內阻、脾腎虧損等密切相關[18],故可從化痰祛濕、補益脾腎著手進行治療。中脘、關元、足三里和豐隆為針刺治療IR 研究的常用穴[19],關元和足三里固護先天腎氣之本和后天脾胃之本,提升機體正氣,避免向糖尿病和多囊卵巢綜合征等IR 相關性疾病轉化;配伍中脘和豐隆理氣化痰祛濕,祛除病邪。有研究表明,高脂飲食能促進大鼠的肥胖與IR,并且Wistar 大鼠經過高脂飲食飼料喂養建模能較好地模擬IR 的臨床自然過程[20-21]。IRS-1 與Akt 是關鍵的肝臟胰島素信號調控因子[22],IRS-1 磷酸化后,Akt 發生磷酸化,使葡萄糖轉移至細胞內,從而改善IR[23]。若胰島素代謝分泌異常,將造成上述功能障礙。因此,本研究采用高脂飲食飼喂法,制備IR 大鼠模型,并選取中脘、關元、足三里和豐隆進行電針治療。檢測大鼠肝臟組織中IRS-1、p-IRS-1、AKT、p-AKT 蛋白表達,以觀察肝臟胰島素敏感性的變化;檢測大鼠GIR,以觀察全身胰島素敏感性的變化。結果顯示,與正常組相比,模型組PBG顯著上升,GIR顯著降低,IPGTT血糖水平明顯上升,肝臟組織IRS-1、p-AKT、p-IRS-1 蛋白表達顯著降低;與模型組相比,電針組PBG 顯著降低,GIR 顯著上升,IPGTT 血糖水平明顯降低,肝臟組織p-IRS-1 蛋白表達顯著上升。提示高脂飲食會引起胰島素敏感性降低,導致IR,而電針治療能夠提高胰島素敏感性,從而改善IR。這與現有研究[24-25]較為一致。研究表明,自噬水平的變化與IR 呈負相關[26-27],IR 狀態下,肝臟自噬相關基因表達顯著降低,提示IR 與肝臟自噬水平下降密切相關,且肝臟自噬受損可導致IR 的發生發展[28]。故此,自噬成為IR 機制研究的熱點。目前關于IR 的研究多為電針對脂質生成和水平的影響,自噬雖是脂肪降解和儲存的重要環節,但對自噬的相關報道甚少,導致其深入的機制未揭示。因此,本研究從自噬角度入手,研究電針改善IR 效應與肝臟自噬水平的關系,結果顯示電針可以通過激活肝臟自噬改善全身與肝臟胰島素敏感性,明確了自噬在治療中的作用,對既往研究結果進行了補充。
微管相關蛋白1 輕鏈3(microtubule-associated protein 1 light chain 3, LC3)和p62 是自噬相關的重要標志物[29],LC3 是檢測自噬發生的標志性蛋白。當自噬作用發生的時候,Ⅰ型經泛素樣反應與磷脂酰乙醇胺結合,并直接形成Ⅱ型,此時,LC3 含量與自噬泡數成正比例關系[30-31]。LC3-Ⅱ可反映自噬活性水平,其值越大,自噬越強,反之則越弱。LC3 蛋白共分為多種亞型,其中LC3B 起到自噬調控作用,與自噬的關系最密切,通過結合脂質形成LC3B-Ⅱ發揮自噬功能[32]。p62 是泛素化蛋白,可以和底物蛋白及LC3-Ⅱ特定結構域結合,有利于底物進入自噬體被降解,p62 越高表示自噬越弱,反之則越強[33]。通過熒光顯微鏡觀察肝細胞GFP-LC3 熒光斑可很好地監測細胞自噬,當發生細胞自噬時,細胞自噬強度與GFP 熒光強度成正比,自噬強度越強,熒光強度越強。本研究結果顯示電針干預后IR 大鼠LC3B-Ⅱ蛋白表達顯著上升,p62 蛋白表達均顯著下降,電針組GFP-LC3 熒光密度顯著上升,由此可推論電針激活了大鼠肝臟細胞自噬。
研究證實電針對細胞自噬具有調節作用。田洪昭等[34]發現,電針可增加自噬相關蛋白LC3-Ⅱ表達,降低p62 的表達,促進自噬流修復損傷脊髓。黃小珍等[35]通過研究后發現,電針可降低脊髓及神經組織p62 的蛋白含量,對神經根型頸椎病大鼠具有顯著鎮痛作用,可通過調節大鼠脊髓及神經組織神經細胞的自噬保護神經細胞。有研究發現,電針治療可降低LC3 的表達,上調p62 的表達,有效抑制肥胖大鼠白色脂肪組織的自噬水平[36]。本研究結果顯示,電針可以上調LC3B-Ⅱ表達,下調p62 表達,提示電針能激活肝臟自噬,與以上眾多研究報道相符。
綜合上述內容,電針療法可提高IR 大鼠全身及肝臟胰島素敏感性,有效改善IR,其作用機制可能與調節LC3B-Ⅱ和p62 的表達,從而激活肝臟自噬有關。

