核黃素參與水稻非生物脅迫的響應分析
夏清珊,周正琨,譚炎寧,劉選明,秦迪嵐,林建中*
(1 湖南大學 生物學院 植物功能基因組學和發育調控湖南省重點實驗室/國家耐鹽堿水稻技術創新中心,長沙 410082;2 湖南雜交水稻研究中心,長沙,410125;3 湖南省生態環境監測中心 國家環境保護重金屬污染監測重點實驗室,長沙 410019)
水稻是中國的第一大糧食作物,隨著人口的增加和耕地面積的減少,提高糧食的產量是現代水稻研究的重中之重[1]。水稻在生長過程中,常會受到自然界各種不利環境的影響,如高溫、干旱、高鹽、低溫、氧化脅迫、大氣污染等非生物因素,病原微生物、害蟲等生物因素[2-3]。
這些逆境脅迫會引起水稻一系列形態和生理生化上的變化,影響水稻的正常生長發育,尤其會對產量和品質帶來損失,嚴重時甚至可導致死亡[4-5]。水稻在生長過程中不能主動避開逆境脅迫帶來的危害,但在漫長的進化過程中已經形成了一系列復雜且有序的機制來感知環境的變化、抵御環境帶來的不利影響[6-7]。
核黃素(riboflavin)又稱維生素B2(VB2),因其結構中含有核糖且呈黃色,故取名核黃素[8-9]。核黃素是酶輔因子黃素單核苷酸(FMN)和黃素腺嘌呤二核苷酸(FAD)的前體,FAD和FMN是許多氧化還原酶的輔基,參與許多生物過程,如生物鐘調節[10]、固氮[11]和激素代謝[12-13]。所有的植物和真菌以及大多數細菌都能產生核黃素[14],核黃素的基本功能就是以FMN或FAD的形式作黃素酶的輔基,與黃素蛋白或金屬黃素蛋白組成復酶,參與動植物、微生物以氧化還原反應為特征(包括氨基酸去氨基化作用、嘌呤降解、醛類物質的降解、呼吸電子傳遞鏈等)的50多個生理生化過程,與機體的糖、脂類及蛋白質的生物氧化有密切關系。植物體外施用核黃素可以促進許多生理代謝過程、減輕病害;同時,核黃素在植物體內可以與各種多糖結合,形成糖基化核黃素。這些研究結果表明,植物可能有一種機制對核黃素在體內進行重新分配,調控環境脅迫反應[15-17]。已有研究發現,核黃素能夠增加植物的抗病性。例如,董漢松等[18]發現核黃素能作為植物抗病性激發子而激活免疫信號轉導通路,誘導植物對多種病害產生抗性。
最近,Hu等[19]發現核黃素影響水稻體內活性氧的代謝平衡和葉綠體的發育。Tian等[20]在玉米中發現,核黃素通過協同線粒體能量代謝和細胞周期來調控胚乳發育;異源過表達核黃素合成酶基因ZmRIBA1能顯著提高擬南芥的滲透脅迫耐受性。盡管有跡象顯示核黃素參與了植物非生物脅迫響應,但關于核黃素緩解非生物脅迫傷害的機制仍知之甚少。
因此,在高溫、鹽、堿、干旱等非生物逆境脅迫條件下,本研究測定了粳稻品種Kitaake和秈稻品種T98B的核黃素含量及其合成相關基因的轉錄水平,并分析了施加外源核黃素后水稻對不同逆境脅迫的響應特征,以證實核黃素是否參與了調控植物非生物逆境響應的調控,為后續分子機制研究提供重要線索和啟示。
1 材料和方法
1.1 試驗材料
選擇粳稻品種Kitaake(Oryzasativassp.japonicavar. Kitaake)和秈稻品種T98B(Oryzasativassp.indicavar. T98B)進行模擬逆境處理、核黃素含量測定、RNA提取、生理指標測定等。水稻種子保存于4 ℃冰箱,而幼苗均在人工氣候箱(Conviron,加拿大)中培養。
1.2 水稻逆境處理
選用在水培溶液[21]中正常生長14 d的Kitaake和T98B幼苗進行逆境脅迫處理。其中,逆境脅迫處理參考本課題組方法[22],包括:(1)鹽脅迫處理,140 mmol/L NaCl的水培營養液培養幼苗;(2)滲透脅迫處理(模擬干旱脅迫),20% PEG的水培營養液培養幼苗;(3)氧化脅迫處理,4 μmol/L甲基紫精(MV) 的水培營養液培養幼苗;(4)堿脅迫處理,50 mmol/L 的NaHCO3+Na2CO3水培營養液處理幼苗;(5)高溫脅迫處理,將生長于正常水培溶液中的幼苗置于45 ℃的高溫培養箱中培養。另外,在各逆境脅迫處理培養溶液中添加核黃素[15](10 μmol/L)作為平行處理,用于考察施加外源核黃素對逆境脅迫響應的影響。處理時間為6~12 d,直至出現明顯的逆境脅迫表型為止,然后進行相關指標觀測。
1.3 觀測指標及方法
1.3.1 表型和生長指標
脅迫處理結束后,觀察植株表型、測量株高和鮮重并統計存活率[21]。(1)株高:分別取脅迫處理前后的水稻幼苗(選取時間與逆境處理時間保持一致),測量從根部到莖葉頂部的高度。(2)鮮重:分別取脅迫處理前后的水稻幼苗(選取時間與逆境處理時間一致),擦干根和葉表面水分,稱取單株幼苗重量。
1.3.2 核黃素含量
參照Hiltunen等[23]的方法并加以改進,進行核黃素含量測定。主要步驟如下:稱取0.1 g植物材料,用液氮研磨,然后懸浮于0.5 mL甲醇/二氯甲烷(9∶10)中,在4 ℃溫和攪拌下孵育2 h,離心取上清待測。樣品在高效液相色譜系統1100(安捷倫,美國)上進行分析,使用Agilent HC-C18柱(高250 mm,直徑4.6 mm),以1 mL/min的速度在27 min內以水和甲醇(5%~90%)的線性梯度洗脫。用熒光法(λex= 265 nm,λem= 530 nm)檢測核黃素并用正品標準確認。
1.3.3 實時熒光定量PCR (QRT-PCR)分析
按照引物設計原則,利用軟件Premier 5.0設計核黃素合成相關基因的特異性引物(表1)。采用Trizol試劑(No.9109,TaKaRa)提取水稻幼苗的總RNA,并逆轉錄為cDNA,然后參照文獻[24]采用qRT-PCR分析核黃素合成相關基因的轉錄水平。

表1 PCR引物序列
1.3.4 生理指標
生長14 d的水稻幼苗用鹽和高溫脅迫處理0,3,5,7 d,取幼苗地上部分用于后續生理指標檢測。其中,參照 Cao等[25]的電導儀法測定水稻葉片相對電導率;采用丙二醛(MDA)含量檢測試劑盒 (BC0025;Solarbio)、過氧化氫(H2O2)含量檢測試劑盒(BC3590;Solarbio)和過氧化氫酶檢測試劑盒(S0051;Beyotime)分別測定鹽和高溫脅迫處理幼苗中的MDA和H2O2含量,以及過氧化氫酶活性。
1.4 數據分析
所有數據用平均值±標準差表示,采用SPSS23.0統計分析軟件,顯著性水平為0.05,采用GraphPad Prism 8計算機軟件作圖。
2 結果與分析
2.1 外源核黃素對水稻非生物脅迫響應的影響
Kitaake 和T98B水稻幼苗在鹽、高溫、滲透、堿和氧化等5種非生物脅迫處理6~12 d后的生長情況如圖1所示。其中,在鹽脅迫處理8 d后,Kitaake和T98B均表現出了生長受到抑制和葉片壞死等明顯的脅迫表型;施加外源核黃素(10 μmol/L)則顯著提高了T98B的耐鹽性,其幼苗存活率、高度和鮮重比鹽脅迫分別顯著提升了約75%、9%和11%,而Kitaake的改善效果不明顯(圖1,A、F);在高溫(45 ℃)處理8 d后,Kitaake 和T98B均表現出了葉片卷曲和干枯的脅迫表型,而施加外源核黃素則小幅度提高了Kitaake的高溫耐受性,而對T98B的改善效果不明顯,但是Kitaake 和T98B幼苗的鮮重均顯著增加(圖1,B、F)。在滲透脅迫處理6 d后,Kitaake 和T98B均表現出了明顯的脅迫表型,且Kitaake受傷害更嚴重;施加外源核黃素則使T98B則對滲透脅迫更敏感,尤其是幼苗存活率和鮮重顯著降低,而對Kitaake的滲透脅迫響應沒有明顯影響(圖 1,C、F)。
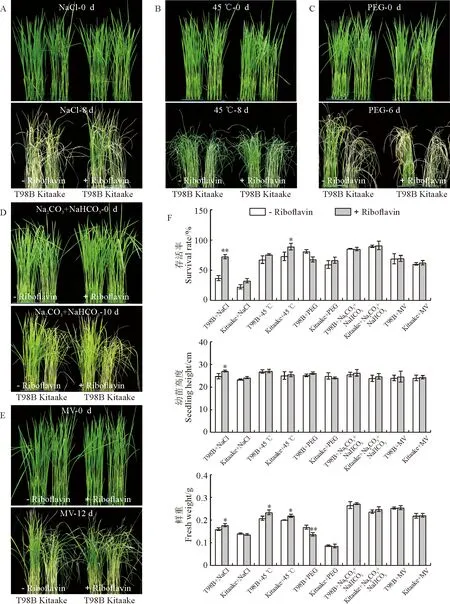
A~E. 生長14 d的粳稻Kitaake和秈稻T98B施加或不施加外源核黃素時分別進行鹽(140 mmol/L的NaCl處理8 d)、高溫(45 ℃處理8 d)、滲透(20% PEG處理6 d)、堿(50 mmol/L的NaHCO3+Na2CO3處理10 d)和氧化脅迫處理(4 μmol/L甲基紫精處理12 d)的表型分析;F. 秈稻和粳稻幼苗在不同脅迫處理下的存活率、幼苗高度和鮮重,其中的數值代表平均值±標準方差(n=40,t檢驗,*和**分別表示施加與不施加外源核黃素處理間在0.05和0.01水平存在顯著性差異)。
在堿脅迫處理10 d后,Kitaake 和T98B均表現出脅迫表型,且施加外源核黃素對脅迫表型均沒有影響(圖1,D、F)。在氧化脅迫處理12 d后,Kitaake和T98B才表現出脅迫表型,且Kitaake受傷害更嚴重;施加外源核黃素對2個材料幼苗的脅迫表型均沒有明顯影響(圖1,E、F)。這些結果說明,核黃素能明顯改善水稻對鹽和高溫的耐受性,而對氧化和堿脅迫響應沒有影響,反而提高了水稻對滲透脅迫的敏感性;同時,在逆境脅迫響應和外源核黃素作用效果方面,秈稻和粳稻亞種之間也存在一定程度的差異。總之,核黃素不同程度地參與了水稻非生物脅迫響應的調控。
2.2 非生物脅迫處理下水稻幼苗核黃素含量的變化
Kitaake和T98B水稻幼苗在鹽、滲透、高溫、氧化和堿等5種非生物脅迫處理后,分別在處理0,3,7 d取樣檢測各脅迫處理前后幼苗中核黃素的含量。檢測結果表明在遭受5種非生物逆境脅迫后,粳稻Kitaake幼苗體內的核黃素含量均不同程度升高,尤其是在鹽、滲透和高溫脅迫下核黃素含量升高最為明顯,在處理7 d時分別為未處理時的9,5,7倍(圖2)。同樣,秈稻品種T98B在遭受5種非生物脅迫后體內核黃素含量也呈不同程度的升高,但是在滲透和堿脅迫下的升高不顯著(圖 3)。以上結果說明,鹽、高溫和氧化等非生物脅迫均能顯著促進水稻體內核黃素的合成和積累,滲透和堿脅迫也能不同程度促進核黃素的合成和積累,但是在秈稻和粳稻亞種間存在較大差異。值得說明的是,粳稻Kitaake的核黃素合成受逆境脅迫促進程度較秈稻T98B更為顯著。因此,筆者猜測核黃素參與了水稻對這些非生物脅迫響應的調控。為了進一步研究核黃素參與脅迫響應的調控,后續研究主要聚焦于對促進核黃素合成最為顯著的鹽和高溫脅迫。
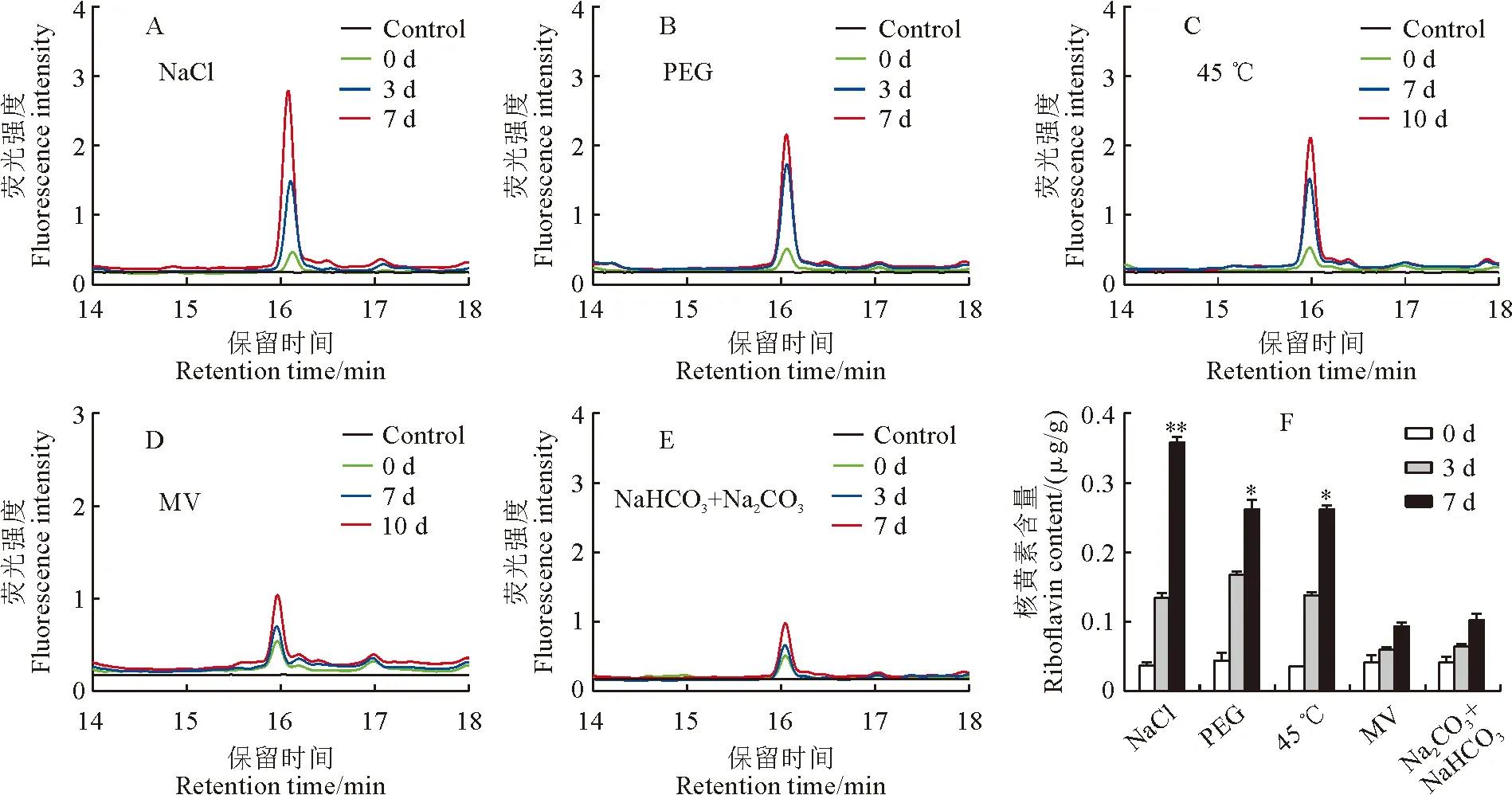
A~E. 鹽(140 mmol/L的NaCl)、滲透(20% PEG)、高溫(45 ℃)、氧化脅迫處理(4 μmol/L甲基紫精)和堿(50 mmol/L的NaHCO3+Na2CO3)處理下水稻幼苗體內核黃素熒光強度;F. 各個脅迫處理前后幼苗核黃素含量,其中的數值代表平均值±標準方差(n=3,t檢驗,* P <0.05,** P <0.01)。下同。
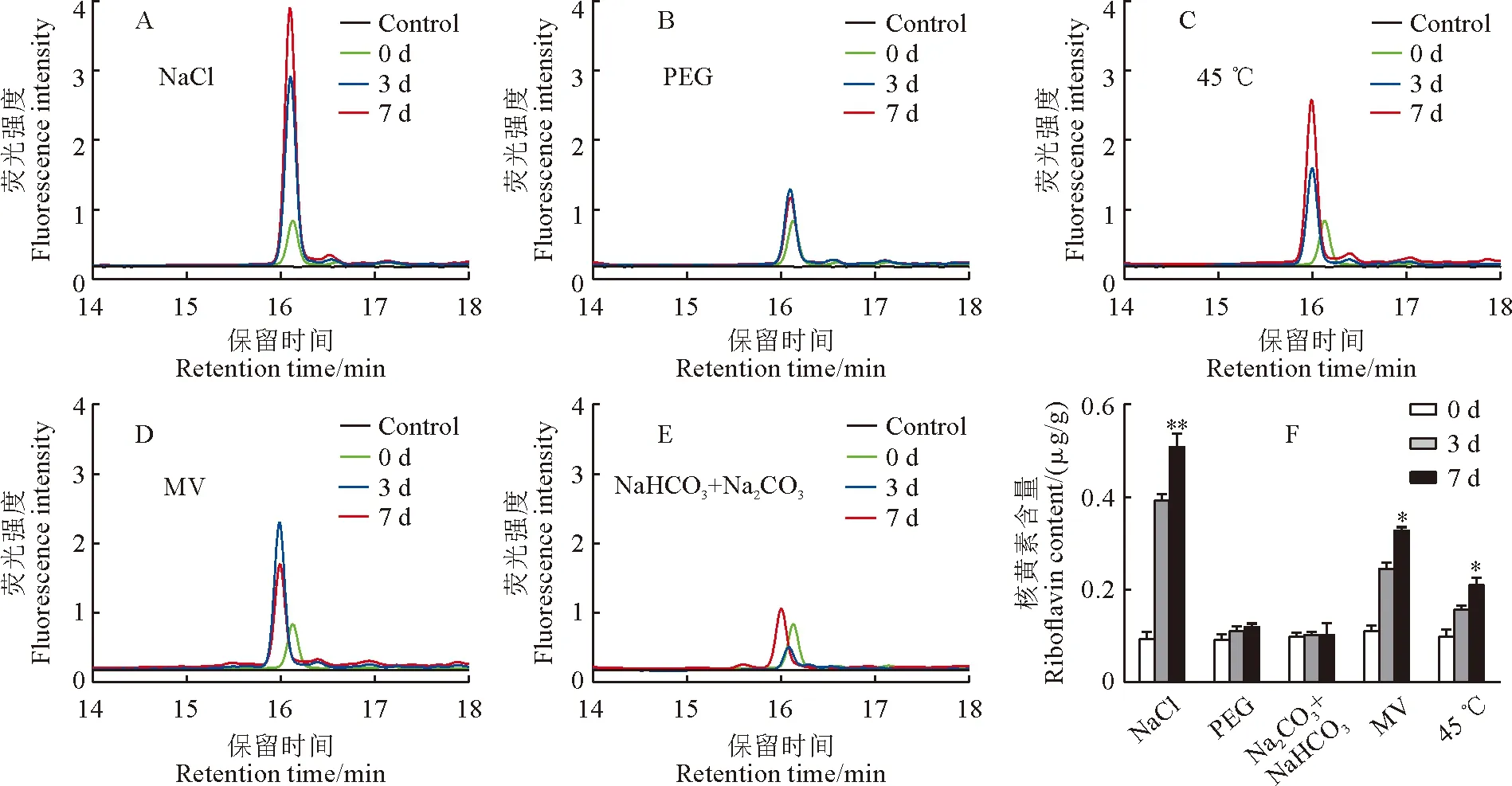
圖3 秈稻T98B幼苗在不同非生物脅迫下核黃素熒光強度和含量變化
2.3 鹽和高溫脅迫對水稻核黃素合成相關基因表達的影響
通過生物信息學和序列同源性分析,筆者從水稻基因組中找到與核黃素合成代謝相關的8個基因(Os05g0460600、Os02g0572400、Os08g0481950、Os03g0117200、Os04g0177400、Os12g0541000、Os04g0497400、Os03g0801700)。其中,Os05g0460600、Os02g0572400和Os08g0481950編碼ribA(鳥苷三磷酸合成酶);Os03g0117200和Os04g0177400編碼ribD(5-氨基-6-核糖氨基-2,4(1H,3H)-嘧啶二酮);Os12g0541000編碼ribE(5-氨基-6-核糖氨基-2,4(1H,3H)-嘧啶二酮-5′-磷酸);Os04g0497400編碼ribH(6,7二甲基-8-核糖二羥基蝶啶);Os03g0801700編碼FADs(FAD合成酶)。將Kitaake和T98B幼苗進行鹽和高溫處理7 d,然后測定8個核黃素合成相關基因在脅迫處理前后的轉錄水平。qRT-PCR結果表明,在鹽和高溫脅迫下水稻大部分核黃素合成相關基因的表達量均不同程度上調(圖4)。
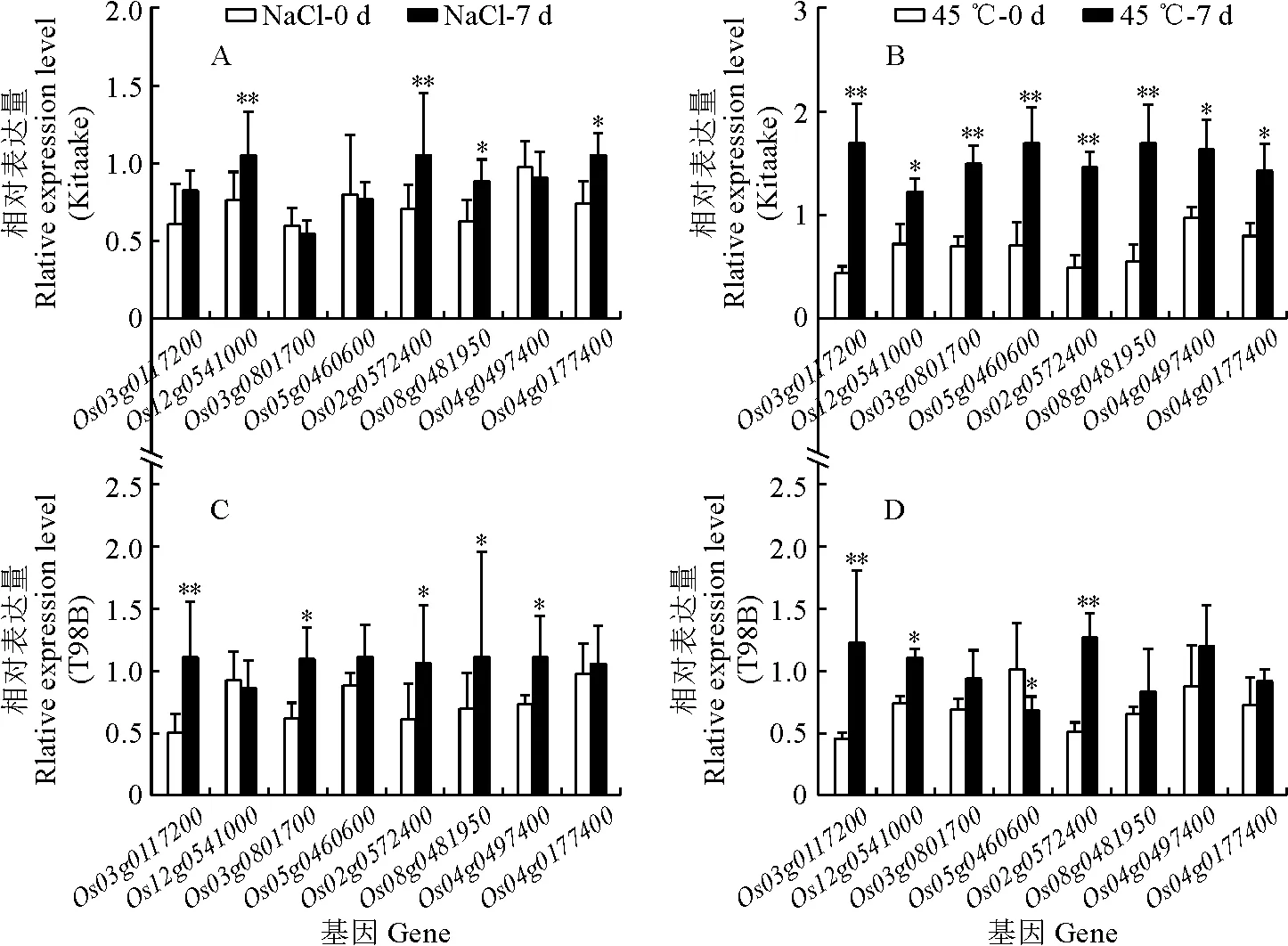
*和**分別表示處理前后在0.05和0.01水平有顯著性差異。
其中,在高溫脅迫下,Kitaake中8個基因均顯著上調,而T98B中僅3個基因顯著上調;在鹽脅迫下,Kitaake和T98B中的上述基因表達變化趨勢基本類似。這些結果說明,鹽和高溫脅迫能誘導核黃素合成基因的表達,從而促進核黃素在水稻體內的合成和積累。同時也可以看出,秈稻和粳稻在響應高溫脅迫時,其核黃素合成基因的表達有明顯差別,粳稻的上調幅度更大,說明粳稻對高溫脅迫較秈稻更敏感。
2.4 核黃素對鹽和高溫脅迫下水稻幼苗生理變化的影響
水稻受到非生物脅迫后,體內一些基本的生理指標如相對電導率、MDA、H2O2含量以及過氧化氫酶(CAT)的活性等會出現紊亂,并能反映出植物體所受的傷害程度。Kitaake和T98B幼苗在鹽和高溫脅迫下這些生理指標測定結果(圖5)表明,在未進行鹽和高溫處理時,水稻幼苗的相對電導率沒有明顯的差異;施加外源核黃素后,除了在T98B的高溫脅迫中沒有效果外,均能有效降低其余處理、水稻幼苗相對電導率(圖 5,A、B)。同樣,核黃素除了在T98B的鹽脅迫中沒有明顯效果外,均能有效降低其余處理、材料幼苗的MDA含量(圖 5,C、D)。這些結果說明,核黃素能有效降低鹽和高溫脅迫對細胞膜的傷害,提高水稻的逆境耐受性,且該結果與前面的幼苗存活率測定結果(圖1,A、B和F)一致。
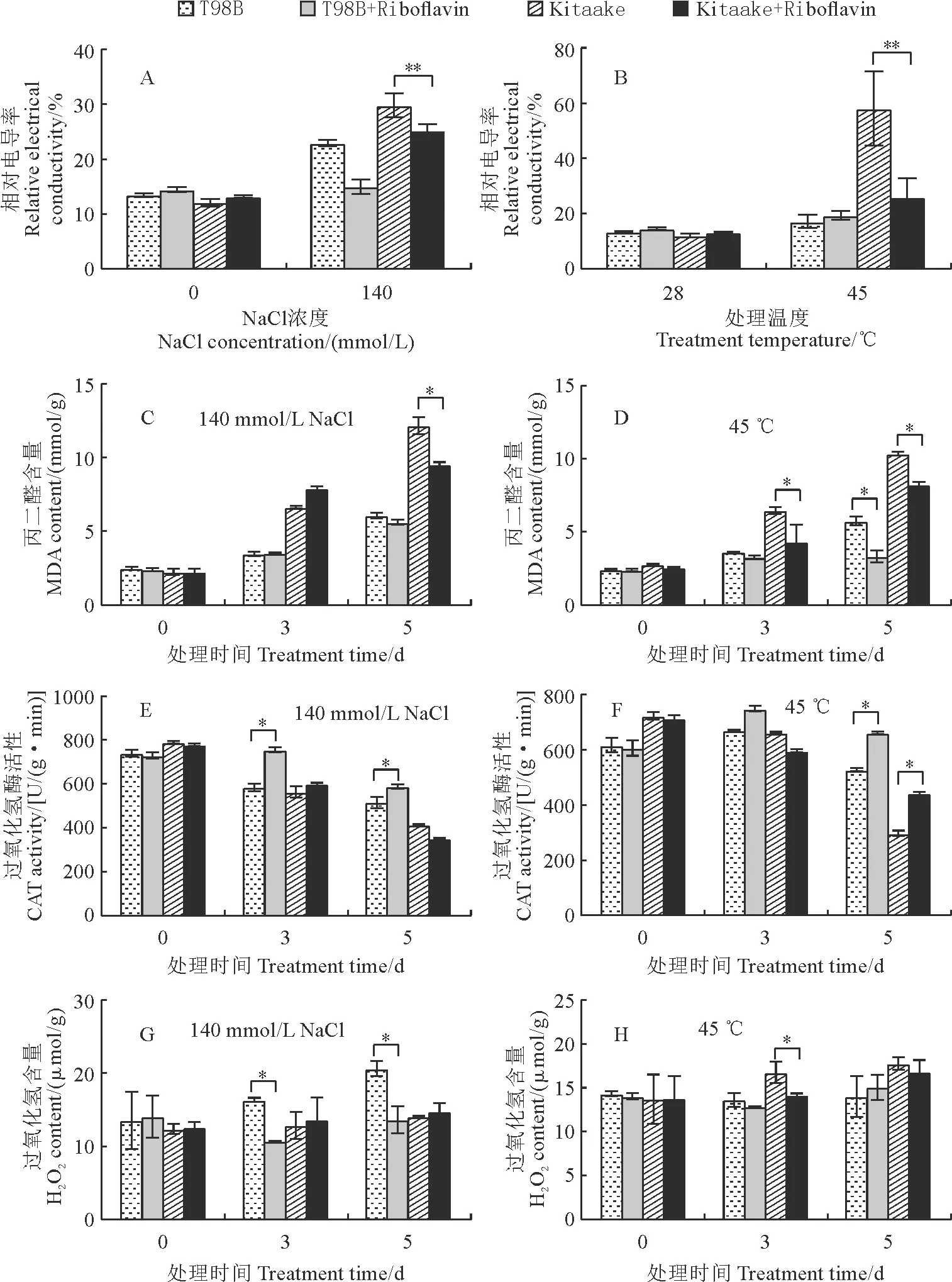
圖5 水稻幼苗在140 mmol/L NaCl(C,E,G)和45 ℃高溫(D,F,H)脅迫下生理指標的變化
另外,植物在逆境下會積累活性氧如H2O2,若不及時清除會導致嚴重的氧化損傷。過氧化氫酶在逆境H2O2的清除中起著重要作用。Kitaake和T98B幼苗過氧化氫酶活性和H2O2含量測定顯示,核黃素能有效提高鹽和高溫脅迫下水稻體內的過氧化氫酶活性,并降低其體內H2O2含量(圖 5,E~H)。
該結果說明,核黃素能提高水稻體內活性氧清除酶的活性,降低體內活性氧的積累,減輕或消除因鹽和高溫脅迫而導致的氧化損傷。總之,在鹽和高溫等逆境脅迫下,水稻通過促進體內核黃素的合成和積累來改善逆境脅迫的耐受性。
3 討 論
植物本身可以合成核黃素,且主要以酶輔因子FMN和FAD的形式參與許多體內的生化過程[12-13]。Ouyang等[26]和Hedtke等[27]發現核黃素缺乏會導致擬南芥的葉色異常。最近,Hu等[19]發現核黃素影響水稻細胞分裂素的穩態和葉綠素的合成,進而調控葉綠體和葉色的形成。Tian等[20]發現核黃素通過協同線粒體能量代謝和細胞周期來調控玉米胚乳發育。本研究分析了外源核黃素對秈稻和粳稻響應鹽、滲透、高溫、氧化和堿等5種非生物脅迫的影響,同時分析了這些逆境脅迫對水稻體內核黃素合成的影響。研究發現,施加外源核黃素能夠提高水稻對鹽和高溫脅迫的耐受性,且5種逆境脅迫均能不同程度地促進核黃素在水稻中的積累,尤其鹽和高溫脅迫的促進效果最明顯。隨后的qRT-PCR分析發現,鹽和高溫脅迫能顯著誘導水稻幼苗中大部分核黃素合成相關基因的表達,進一步證實鹽和高溫脅迫能促進核黃素在水稻體內的合成和積累。值得指出的是,高溫脅迫下核黃素合成基因的表達在粳稻中上調幅度更大,說明粳稻對高溫脅迫較秈稻更敏感。在生產中,粳稻適于在北方溫帶地區栽培,而秈稻適于南方熱帶和亞熱帶地區栽培,就已說明粳稻較秈稻對高溫更敏感,這與本研究結果高度一致。進一步的生理指標檢測發現,核黃素能提高鹽和高溫脅迫下水稻體內的過氧化氫酶活性,并降低其體內H2O2含量。Hu等[19]最近也發現核黃素合成關鍵酶之一的二氧四氫喋啶合成酶的缺失,會導致水稻體內核黃素合成下降和活性氧積累。這些結果均說明,核黃素能通過促進體內活性氧的清除,消除氧化損傷,提高植物的逆境脅迫耐受性。
同時,核黃素對植物脅迫響應的影響存在較大差異。在研究中發現,核黃素能顯著提高水稻的耐鹽性,而對耐堿性沒有影響。雖然在粳稻Kitaake中,堿脅迫也能一定程度提高核黃素合成基因的表達,但是外源核黃素并沒有改良其耐堿性。筆者認為可能的原因與核黃素自身的理化性質有關。核黃素微溶于水且溶液易變質[28],在堿性溶液中或遇光變質,在鹽溶液中溶解性提高。在鹽脅迫下,由于核黃素溶解度提高,使其能充分參與調控鹽脅迫響應,提高水稻耐鹽性。在堿脅迫條件下,由于溶解度低或結構被破壞,從而無法參與調控堿脅迫響應。另外,筆者也推測在氧化脅迫條件下,可能造成了核黃素的結構破壞,使其無法在氧化脅迫響應中發揮作用。本研究中核黃素除了在鹽脅迫下能改善T98B的幼苗高度外,對于其余處理幼苗高度的影響不明顯,可能是核黃素的濃度還沒有達到促進幼苗生長的程度。當然,這些猜測還有待進一步研究和證實。雖然滲透脅迫(模擬干旱)能促進核黃素在水稻體內的合成,但是外源施加核黃素卻提高了水稻對滲透脅迫的敏感性,意味著核黃素負調控水稻的滲透或干旱脅迫耐受性。最近,Tian等[20]將玉米核黃素合成酶基因ZmRIBA1異源過表達于擬南芥,發現核黃素合成增加,并改善了轉基因植株的滲透脅迫耐受性。這些結果說明,核黃素參與滲透或干旱脅迫響應的機制與其他非生物脅迫響應不同,而且在不同物種間還存在差異,但其背后的分子機制尚不清楚,仍需要進一步研究。
總之,本研究初步證實核黃素在水稻的非生物脅迫響應中發揮著重要作用。特別是發現,核黃素正調控水稻鹽和高溫脅迫的耐受性,而負調控滲透或干旱脅迫耐受性。該研究結果為進一步探究核黃素參與非生物脅迫響應的分子機制提供了線索,也為耐逆水稻的培育提供了啟示。

