鹽膚木體細胞胚胎發生及植株再生
楊慶敏,尹飛飛,龔 清,楊 洋,桑子陽,劉 文*
(1 三峽區域植物遺傳與種質創新重點實驗室[三峽大學]/三峽大學 生物技術研究中心,生物與制藥學院,湖北宜昌 443002;2 五峰博翎種業有限公司,湖北五峰 443413)
鹽膚木是漆樹科(Anacardiaceae)鹽膚木屬(Rhus)落葉小喬木,因其種子表面會泌鹽而得名。鹽膚木葉翅受五倍子蚜蟲取食誘導可形成中藥五倍子,故又稱五倍子樹,我國除新疆、青海外,各地區均有分布[1]。鹽膚木果實、木上之鹽可食用,周身可入藥,研究表明,其具有抗菌、抗病毒、降壓、降血糖,抗炎等藥用功效[2],臨床上已用于冠心病[3]、結腸癌[4]、糖尿病[5]等的治療研究。鹽膚木及五倍子經濟價值高,除在醫藥方面的應用,在農業、化工等方面也運用廣泛,市場需求大[6]。鹽膚木花是良好的蜜源,鹽膚木還可作為觀葉、觀果的景觀樹種,運用于園林綠化中;此外,鹽膚木還是植被恢復的先鋒物種和重金屬吸附植物,可用于環境保護[7]。目前,鹽膚木相關研究集中的化學成分[8]、藥用價值[9]、抗逆性[10]、人工栽培[11]等方面,其中鹽膚木的人工栽培多是通過播種育苗來繁育種苗。隨著五倍子產業的發展,生產上需要大量的優質鹽膚木種苗,然而鹽膚木選育歷史短,品種缺乏,市場上種苗質量參差不齊,加之種子育苗方法難以保存親本的優良性狀,且繁殖周期長,生產所需的大量優質鹽膚木種苗已成為制約五倍子產業發展的瓶頸[12]。當前,組織培養技術,尤其是體細胞胚胎發生技術在林木良種繁育中的應用越來越受到重視。鹽膚木組織培養研究中已有器官發生途徑的報道,吳麗芳等[13]通過鹽膚木子葉、子葉節、下胚軸節段成功誘導出不定芽并實現其再生。但是,鹽膚木體細胞胚胎發生及植株再生體系尚未見報道。
體細胞胚胎發生(somatic embryogenesis,SE)是指植物體細胞在沒有經過生殖細胞融合的情況下,模擬有性的合子胚胎發生過程,經歷原胚期、球形胚、心形胚、魚雷胚、子葉胚而發育形成完整植株的過程,其原理是植物細胞全能性[14]。已報道楸樹[15]、杉樹[16]、松樹[17]、油茶[18]等多種木本植物通過體細胞胚胎發生途徑獲得再生植株。體細胞胚胎發生具有數量多、速度快、結構完整、再生率高等特點[19]。體細胞胚比受精卵更容易獲得和批量生產,因此體細胞胚胎發生體系的建立和研究,不僅有利于植物規模化繁育,也有利于了解合子胚發生的相關機制。此外,體細胞胚胎還可以用于制作人工種子,不僅可節約大量種子,也可固定雜種優勢[20]。因此,建立鹽膚木體細胞胚胎發生及植株再生體系可以為鹽膚木種苗繁育問題提供有效的技術手段,并可為鹽膚木遺傳轉化體系的建立奠定重要基礎。
本研究以鹽膚木幼胚為外植體,通過探討不同種類和不同濃度的植物生長調節劑對鹽膚木愈傷組織誘導及體細胞胚胎發生的影響,建立了鹽膚木體細胞胚胎發生及植株再生體系。該體系的建立將為鹽膚木種質資源保存和優良品種快速繁殖提供重要途徑,也將為其遺傳轉化和生物技術育種奠定基礎。
1 材料和方法
1.1 試驗材料
研究所用的鹽膚木材料取自湖北省五峰土家族自治縣內野生植株。于2020年9月上旬采集未成熟的鹽膚木種子,置于4 ℃冰箱保存備用。
1.2 外植體消毒
未成熟種子用洗潔精洗去表面的油脂后流水沖洗30 min;隨后,在超凈工作臺中用75%酒精浸泡種子30 s,無菌水沖洗5遍;之后設置不同滅菌時間(8,9,10,11,12,13 min)用0.1%升汞進一步滅菌;最后用無菌水清洗5次,無菌濾紙吸干表面水分。剝去種皮后,將幼胚接種到愈傷誘導培養基中,黑暗培養[培養溫度為(25±2) ℃]1周后統計污染率,污染率=污染外植體個數/接種外種植總數×100%。
1.3 鹽膚木幼胚愈傷組織誘導
將消毒滅菌好的幼胚接種在添加2,4-D(0,0.5,1.0,2.0,3.0 mg/L)和6-BA(0,0.1,0.2,1.0 mg/L)的MS培養基中,以不加任何激素的MS基本培養基為對照。每皿接種16個外植體,每種培養基接種10個皿,每個處理總共160個外植體,暗培養15 d后統計愈傷誘導率,愈傷誘導率=產生愈傷的外植體個數/接種外種植總數×100%。
1.4 胚性愈傷組織誘導及增殖培養
胚性愈傷組織誘導的培養基為1/2 MS中添加6-BA(0.1,0.5,1.0,2.0 mg/L)和NAA(0.01,0.10,0.50,1.00 mg/L),以不加任何激素的1/2 MS培養基為對照。每個培養皿中轉接16個大小均一的初代愈傷,每組試驗10個培養皿,光照培養[光照強度2 000 lx,光周期為12 h光照/12 h黑暗,培養溫度為(25±2) ℃]30 d后觀察胚性愈傷誘導情況。篩選胚性愈傷最適增殖培養基時,在超凈工作臺中稱取約1 g的胚性愈傷組織接種在胚性愈傷組織增殖培養基中,光照培養30 d后再次稱重,統計不同培養基胚性愈傷增殖倍數(愈傷增殖倍數=增殖培養后愈傷組織質量/增殖培養前愈傷組織質量×100%),篩選出最佳愈傷組織增殖培養基。
1.5 體細胞胚胎誘導
選取生理狀態一致的胚性愈傷進行體細胞胚胎誘導,包括:基本培養基1/2 MS,植物生長調節劑為6-BA(2,4,6 mg/L)、NAA(0.05,0.10,0.50 mg/L)和蔗糖(3%,4%,5%,6%,7%,8%)。每個培養瓶中轉接8個大小均一的胚性愈傷組織,每種培養基10瓶,光照培養30 d后統計體細胞胚胎誘導率,體細胞胚胎誘導率=體細胞胚胎發生的愈傷個數/接種胚性愈傷總數×100%。
1.6 植株再生
選取處于子葉胚時期生長狀況良好的成熟體細胞胚胎,轉移到不添加任何激素的1/2 MS培養基中,光照培養,觀察并記錄其生長狀況,待其生長形成完整植株后,進行煉苗移栽。
1.7 細胞學鑒定
取各時期的愈傷組織用70%的FAA固定液固定48 h后抽氣;然后以80%、85%、90%、95%、100%乙醇分別脫水2 h;隨后將材料放入二甲苯中透明3 h;之后將材料用60℃純石蠟浸泡3次,時間分別為1 h、1 h、2 h;浸蠟后對其包埋和切片,切片厚度為8 μm。染色時在通風櫥中先將切片浸入二甲苯5 min,重復3次進行脫蠟;隨后逐步放入100%、95%、85%、70%乙醇中復水15 min、5 min、3 min、5 min;最后用蒸餾水浸泡2 min。用高碘酸鉀—錫夫試劑—萘酚黃染色法染色,具體步驟為:0.5%高碘酸鉀20 min、自來水5 min、蒸餾水2 min、schiff試劑30 min、漂洗液漂洗3次,分別2 min、自來水5 min、蒸餾水2 min、萘酚黃S 10 min、蒸餾水2 min、70%乙醇2 min、95%乙醇2 min、100%乙醇4 min、二甲苯5 min,最后用加拿大中性樹脂封片。利用顯微鏡(Nikon ECLIP80i)對石蠟組織切片進行觀察并拍照。
1.8 數據處理與分析
用SPSS 22.0軟件對數據進行統計分析,并用Origin軟件制圖。
2 結果與分析
2.1 滅菌方式對外植體污染率的影響
為了篩選得到鹽膚木未成熟種子最適的表面消毒條件,設置不同的升汞滅菌時間梯度。結果如表1所示,鹽膚木未成熟種子通過75%酒精消毒30 s,無菌水清洗5次,0.1%升汞滅菌10 min,無菌水清洗5次后,即可達到零污染率,且外植體不會褐化影響后續愈傷組織的誘導。
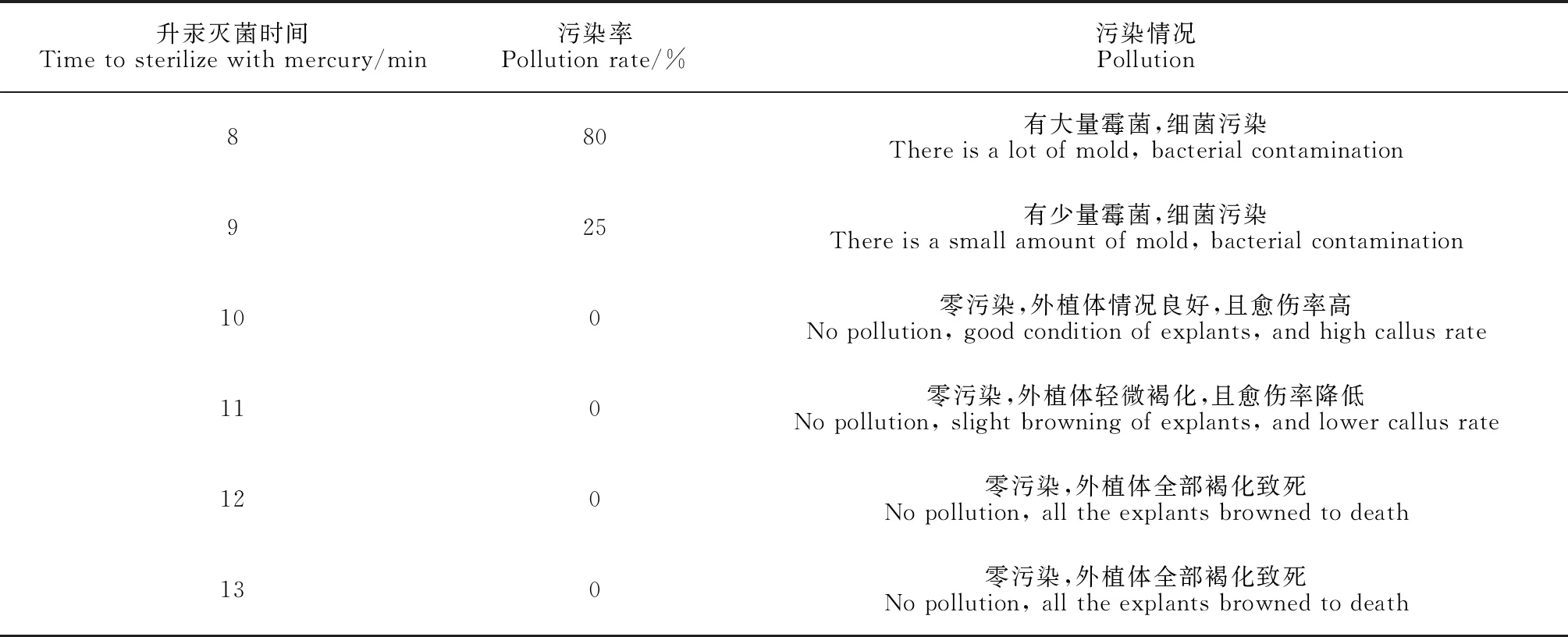
表1 滅菌時間對外植體的影響
2.2 6-BA與2,4-D對愈傷組織誘導的影響
鹽膚木愈傷組織誘導情況如圖1所示,鹽膚木幼胚在愈傷誘導培養基中5~8 d即可誘導出初代愈傷組織(圖1,a),為淡黃色疏松水漬狀的非胚性愈傷。

a.非胚性愈傷組織;b. 1 g胚性愈傷組織;c.增殖后的8.55 g胚性愈傷組織;GE.球形胚;HE.心形胚;TE.魚雷胚;CE.子葉胚;d~g.各時期體胚;h.再生植株;i.移栽入基質的再生苗。標尺為0.2 cm。
其中誘導率和愈傷組織生長狀況如表2所示,當6-BA濃度為0.2 mg/L時,愈傷誘導率普遍較高,其中當2,4-D為1 mg/L時愈傷誘導率最高,為(84.57±2.66)%;在只含2,4-D的培養基中,愈傷組織表面產生少量不定芽;未添加任何激素的對照未誘導出愈傷組織,而是直接萌發成苗。總體來說,培養基A5、A6、A7與A8誘導率較高,而A6顯著高于其他組合。結合愈傷誘導率和愈傷組織的形態及后續的生長狀況看,A6:MS+2,4-D 1 mg/L+6-BA 0.2 mg/L是最適合鹽膚木幼胚誘導愈傷組織的培養基。
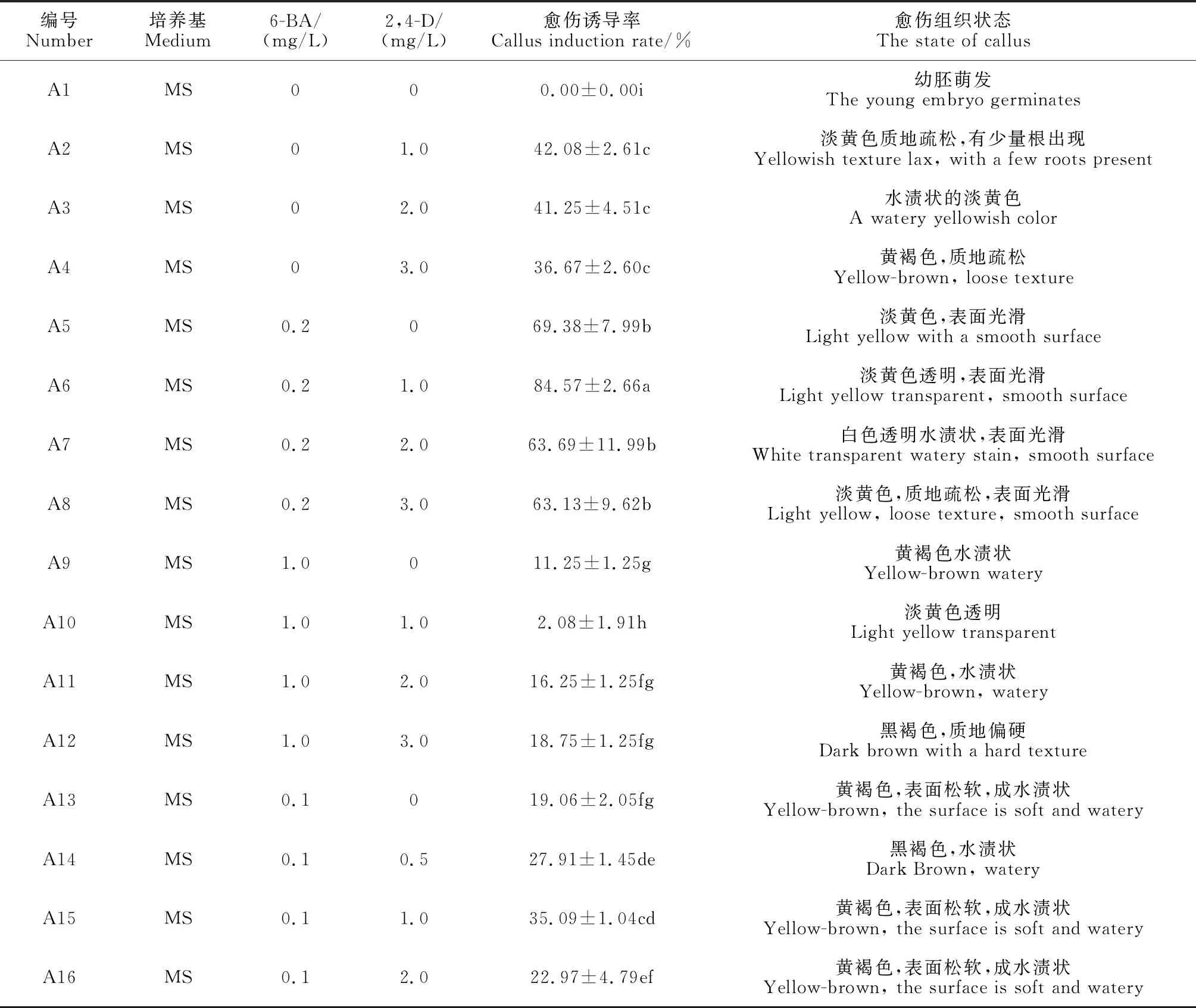
表2 不同濃度6-BA、2,4-D對愈傷組織誘導的影響
2.3 6-BA與NAA對胚性愈傷組織誘導及增殖的影響
誘導出的初代愈傷組織轉接至胚性愈傷誘導培養基中培養3 d后變成黑褐色的愈傷組織,并在15 d后從黑色的愈傷組織上長出淡黃色緊密的胚性愈傷。
由于各激素濃度下初代愈傷都能轉變為胚性愈傷,所以對胚性愈傷組織的誘導不做最佳條件探究。探索胚性愈傷組織最適增殖培養基結果如表3所示,接種1 g淡黃色的胚性愈傷(圖1,b)在B14培養基組合中,增殖培養30 d后胚性愈傷組織可達8.55 g,增殖倍數最大,為(854.73±14.06)%,愈傷組織呈黃褐色,狀態好(圖1,c)。結合胚性愈傷組織生長狀態及后續的分化狀況看,B14(1/2 MS+NAA 0.5 mg/L+6-BA 2 mg/L)是最適合鹽膚木胚性愈傷組織增殖的培養基。

表3 不同濃度6-BA、NAA對胚性愈傷組織增殖的影響
2.4 激素和蔗糖對體細胞胚胎誘導的影響
2.4.1 不同濃度6-BA和NAA對體胚誘導的影響
探究6-BA與NAA配比對體胚誘導的影響,結果如表4所示:當6-BA濃度不變時,最適NAA濃度0.5 mg/L,固定NAA濃度0.5 mg/L時,提高6-BA濃度均不能誘導出體細胞胚胎。推測出現以上差異的原因可能來源于生長素與分裂素比例不同:在C1到C5中6-BA與NAA的比例分別為40、20、4、8、12,比例太高不利于體細胞胚胎誘導,只有當6-BA與NAA的比例為4時,才能誘導出體細胞胚胎。

表4 不同濃度6-BA、NAA對體細胞胚胎誘導的影響
2.4.2 不同蔗糖濃度對體細胞胚胎誘導的影響
蔗糖可以作為培養基中的能源物質,為細胞、組織等提供碳源;蔗糖還是一種滲透調節物質,能通過改變培養基中的滲透壓、制造脅迫環境來誘導體細胞胚胎的發生[21]。本研究探究不同蔗糖濃度對鹽膚木體細胞胚胎發生的影響,結果(表5)表明,將培養基中蔗糖濃度從3%提高到4%時,鹽膚木體細胞胚胎發生率從(18.47±1.40)%提高到(32.67±4.75)%,誘導得到的體細胞胚胎如圖1,d~g所示;而如果進一步提升蔗糖濃度,則胚性愈傷組織生長狀態越來越差,直至死亡。

表5 蔗糖對體細胞胚胎誘導影響
2.5 植株再生
培養基1/2 MS+6-BA 2 mg/L+NAA 0.5 mg/L+蔗糖4%中培養30 d后形成的成熟體細胞胚放置到不含任何激素的1/2 MS培養基中繼續培養,1個月后可觀察到再生苗生根(圖1,h),待再生苗生長至3~5 cm時,轉入泥炭土∶蛭石∶珍珠巖為2∶1∶1的基質中能穩定成活(圖1,i)。
2.6 鹽膚木體細胞胚胎發生的細胞學觀察分析
對鹽膚木體細胞胚胎的不同發育時期材料,利用體視顯微鏡進行組織學觀察,并利用石蠟切片進行細胞學觀察,以進一步明確其胚胎發生過程。體式顯微鏡觀察發現鹽膚木非胚性愈傷組織呈白色透明、水漬狀偏軟(圖1,a),組織切片觀察發現其細胞大小無規則、排列疏松、不易被染色、幾乎不存在淀粉粒(圖2,a)。胚性愈傷組織呈淺黃色或黃褐色、疏松狀、分裂旺盛(圖1,b和圖1,c),組織切片觀察發現其細胞整齊緊密排列、細胞內含有大量的淀粉粒,且淀粉粒小而分散(圖2,b)。觀察到鹽膚木體細胞胚胎發生的整個過程,包括球形胚(圖2,c)、心形胚(圖2,d)、魚雷胚(圖2,e)、子葉胚(圖2,f)等不同發育時期。
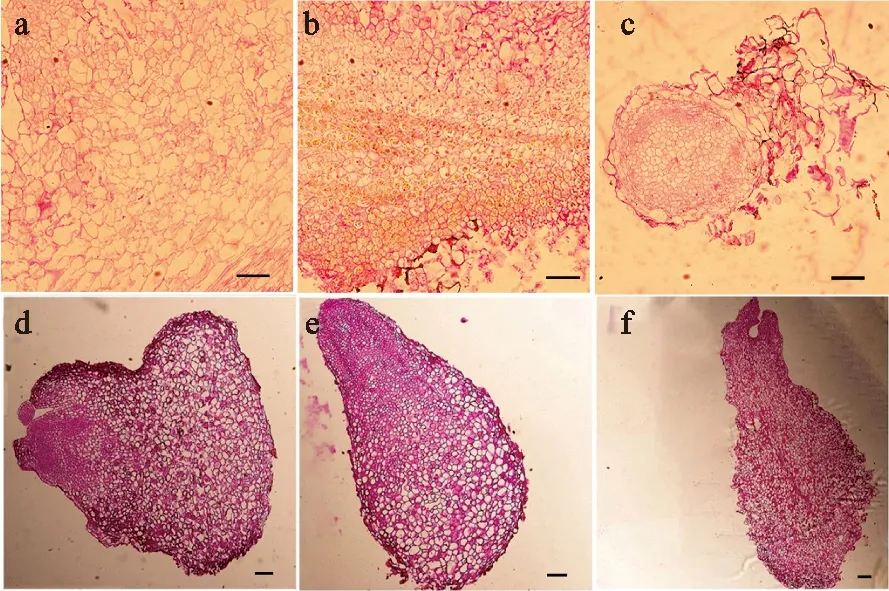
a.非胚性愈傷;b.胚性愈傷;c.球形胚;d.心形胚;e.魚雷胚;f.子葉胚。圖中標尺為100 μm。
3 討 論
植物激素是誘導植物愈傷組織形成的關鍵因素[22]。本研究發現,植物激素與鹽膚木幼胚的發育命運息息相關,只有添加一定濃度的6-BA和2,4-D時鹽膚木幼胚才能誘導形成愈傷組織(圖1,a);不添加時,鹽膚木幼胚會直接萌發。姜治國等[23]以三葉木通幼胚為外植體,也出現類似情形。許多物種體細胞胚胎發生的研究表明,細胞分裂素在體細胞胚胎誘導中主要是在細胞分化、體細胞胚胎發育方面起作用,生長素主要是在細胞分裂方面起作用[24]。培養基中添加6-BA 0.2 mg/L和NAA 0.05 mg/L時,楸樹體細胞胚胎誘導率最高可達59.8%[25]。在本研究中,培養基中添加6-BA 2 mg/L和NAA 0.5 mg/L時,鹽膚木體細胞胚胎誘導率為18.47%。雖然6-BA和NAA的組合處理能誘導多種植物體胚的形成,但是不同植物所需的最適濃度并不相同,這或許是存在基因型差異及取樣時間差異造成的。有研究發現,內源IAA含量上升或保持在較高的濃度是胚性細胞出現的一個共同標志[26],內源ABA含量升高有利于植物體胚發生與成熟[27]。后續可以對鹽膚木體胚發生過程中各時期愈傷組織的內源激素含量進行測定,為鹽膚木體細胞胚發生的激素調控提供理論依據,也可進一步從分子水平揭示鹽膚木體胚發生機制。
研究表明脅迫是誘導體胚發生的重要因子。PEG、ABA、高濃度蔗糖等被稱為與植物細胞獲得胚胎發生能力的脅迫相關物質[28]。Kato等人[29]以鴨兒芹幼苗的莖尖為外植體,用0.7 mol/L蔗糖作為高滲脅迫處理,有效地誘導了體細胞胚胎的發生;在萬壽菊體細胞胚胎發生研究中,發現添加4.5%蔗糖促進體細胞胚胎發育與成熟[30];唐靜儀對鐵皮石斛進行體胚發生研究時,發現6%的蔗糖和一定濃度的ABA結合使用,可使體胚產量高達59%[31]。但是,添加高濃度蔗糖有可能誘發畸形胚。張煥玲在栓皮櫟的體胚成熟試驗中發現提高蔗糖濃度時畸形胚的誘導率也隨之升高[32]。本研究探索蔗糖濃度對鹽膚木體細胞胚胎發生的影響,發現當蔗糖濃度由3%提升到4%時更有利于其體細胞胚胎的形成,但是蔗糖濃度繼續升高則抑制體細胞胚胎形成(表5),說明適當提高蔗糖濃度對鹽膚木體細胞胚胎形成有促進作用,后續可以繼續嘗試用不同濃度PEG或ABA對胚性愈傷組織進行脅迫處理,從而優化鹽膚木體胚發生體系。
Wang等在對紅掌體胚發生研究中發現較低濃度的植物激素、礦物質營養促進紅掌體胚的發生,甚至營養減少用1/8 MS和無激素培養基更適用于體胚萌發[33]。另有研究發現液體培養基和半固體培養基培養對體胚發生和成熟也有影響,液體培養基的懸浮培養在振蕩作用下有更好的簇解離效果,且液體培養條件下組織更多地暴露于培養環境以及有更好的通風,這都有利于椰棗體胚的產生[34]。同樣方法是否適用于鹽膚木的體胚發生也有待進一步研究。
細胞學觀察是區分體細胞胚胎再生階段的重要手段[14]。本研究通過石蠟切片觀察到鹽膚木體細胞胚胎發生的整個過程與大多數植物體細胞胚胎發生過程一致,經歷球形胚、心形胚、魚雷胚和子葉胚等時期。組織染色結果顯示,鹽膚木胚性愈傷組織中積累了較多的淀粉粒,這為體細胞胚胎的后續發育及成熟儲存一定的物質和能源。植物體細胞胚胎發生存在內起源、外起源以及內起源與外起源同時發生的雙起源方式。貓兒屎[35]、洪平杏[36]、花櫚木[37]等是以雙起源方式為主,荔枝[38]、三葉木通[39]等是以外起源方式為主。石蠟切片染色發現鹽膚木體細胞胚是在愈傷組織表面發起的(圖2,c),在愈傷組織內并沒有見到體細胞胚胎的發生,表明鹽膚木體細胞胚胎起源方式為外起源方式。從形態學和組織細胞學的層面,系統地觀察體細胞胚胎發生發育的全過程,不僅有利于揭示細胞全能性以及體細胞胚胎的起源,也可為建立體細胞胚胎再生形式的高效遺傳轉化體系提供細胞學依據。
本論文以鹽膚木幼胚為外植體,建立了鹽膚木體細胞胚胎發生及植株再生體系,但由于體細胞胚胎誘導率不高,后續可進一步優化條件,提高其體細胞胚胎發生率并建立工廠化繁育技術體系,同時,在此基礎上,可進一步建立鹽膚木遺傳轉化體系,為鹽膚木種質創新提供平臺,這些對五倍子產業發展具有重要意義。

