基于FAERS數據庫的巴瑞替尼不良反應的信號挖掘與分析
駱巧,李剛
[1.錦州醫科大學十堰市人民醫院研究生培養基地,湖北 十堰 442000;2.湖北省十堰市人民醫院,湖北 十堰 442000]
Janus 激酶(Janus kinases,JAKs)是一種多結構域非酪氨酸激酶受體,在細胞信號轉導中具有關鍵作用。可以通過使用JAK 抑制劑靶向JAK 相關途徑以治療血液腫瘤學、風濕病學、皮膚病學、胃腸病學等系統疾病[1]。巴瑞替尼,商品名為艾樂明、Olumiant,是一種選擇性JAK 抑制劑,于2018 年5 月在美國獲批上市,2019 年6 月在中國獲批上市[2];目前可用于類風濕關節炎(rheumatoid arthritis,RA)、系統性紅斑狼瘡(systemic lupus erythematosus,SLE)、特應性皮炎、斑禿、腫瘤等疾病的治療[3-6]。日本和美國別于2021 年4 月、2022 年5 月批準該藥用于新冠肺炎(COVID-19)的治療[7-8]。巴瑞替尼常見的不良反應包括感染、靜脈血栓栓塞、惡性腫瘤、消化道穿孔等[9]。因巴瑞替尼在我國臨床上使用時間較短,安全性研究的數據較少,本文擬對美國FDA不良事件報告系統(FDA Adverse Event Reporting System,FAERS)數據庫中巴瑞替尼的不良事件(adverse drug event,ADE)進行統計分析,為該藥的安全合理使用提供參考。
1 資料與方法
1.1 數據來源
在OpenVigil 2(https://openvigil.sourceforge.net/)中,以藥品名稱“Baricitinib”和“Olumiant”為關鍵詞檢索FAERS 中2015 年1 月1 至2022 年9 月1 日所有數據,剔除重復報告,得到以巴瑞替尼單藥為首要懷疑藥物的ADE 報告共6 344 例。
1.2 數據標準化
本研究采用國際醫學用語詞典(Medical Dictionary for Regulatory Activities,MedDRA)25.1版本中藥物不良反應術語集的首選術語(Preferred Term,PT)和系統器官分類(System Organ Class,SOC)對相關ADE 事件進行分類和描述。
1.3 方法
本研究通過比例失衡法中的報告比值比(reporting odds ratio,ROR)法和比例報告比值(proportional reporting ratio,PRR)法進行數據整理及清洗。其算法基于四格表(表1、表2),ROR的判斷標準為95%CI 下限>1;PRR 的判斷標準為95%CI 下限>1,報告例數≥3 且PRR≥2;信號數值越大表示信號越強,說明巴瑞替尼與目標ADE 的統計學關聯越強[10-11]。
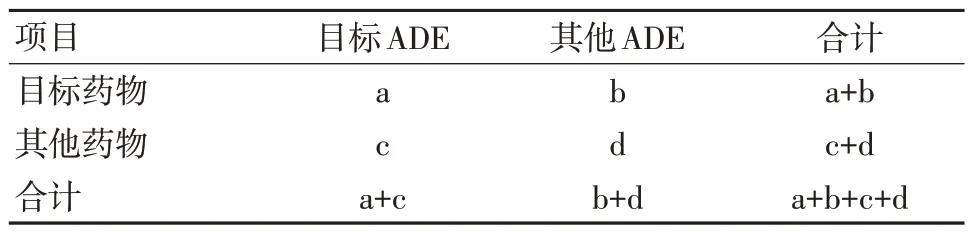
表1 比值失衡測量法四格表

表2 計算公式及信號監測閾值標準
1.4 結局指標
對符合風險信號檢測標準的巴瑞替尼相關ADE 報告進行提取,分析ADE 報告的基本情況及分布特點,并與巴瑞替尼藥品說明書對比,挖掘說明書上未提及的ADE。
2 結果
2.1 描述性結果
于2015 年第一季度至2022 年第三季度中在FAERS 系統中共檢索到7 201 690 例巴瑞替尼相關ADE,其中以巴瑞替尼為主要懷疑對象為6 344例。為了得到較強信號和較高頻次的ADE,通過ROR 和PRR 法多重篩選,選取95%CI 下限>1、報告例數≥3、PRR≥2 且χ2≥4 的報告2 368 例。分析年齡、性別、結局、上報國家等基本情況可知,巴瑞替尼ADE 主要發生在46 歲以上患者,尤其是66 歲以上者;上報國家以美國居多,占61.19%,中國報告率約為0.38%,女性偏多,見表3。其中,住院是報告的不良事件中最常見的后果,為978 例(占41.30%),死亡和危及生命分別為420 例(占17.74%)和324 例(占13.68%),見圖1。
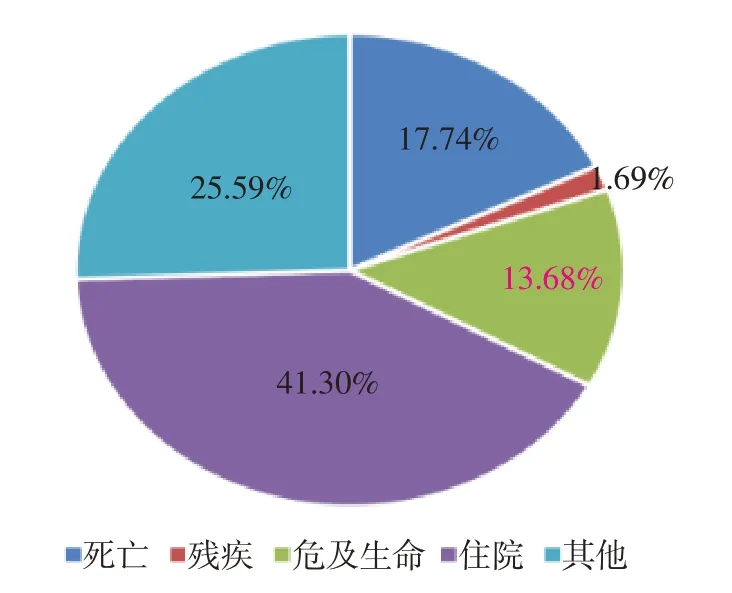
圖1 巴瑞替尼不良事件的基本信息
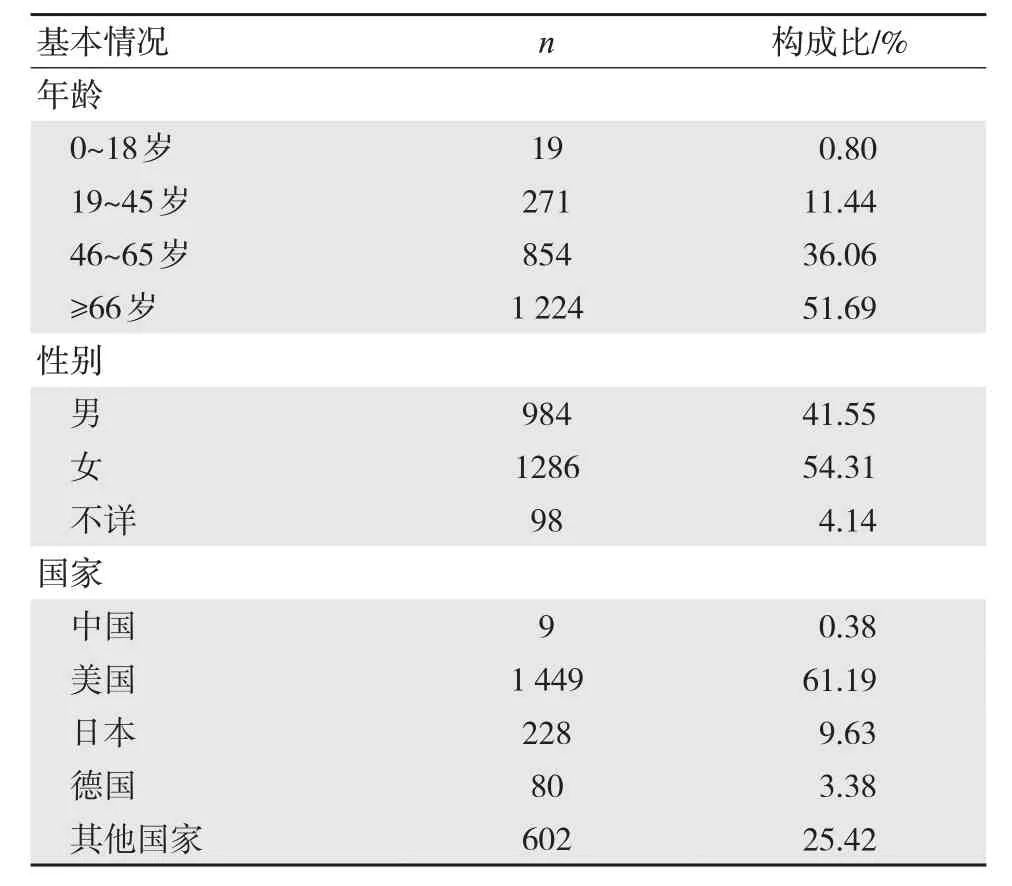
表3 巴瑞替尼不良事件的基本信息(n=2 368)
2.2 信號監測結果
通過MedDRA 25.1 版本中藥物不良反應術語集的PT 和SOC 對數據進行整理,并去除各類損傷、中毒、檢查、操作及手術并發癥、感染、局部感染、社會環境、肺部疾病、治療產品無效、面部癱瘓、呼吸系統疾病、鼻竇疾病、囊腫等無法判斷ADE 的PT,獲得PT 共59 個及1 731 個ADE。結果顯示,在使用巴瑞替尼的不良信號中,最常見為血栓栓塞事件,占20.91%,其他常見不良事件有感染,最常見感染部位為呼吸系統,其次為全身感染,如菌血癥、毒血癥等。值得注意的是,急性胰腺炎、腦卒中、感染COVID-19、血小板及白細胞增多等在巴瑞替尼說明書中并未提及。且新冠肺炎感染率高達7.51%,居ADE 第二位,見表4。報告序數前12 位SOC 見圖2。其中發生不良反應最常見的系統器官為血管及淋巴管,該系統中最常見ADE 為血栓栓塞事件,占該系統的構成比高達70.57%。這與巴瑞替尼說明書上不良反應說明一致。但呼吸系統最常見的ADE 為COVID-19,這在巴瑞替尼的說明書中并未收錄。見表5。
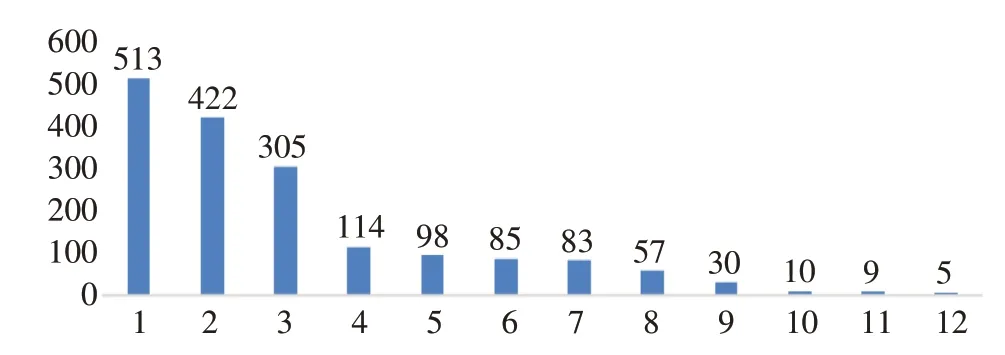
圖2 巴瑞替尼不良反應累計各系統信息
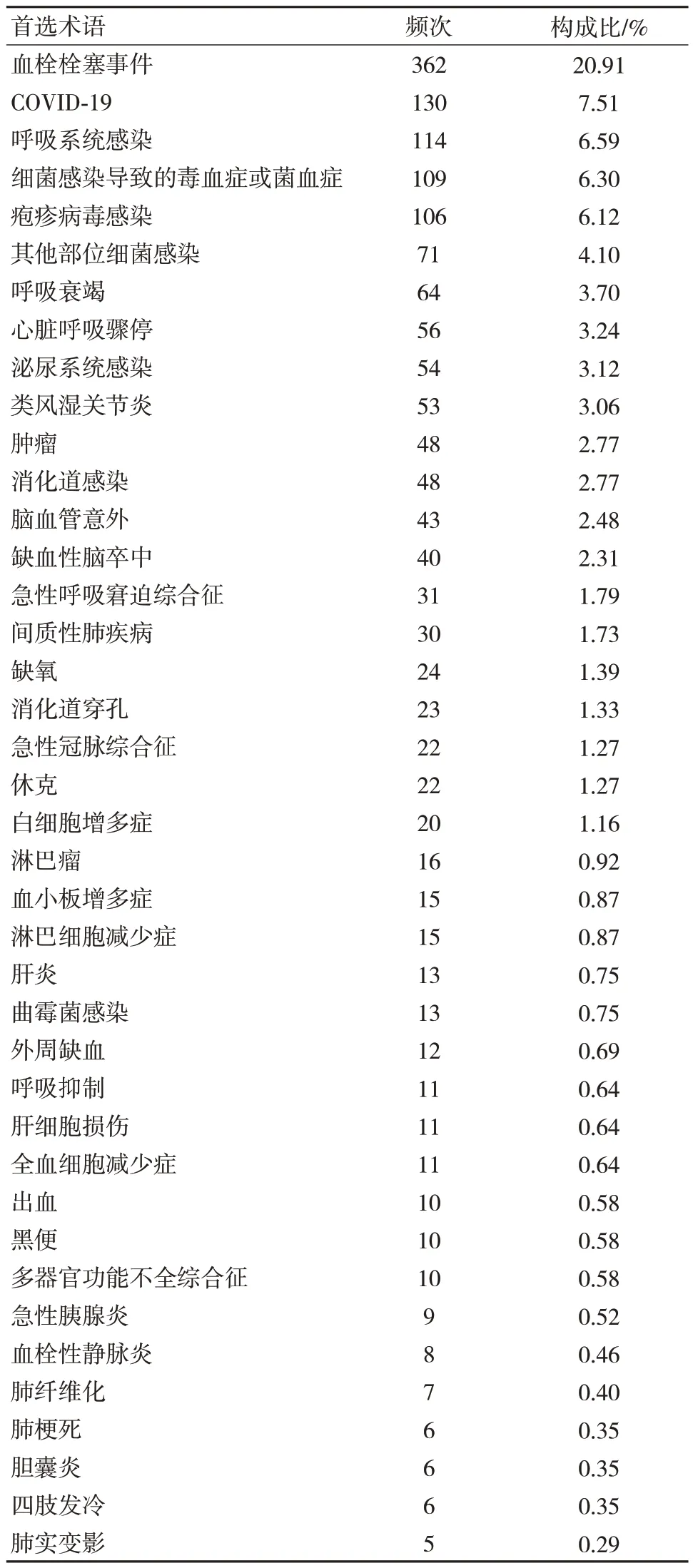
表4 巴瑞替尼常見的不良信號(n=1 731)
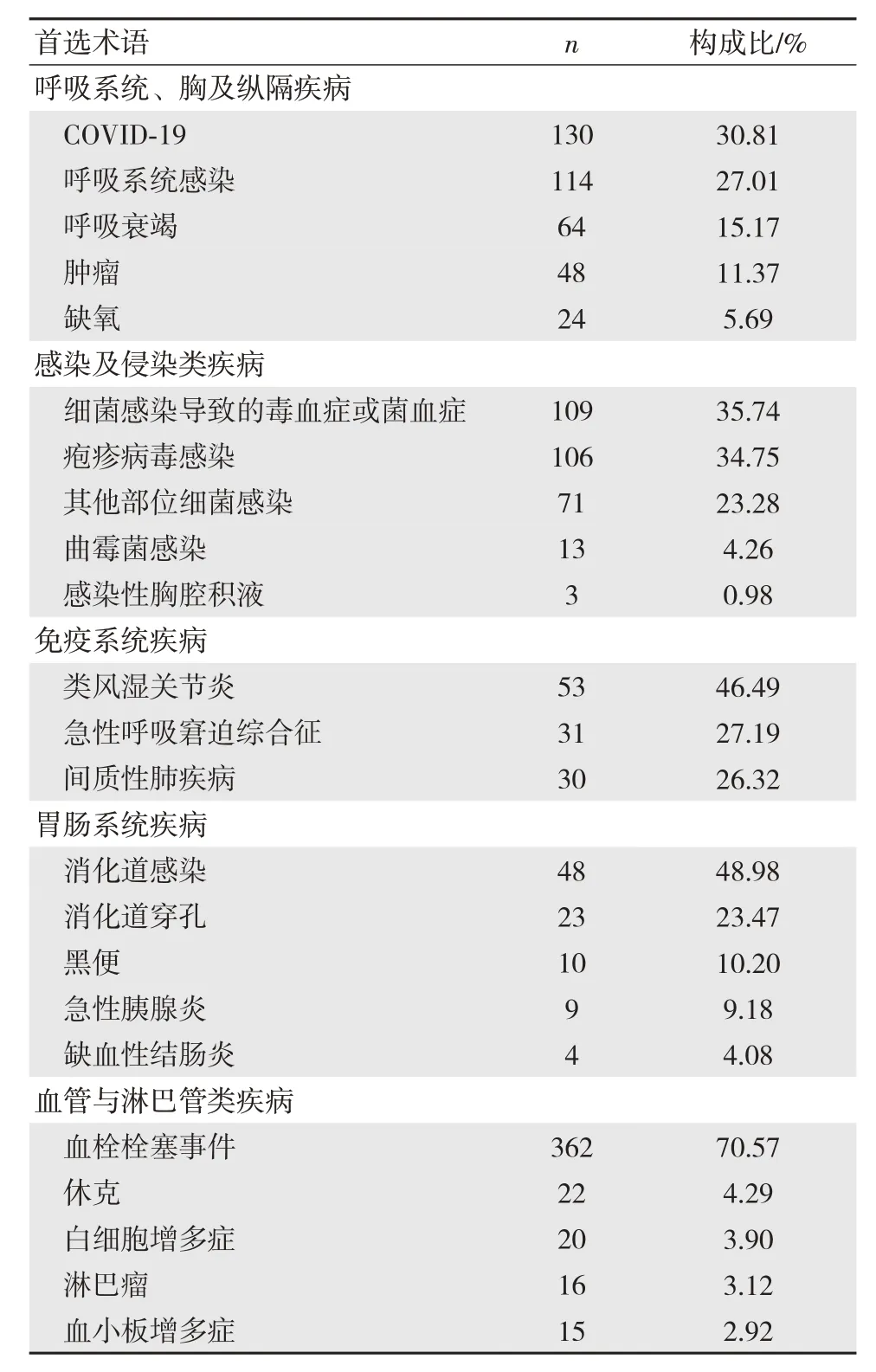
表5 巴瑞替尼各系統中前5 位ADE 情況
3 討論
本研究獲得的巴瑞替尼不良事件涵蓋了說明書提及的靜脈血栓、感染、皰疹病毒感染、誘發腫瘤、肝功能異常、血脂代謝紊亂、結核等信息,說明了本研究的可靠性。本研究發現使用巴瑞替尼的ADE 事件中,血栓栓塞事件共362 例(20.91%)。導致血栓栓塞事件風險增加的疾病有惡性腫瘤、急性心肌梗死、活動障礙及包括RA 及SLE 在內的免疫介導的疾病[12]。JAK 家族有四個成員,包括JAK1、JAK2、JAK3 和酪氨酸激酶(Tyk)2。巴瑞替尼選擇性抑制JAK1、JAK2,以及在較小程度上抑制Tyk2 和JAK3。各種JAK 抑制劑的毒性略有不同;越來越多的證據表明,JAK抑制劑可能不適合有感染和血栓栓塞事件風險的患者[13-15]。
本文的研究結果表明,女性關于巴瑞替尼不良反應的報告比例高于男性(54.31%vs.41.55%),這可能是由于RA、SLE 等疾病好發于女性,其女性與男性的比例為3∶1[16-17]。這導致女性更有可能暴露于巴瑞替尼的治療,從而增加了女性有關巴瑞替尼不良反應的報告率。此外,陽性信號中提示消化道穿孔情況。消化道穿孔可能與年齡相關,高齡與胃黏膜結構變化有關[18]。有研究顯示,與年輕參與者相比,老年患者(年齡60~85 歲)的胃黏膜中血管膠原和氧化應激增加[19]。值得注意的是,COVID-19 在巴瑞替尼的ADE 中有130例(占7.51%),這在巴瑞替尼說明書中并未提及。目前,美國和日本已批準巴瑞替尼治療COVID-19[7-8,20]。一項隨機雙盲安慰劑對照的Ⅲ期臨床試驗表明,巴瑞替尼組和安慰劑組的60 d 全因死亡率分別為10%(n=79)和15%(n=116)[H^R=0.62(95%CI:0.47~0.83);P=0.005],且使用這種藥物沒有顯著增加副作用[21]。一項以英國住院患者為試驗對象的隨機對照試驗表明,4 148名接受巴瑞替尼治療的患者中有514 名(12%)在28 d 內死亡,而4 008 名接受常規治療的患者中有546 名(14%)在28 d 內死亡,95%CI:0.77~0.99,P=0.028;結果表明,巴瑞替尼可降低住院治療的新冠肺炎者的死亡風險,但是獲益的規模比以前的試驗所顯示的要小;同時,在恢復過程中,沒有因非COVID-19 原因導致的死亡或感染顯著增加,也沒有血栓形成或其他安全結果顯著增加[22]。綜上所述,巴瑞替尼在一定程度上或可增加COVID-19 感染可能性,且該藥用于治療COVID-19的有效性尚需進一步考量。
本研究也有局限性。首先,因數據來源于FAERS 系統,該系統是一個自發報告系統,數據有許多局限性,包括重復和不完整的報告、報告不良事件與藥物不能確定因果關系、報告中的信息未經來源核實;其次,該系統的ADE 報告的嚴重性是由發送報告的人(而不是FDA)指定的,兩個不同的報告人可能對同一ADE 的嚴重性有不同的看法;第三,該系統為公共數據系統,部分患者可能會自發使用該系統,并可能導致患者的困惑、恐懼、甚至堅決不服藥[23]。本研究采用ROR 法聯合PRR 法檢測信號,雖可以表明藥物與相關風險信號具有統計學關聯,有重要的提示作用,但其確切的因果關系仍需進一步研究以保證患者用藥安全。
綜上所述,巴瑞替尼存在較廣泛的藥品不良反應,部分不良事件已被報告或已在藥品說明書中明確,另一些不良事件是在本研究中初次報告,因此,醫療衛生人員在應用該藥前應加強評估,使用時應該注意識別和預防,并采取相關治療措施保證用藥安全。

