碳熱還原法制備碳化硼的熱力學研究
李 欣, 牛 群, 陳 濱, 喬 佳, 程恩慶, 邢鵬飛
(1.江蘇大學 綠色材料與冶金研究院, 江蘇 鎮江 212013;2.遼寧省國家新型原材料基地建設工程中心, 沈陽 110819; 3.東北大學 冶金學院, 沈陽 110819)
碳化硼(B4C)具有僅次于金剛石、立方氮化硼的高硬度(莫氏硬度9.32).此外,它還具有高熔點(2 450 ℃)、低密度(2.52 g/cm3)、較好的化學惰性、優良的電學性能及中子吸收性能等優點[1-4],因此被廣泛用作LED 底襯的研磨材料[5-6]、軍工防彈材料、核工業中子控制和屏蔽材料、工程陶瓷材料及高級耐火材料等.近年來,隨著LED 產業、軍工防彈產業和核電產業的大力發展,高品質B4C 粉體的需求量大幅增加.
碳熱還原法制備B4C 因其工藝簡單,是目前應用最廣泛且可實現工業化大規模生產的方法[見式(1)][7-8].但該工藝反應過程較為復雜,會產生較多的中間化合物.其中,易揮發的B2O3及一些硼化物氣體(如B2O2,BO 等)的產生,均會直接影響到B4C 的還原過程及品質[9-11].另外,高品質B4C 的制備不僅取決于反應物配比,同時也受還原溫度、保溫時間及爐內氣壓等因素影響.目前,有眾多學者對碳熱還原法制備B4C 進行研究,但多集中于真空條件下工藝參數(原料配比、反應溫度和反應時間等)的研究,并未對體系的熱力學及反應機理進行系統分析,無法為高品質B4C 的高效制備提供充足依據和有效支撐.
本文中采用FactSage 熱力學軟件分別對B-O體系和B-C-O 體系進行熱力學研究,確定B-O 體系和B-C-O 體系狀態圖,并系統分析B4C 制備過程中主、副反應及理論反應溫度;闡明B2O3-C 體系的優勢區域圖,并解析溫度和氣相分壓對制備B4C 的作用規律,以此明確B4C 生成的優化區域和熱力學條件,提出還原反應的熱力學模型;在熱力學研究的基礎上,建立碳熱還原制備B4C 的反應機理,并進行實驗驗證.該研究結果對碳熱還原法制備高品質B4C 具有理論指導意義和實際應用價值.
1 熱力學研究
1.1 熱力學研究方法
在恒溫恒壓狀態下,化學反應過程沿吉布斯自由能減少的方向自發進行,直至反應結束[12].在標準狀態下,吉布斯自由能的大小可描述反應發生的可能性或發展趨勢.由熱力學第二定律可知,在恒溫恒壓條件下,吉布斯自由能可表示為
式中:ΔHΘT,ΔSΘT和ΔCP分別為溫度T下物質的標準焓變(J/mol)、物質的標準熵變[J/(K·mol)]、恒壓熱容差[J/(K·mol)].
積分法求出的ΔGΘ與T的關系式一般為多項式,但通常會把ΔGΘ與T的多項式簡化為二項式.在冶金計算中,多采用ΔGΘ=A+BT的二項式形式,可將斜率看作某反應式自由能變化對溫度的敏感性.為簡便計算,可根據式(3)計算各反應在不同溫度下的ΔGΘ.
在得到不同溫度T下的后,令X=T,Y=ΔGΘ,利用以下兩個公式可擬合得到各化學反應的關系式.
FactSage 是一款集多種計算功能于一體的綜合性熱力學計算軟件,該軟件的計算過程是基于系統吉布斯自由能的最小化原理,其中,最小吉布斯自由能法是求解熱力學平衡態的常用方法之一[13].在給定的壓力、溫度和系統組成的條件下,總的吉布斯自由能最小時,系統處于熱力學平衡狀態.
1.2 實驗方法
以硼酐(B2O3,質量分數99%)和石油焦(CP,固定碳質量分數90%)為原料,將B2O3和CP粉按原料配比(質量比) 3.3 ∶1 放入混料罐內,球磨5 h 至混合均勻,然后在30 MPa 單軸壓力下,壓制成Φ25 mm 的圓柱體.在80 ℃下干燥6 h,隨后將圓柱體置于高純石墨坩堝內,真空碳管爐內通入Ar 氣.在不同溫度(1 550,1 700,1 850 ℃)下反應30 min 進行碳熱還原實驗,待實驗結束冷卻至室溫后,對實驗產物進行物相結構和微觀形貌的表征與分析.
1.3 分析檢測
采用X 射線衍射儀(D8 ADVANCE,德國布魯克)和Cu-Kα 輻射(k=0.154 06 nm)確定物相組成.利用場發射掃描電子顯微鏡(SIGMA300,德國蔡司)研究產物粉末的微觀形貌,并采用能譜分析(SIGMA300,德國蔡司)確定產物組成及含量.
2 分析與討論
2.1 B-O 和B-C-O 體系的熱力學分析
采用FactSage 軟件對B-O 體系進行熱力學研究,可得到B-O 體系狀態圖,如圖1 所示.
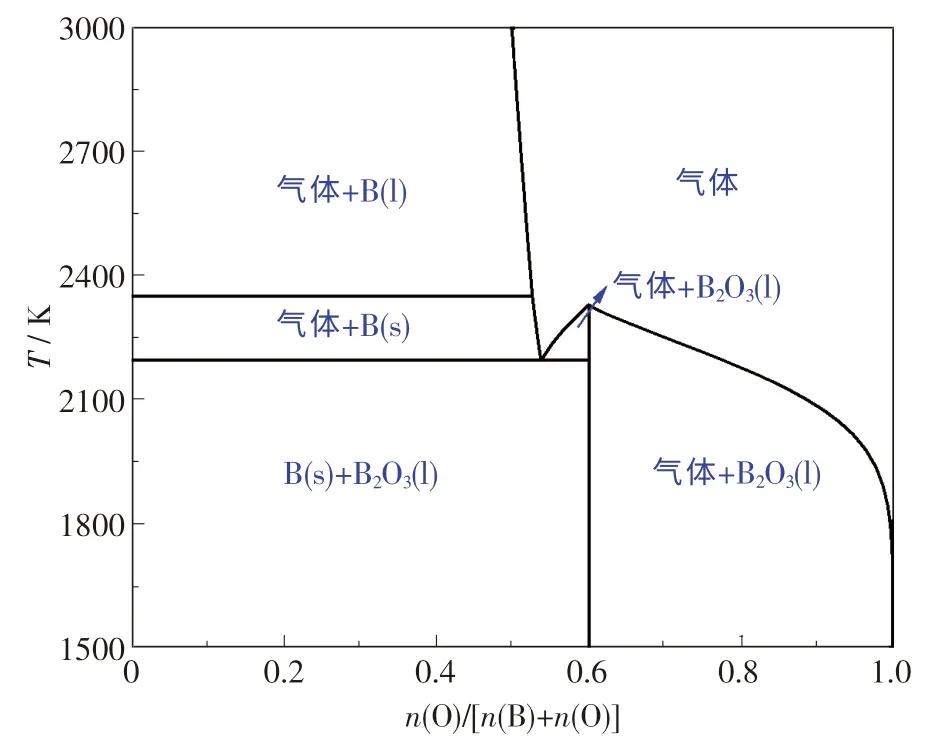
圖1 B-O 體系狀態圖Fig.1 Binary phase diagram of B-O system
由圖1 可知:當n(O)/[n(B)+n(O)]為0 ~0.6、溫度低于1 921 ℃時,主要產物為B(s)和B2O3(l);當溫度由1 921 ℃升高至2 077 ℃時,產物主要為B(s)和混合氣體;當n(O)/[n(B)+n(O)]>0.6、溫度低于2 049 ℃時,主要產物為B2O3(l)和混合氣體;當溫度高于2 049 ℃時,主要產物為混合氣體.綜上分析,B-O 體系中存在的產物主要有B(s),B2O3(l)和混合氣體,其中混合氣相組成可能為B2O3,B2O2或BO 等.Inghram 等[10]研究表明:在還原條件下,液態B2O3主要以亞氧化硼(B2O2)形式揮發;當溫度為1 227 ℃時,氣相中B2O2與B2O3的摩爾比為7 ∶1.Rentzepis 等[11]提出,在B2O3-C 體系中,隨溫度的升高,B2O3將發生由固態向液態以至氣態的轉變.一般情況下,B2O3在327 ℃開始軟化,453 ℃熔化,當高于1 277 ℃時,將與C 反應形成B2O2.綜上可知,B2O2是B-O 體系重要的氣相產物之一.
原料B2O3與C 通過反應(6)可形成B2O2,同時還可以滿足ΔGΘ=644.22 - 0.311 02T+0.019 147Tlg[PCOPB2O2/(PΘ)2],可見降低氣相分壓能降低反應(6)的起始反應溫度.當分壓由101.325 kPa 降至101.325 Pa 時,起始反應溫度則由1 791 ℃急劇下降到1 474 ℃.當壓力低于1.013 Pa、溫度高于1 277 ℃時,反應(6)在熱力學上是可行的,這與文獻[11]的研究結果相吻合.綜上分析可知,提高溫度和降低壓力均有利于B2O2氣體的形成.
使用FactSage 軟件對B-C-O 體系進行熱力學分析,可得到B-C-O 體系狀態圖,如圖2 所示.由圖可知,隨著n(C)/[n(B2O3)+n(C)]和溫度的變化,產物也發生變化.當溫度低于1 561 ℃時,體系未發生化學反應,僅有B2O3由固態熔化為液態.當溫度高于1 561 ℃時,B2O3與C 開始發生反應,形成B4C,并伴隨著氣體產生.當溫度提高至1 867 ℃,n(C)/[n(B2O3)+n(C)]<0.77 時,主要產物為B2O3(l),B4C(s) 和氣體.當0.77 <n(C)/[n(B2O3) +n(C)]<1 時,產物組成為C(s),B4C(s)和氣體,這主要是由C 含量提高所致.當 溫 度 由 1 867 ℃升 高 至 1 961 ℃,n(C)/[n(B2O3)+n(C)]<0.41 時,產 物則 由B2O3(l),B4C(s)和氣體變為B2O3(l)和氣體,這可能是由于C 含量減少,多余的B2O3(l) 與B4C(s)發生反應產生氣體,B4C 則被消耗掉.在此溫度下,當n(C)/[n(B2O3)+n(C)]由0.41 提高至0.66 時,產物由氣體和B2O3(l)變為氣體和B(s),這可能是隨著C 含量的增加,C 與B2O3(l)發生還原反應形成單質B,當繼續增加至0.77時,單質B 與C 發生化合反應形成目標產物B4C.綜上所述,B-C-O 體系是一個復雜的體系,隨著n(C)/[n(B2O3)+n(C)]和溫度的變化,B2O3與C,B4C,B 均會發生一系列復雜的反應,并形成不同的反應產物.
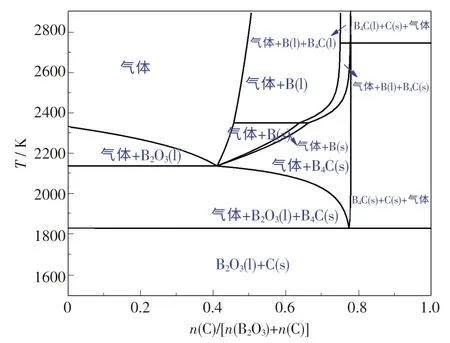
圖2 B-C-O 體系狀態圖Fig.2 Phase diagram of B-C-O system
2.2 B-C-O 體系的優勢區域圖分析
對碳熱還原法制備B4C 的B-C-O 體系及其優勢區域圖進行熱力學分析,可確定適宜的反應條件,并為后續還原反應提供相關的理論依據,這具有重要的理論與實踐意義.通過分析B-C-O 體系狀態圖可知,B-C-O 體系中存在的凝固相主要有B4C、單質C 和單質B,而氣相主要有B2O2和CO.表1 列出了B-C-O 體系中存在的主要反應式及其相關的ΔG~T關系式.

表1 B-C-O 體系中各反應式的吉布斯自由能ΔG 與溫度T 的關系式Table 1 Relationship between ΔG and T of reactions in B-C-O system
為了探討B2O2和CO 等氣體對凝固相B4C、單質C 及單質B 生成的影響,利用表1 中各反應的吉布斯自由能和溫度的關系式,從熱力學角度分別繪制出不同分壓和溫度下B-C-O 體系的優勢區域圖,結果如圖3 和圖4 所示.
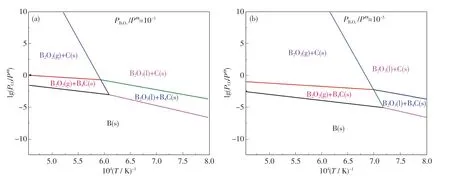
圖3 不同B2O2 分壓下B-C-O 體系的優勢區域圖Fig.3 Predominance diagram at different B2O2 partial pressures for B-C-O system
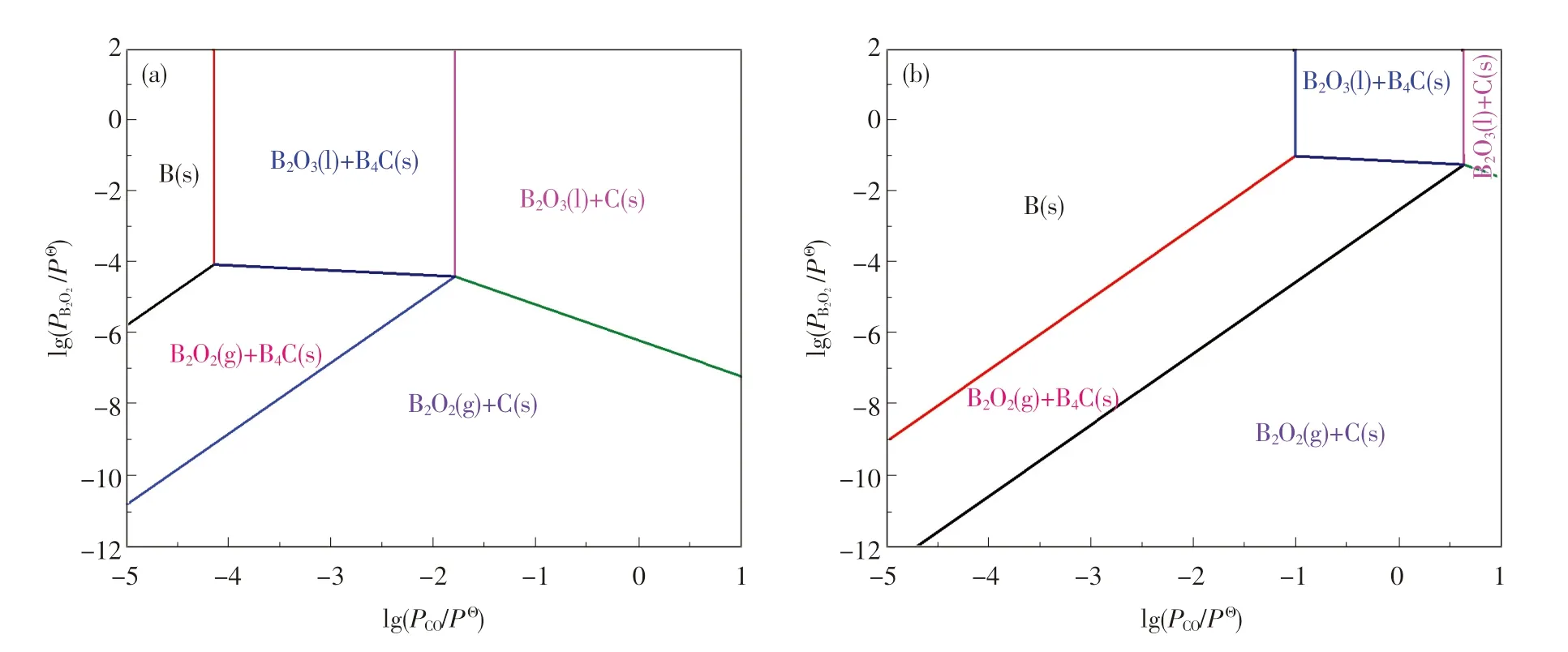
圖4 不同溫度下B-C-O 體系的優勢區域圖Fig.4 Predominance diagram at different temperatures for B-C-O system
從圖3(a)中可看出,CO 氣體分壓對B2O3,B,C,B4C 的穩定存在區域有顯著影響.隨著CO分壓的降低,B-C-O 體系中穩定存在的物相分別為B2O3(1)+C(s),B2O2(g)+C(s),B2O2(g)+B4C(s),B2O3(1)+B4C(s),B(s).當B2O2氣體的分壓由101.325 Pa 降至1.013 25 Pa 時,穩定物相的共存區域也隨之發生變化,B2O3(1)+C(s),B2O3(1)+B4C(s),B(s)的共存區域逐漸縮小,而B2O2(g)+C(s),B2O2(g)+B4C(s)的共存區域增大,這說明B2O2是B-C-O 體系中重要的氣態產物,它可能會參與到B4C 的制備反應,這一結論也與文獻[14]的研究結果相吻合.
同時,B2O2氣體的存在也可通過圖4 得到驗證.隨著碳熱還原反應的進行,B2O3先被C 還原形成B2O2氣體[見反應(6)],B2O2氣體再與C反應形成B4C[見反應(12)].此外,反應對CO 分壓的要求也逐漸提高,只有當CO 分壓極低(10.325 Pa)時,才有可能形成單質B.結合圖3 和圖4 可知,B4C 比B 更易形成,而B 可能是B4C與B2O3或B2O2進一步反應所形成的[見反應(13)或(14)].從熱力學角度進行分析,通常情況下先形成單質B,而后單質B 和C 化合成B4C 的概率較小.在碳熱還原反應中,通過C 還原B2O3可得到B2O2氣體.該氣體既是B-C-O 體系重要的中間氣態產物之一,又是形成B4C 的前驅體[15],B2O2(g)與C 可通過氣-固(VS)機制形成B4C.
目前,關于碳熱還原法制備B4C 的反應機理研究較少.Kobayashi 等[16]認為針狀B4C 顆粒的形成機制為氣-液-固(VLS)機制,Ma 等[17]則認為B4C 納米是通過氣-氣(VV)機制形成,El-Eheikh 及Weimer 等[18-19]提出液/氣態B2O3與C通過液-固(LS)機制或氣-固(VS)機制形成B4C.結合熱力學分析可發現,B2O3與C 通過LS 機制[見反應(11)]或氣態B2O2與C 通過VS 機制[見反應(12)]形成B4C 的概率較大.為了更直觀地進行對比分析,繪制出反應(11)和(12)的ΔGΘ與溫度T關系圖,結果如圖5 所示.在標準狀態下,當溫度高于1 559 ℃時,反應(11)在熱力學上是可行的.此外,在整個溫度范圍內(1 500 ~2 500 K),反應(12)的吉布斯自由能均為負值,這意味著反應(12)在熱力學上也是可行的.
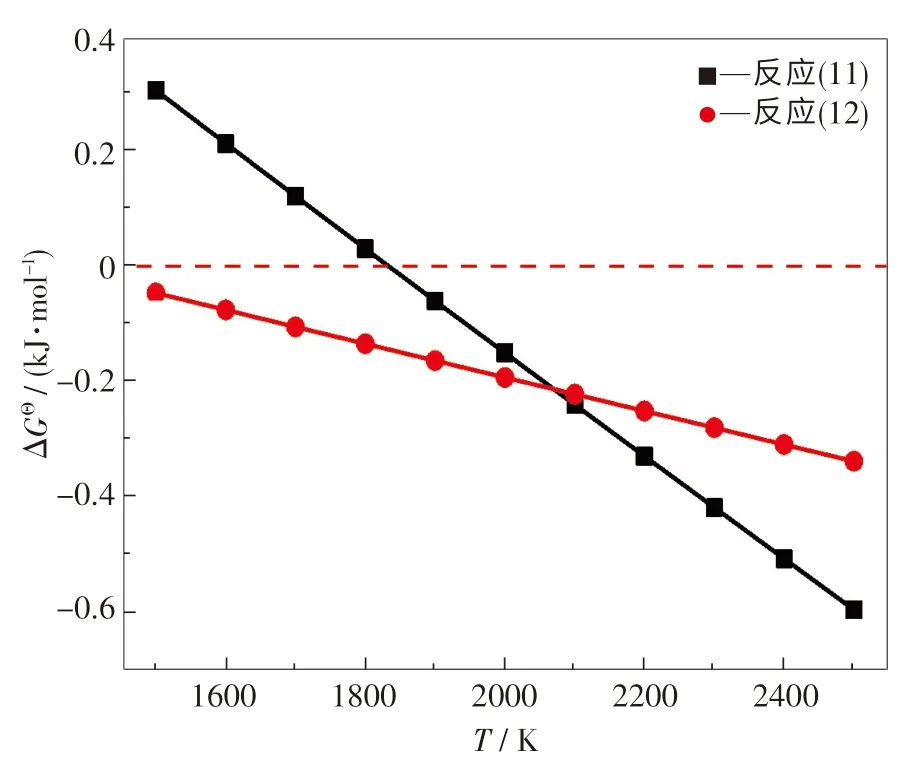
圖5 標準狀態下反應(11)和(12)的ΔGΘ ~T 圖Fig.5 ΔGΘ ~T relationships for reactions (11) and (12) under standard state
通過對CTR 法制備B4C 的熱力學過程及優勢區域圖的討論分析,推測出B4C 的生成機理可能有兩種:①LS 機制,即2B2O3(l)+7C(s)==B4C(s)+6CO(g);②VS 機制,即先通過B2O3(l)+C(s)==B2O2(g)+CO(g)反應形成B2O2氣體,B2O2氣體再與C 發生氣-固反應2B2O2(g)+5C(s)==B4C(s)+4CO(g)形成B4C.
2.3 碳熱還原法制備B4C 的反應機理驗證
以B2O3和CP為原料,對不同溫度下的還原產物進行XRD 分析,結果如圖6 所示.由6(a)可知,衍射峰的主峰位置基本一致,2θ=19.7°,22.0°,23.5°,31.8°,35.0°,37.8°和63.7°的衍射峰分別對應于B4C 的(101),(003),(012),(110),(104),(021)和(125)晶面(JCPDS 卡No.35-0798)[18],且產物中只出現B4C 衍射峰,無其他雜質的衍射峰.B4C 的衍射峰強度較高且尖銳,這說明B4C 晶化程度較高.此外,當還原溫度由1 550 ℃提高至1 700 ℃時,B4C 衍射峰強度增加,這表明升高溫度有利于提高B4C 的結晶性.將B4C 相(110),(104)和(021)晶面進行局部放大,結果如圖6(b)所示.從圖中可以看出,當溫度進一步升高至1 850 ℃時,衍射峰強度減弱,半峰變寬,說明此時B4C 結晶性變差,這可能是高溫所誘發的晶體結構缺陷增多或非晶化造成的.
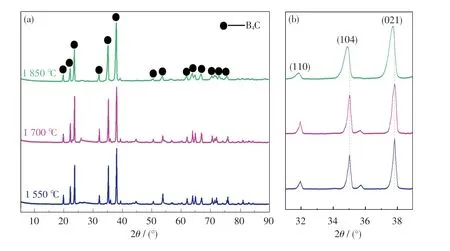
圖6 不同還原溫度下實驗產物的XRD 圖Fig.6 XRD patterns of products synthesized at different temperatures
圖7 為不同溫度下還原產物的SEM-EDS 圖.有研究表明,當溫度發生變化時,產物的微觀形貌和晶粒粒徑也會隨之變化.由圖7(a)和(b)可知:在1 550 ℃下還原產物呈不規則多面體狀,經EDS證實為B4C;B4C 結晶發育完整,晶粒邊緣棱角分明,晶粒尺寸為4~10 μm.由于碳熱還原反應釋放的高熱量,B4C 晶粒會相互依附、堆垛生長,從而使得晶粒聚集形成較大的團聚體.B4C 晶體顯示為層狀結構,側面出現明顯的生長臺階,這表明B4C 的生長機理是二維形核控制的小平面生長.此外,由晶體界面生長理論可知[20-21],不規則B4C 多面體晶體是在液態B2O3中形核并逐漸長大的,而多面體晶體的團聚也證實了液態反應物的存在[14].該實驗結果則證實了熱力學的研究結果,即不規則 B4C 多面體是通過 LS 機制[2B2O3(l)+7C(s)==B4C(s)+6CO(g)]反應形成.

圖7 不同溫度下實驗產物的SEM-EDS 圖Fig.7 SEM-EDS results of products synthesized at different temperatures
從圖7(c)(d)中可看出,當溫度提高至1 700 ℃時,制備的B4C 存在兩種截然不同的晶體形貌:一種是類似于圖7(a)中的不規則多面體晶體;另一種是長度為3~10 μm 棒狀B4C 晶體,并且這些棒狀晶體會相互交叉形成多重結構.顯而易見,不同形貌的B4C 晶體,其生成機理也不相同[22].棒狀晶體是典型的氣-固反應晶體形貌,結合熱力學研究可知,棒狀B4C 是通過VS 機制[反應(2)]形成的.當還原溫度繼續提高至1 850 ℃時,B4C 晶體呈二維薄片狀,薄片長度大于50 μm,寬度為10~20 μm,這進一步證明B4C 是由高溫下形成的過飽和B2O2氣體與C 通過反應(12)形成的[23].綜合上述分析可知,B4C 的生成機理如下:低溫下(~1 550 ℃)以LS 機制為主;隨溫度的升高,氣態產物增多,高溫下(~1 800 ℃)則以VS 機制為主.
3 結 論
(1)B2O2氣體是B-C-O 體系重要的中間氣態產物之一,B2O2氣體是形成B4C 的前驅體.
(2)B-C-O 體系優勢區域圖分析表明體系中穩定的共存區域為B2O3(1)+C(s),B2O2(g)+C(s),B2O2(g)+B4C(s),B2O3(1)+B4C(s)和B(s).隨溫度和分壓的變化,物相共存區域的大小也隨之變化,優勢區域圖的分析證實了B2O2氣體的存在及氣-固反應形成B4C 的可行性.
(3)B4C 的生成機理為:低溫下(~1 550 ℃)以液-固機制為主;隨溫度升高,氣態產物的增多,高溫下(1 850 ℃~)則以氣-固機制為主.

