免疫抑制劑對腎功能不全的免疫球蛋白A腎病患者的療效研究
陳姣姣,崔 文,周鈺昆,王 婷,王 莉,尚 進,趙占正
0 引言
免疫球蛋白A腎病(Immunoglobulin A nephropathy,IgAN)是我國最常見的原發性腎小球腎炎(Primary glomerulonephritis,PGN)[1],且對年輕群體影響較大[2]。IgAN組織病理學特征是以免疫球蛋白A(Immunoglobulin A,IgA)或IgA為主,伴有或不伴有其他免疫球蛋白在系膜區域的沉積[3]。根據改善全球腎臟病預后組織(Kidney disease:improving global outcomes,KDIGO)指南建議,IgAN的治療以支持治療為主,如改變生活方式、嚴格控制血壓、應用腎素-血管緊張素系統(Renin-angiotensin system,RAS)阻滯劑,活動期輔以激素或免疫抑制劑治療[4]。
目前,免疫抑制劑的使用建議僅限于具有快速進展性腎損傷或新月體IgAN患者,不推薦用于腎小球濾過率(Estimated glomerular filtration rate,eGFR)低于30 ml/(min·m2)的IgAN患者[3]。既往關于免疫抑制劑在腎功能不全的IgAN患者中的應用存在很大的爭議,其有效性目前仍有待確定[5],且已有的研究尚未達成共識。因此,本研究進一步評價免疫抑制劑對腎功能不全的IgAN患者的治療效果,為今后的治療提供參考。
1 對象和方法
1.1 研究對象 通過鄭州大學第一附屬醫院單中心數據庫回顧性收集2012年1月1日至2021年7月1日在腎內科經腎活檢證實的IgAN患者。納入標準:①腎活檢證實的IgAN,且腎活檢有慢性病變,如腎小球硬化、腎小管萎縮、間質纖維化或纖維新月體形成;②腎活檢時年齡16~80歲;③腎功能不全[eGFR≤60 ml/(min·m2)]。排除標準:①患有其他自身免疫性疾病或繼發性腎臟疾病[6],如系統性紅斑狼瘡、類風濕性關節炎、強直性脊柱炎或肝硬化;②服用腎毒性藥物;③惡性腫瘤病史;④HIV感染史和神經精神疾病史;⑤急性腎損傷;⑥既往接受過糖皮質激素或免疫抑制劑治療。研究方案經鄭州大學第一附屬醫院倫理委員會批準(倫理編號:KY202100595)。
1.2 觀察指標 從電子病歷中收集患者腎活檢期間數據,包括人口統計學數據、主訴、實驗室數據、腎臟病理結果以及基線或隨訪期間的檢查結果。主訴包括腰痛、頭痛、乏力、惡心、厭食、水腫、夜尿增多、尿檢異常和腎功異常。實驗室指標包括白細胞、紅細胞、血紅蛋白、血小板、血肌酐、血尿酸、血白蛋白(Serum albumin,ALB)、總膽固醇、甘油三酯(Triglyceride,TG)、高密度脂蛋白、低密度脂蛋白、尿點式總蛋白、24小時尿總蛋白定量(24h uric total protein,24hUTP)、血沉、C反應蛋白、補體C3、補體C4等。通過免疫學、光學顯微鏡和電子顯微鏡檢查所有腎活檢組織。根據IgAN牛津分類(MEST評分系統)分析IgAN的病理變化[6]。腎臟病理變化可分為系膜增生(Mesangial hyperplasia,M)、內皮增生(Endothelial hyperplasia,E)、節段性腎小球硬化(Segmental glomerulosclerosis,S)、腎小管和間質纖維化/萎縮(Renal tubular and interstitial fibrosis/atrophy,T)。M0:少于50%的腎小球出現系膜增生;M1:超過50%的腎小球出現系膜增生;E0:沒有內皮增生;E1:出現內皮增生;S0:無節段性腎小球硬化;S1:出現節段性腎小球硬化;T0:0%~25%的皮質區域出現腎小管和間質纖維化/萎縮;T1:26%~50%的皮質區域出現腎小管和間質纖維化/萎縮;T2:超過50%的皮質區域出現腎小管和間質纖維化/萎縮。
1.3 主要終點事件及不良反應 定義為eGFR降低超過40%、腎臟替代治療(腎移植、血液透析、腹膜透析)或死亡。收集和分析了患者用藥期間的不良反應(Adverse drug reactions,ADRs)情況,即安全性結局。
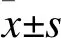
2 結果
2.1 用藥情況 篩查205例經腎活檢證實的IgAN患者。最終129例IgAN患者符合納入和排除標準(圖1)。其中,45.74%的患者接受免疫抑制治療(免疫抑制劑組,n=59),其余僅接受支持治療(非免疫抑制劑組,n=70)。在免疫抑制劑組中,40例(68.00%)患者使用糖皮質激素治療。在非免疫抑制劑組中,11例(15.71%)患者使用糖皮質激素治療。在免疫抑制劑組,54例(91.5%)患者僅接受嗎替麥考酚酯(Mycophenolate mofetil,MMF)治療,4例(6.8%)患者僅接受環磷酰胺(Cyclophosphamide,CTX)治療,1例(1.7%)患者接受MMF和CTX治療。MMF的給藥方案:0.5~1.5 g/d,分2次口服。CTX口服給藥方案:100 mg/d,或0.5~1.0 g/m2,靜脈注射。免疫抑制劑的應用時間為腎活檢確診為IgAN至隨訪截止時間。
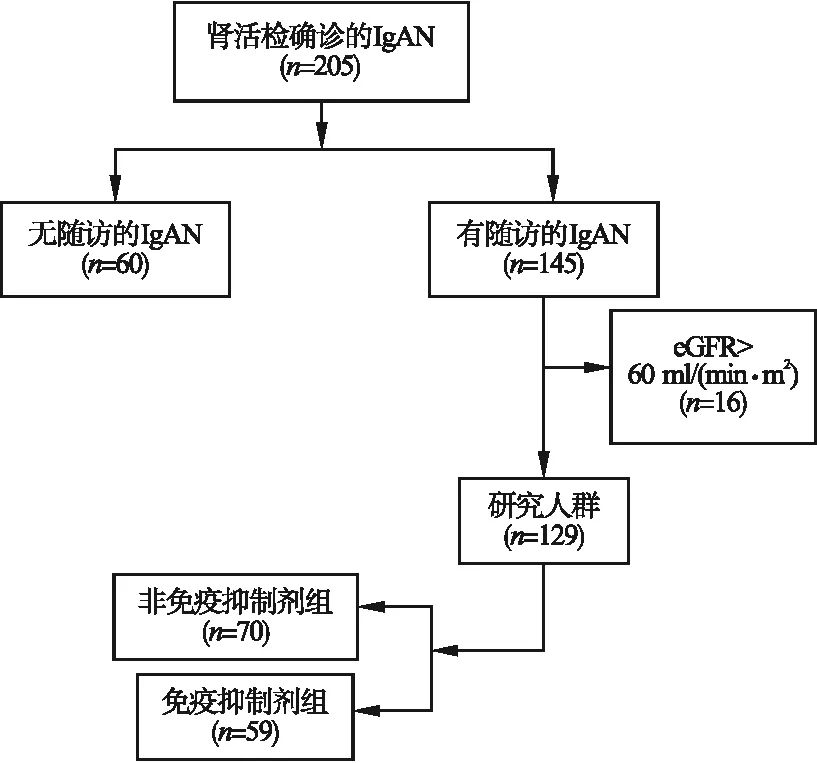
圖1 納入IgAN患者的流程圖
2.2 基線資料比較 基線數據見表1。研究人群的平均年齡約為40歲,且男性患者的占比較大(65.1%)。與非免疫抑制劑組相比,免疫抑制劑組患者更年輕(P<0.05),免疫抑制劑組患者使用血管緊張素受體阻滯劑的比例較低(P<0.05)。免疫抑制劑組的血白蛋白水平低于非免疫抑制劑組(P<0.05)。免疫抑制劑組甘油三酯和24小時尿總蛋白定量水平高于非免疫抑制劑組(P<0.05)。兩組間eGFR水平差異無統計學意義(P<0.05)。
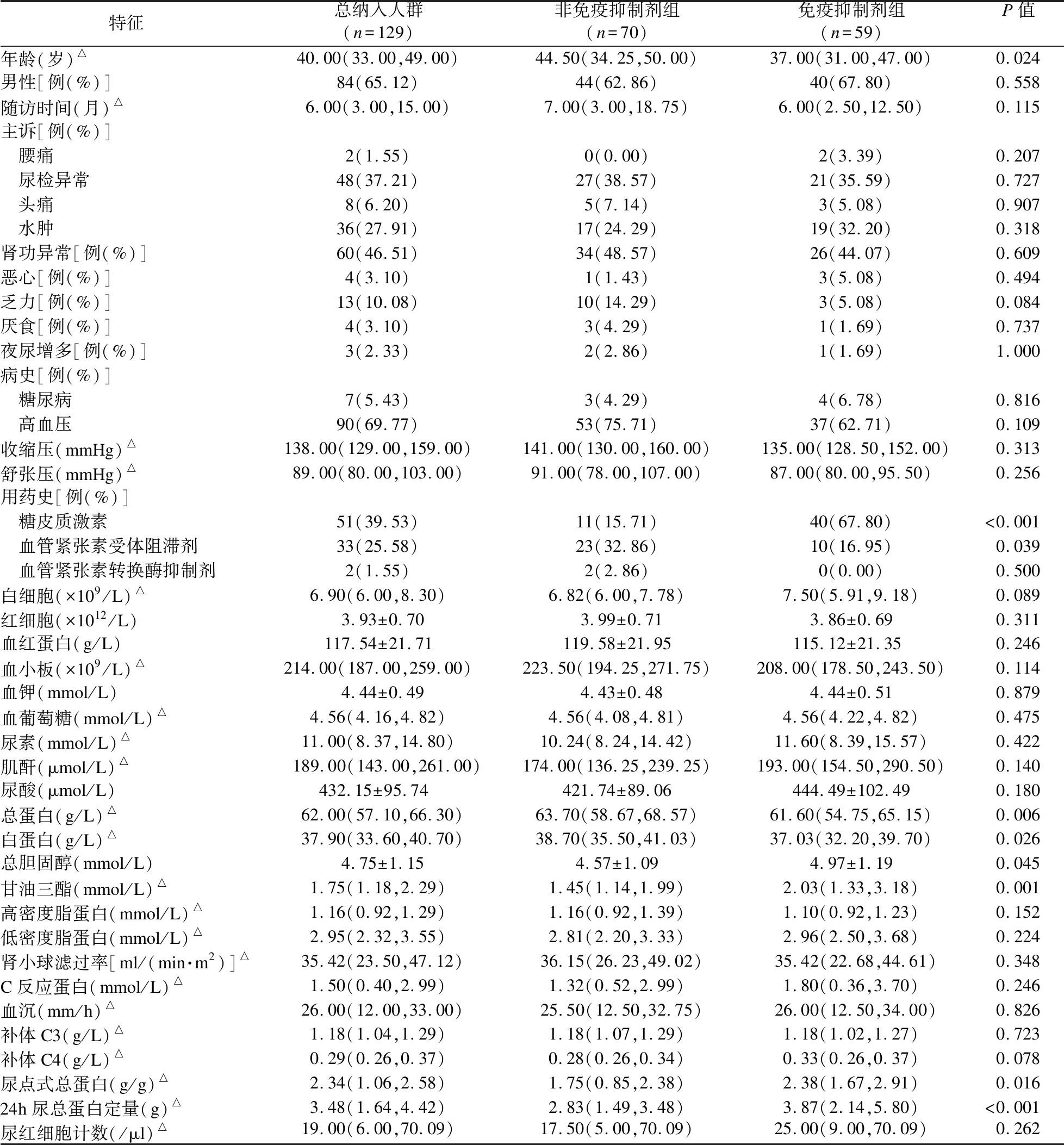
表1 兩組患者的基線資料比較
所有患者的中位隨訪時間約為6個月,最短1個月,最長70個月。免疫抑制劑組的中位隨訪時間為6個月,最短和最長分別為1個月和63個月。非免疫抑制劑組的中位隨訪時間為7個月,最短1個月,最長70個月。兩組隨訪時間比較差異無統計學意義(Z=-1.577,P>0.05)。
2.3 兩組間腎活檢病理資料比較 根據經腎活檢證實的IgAN患者的病理結果,采用IgAN牛津分類(MEST評分)對腎臟進行病理評分。結果顯示,在整個分析人群中,S評分和T評分的比例較高。非免疫抑制劑組與免疫抑制劑組的病理結果差異無統計學意義(P>0.05)。見表2。
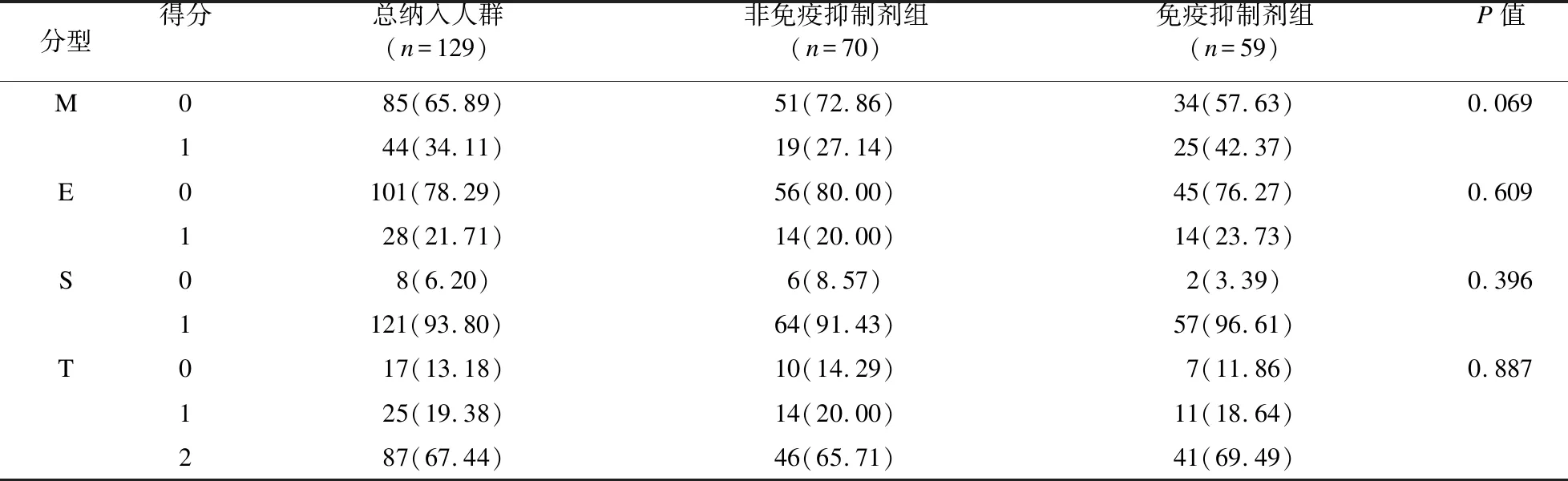
表2 兩組患者腎活檢病理資料[例(%)]
2.4 兩組患者結局比較 非免疫抑制劑組出現透析結局的患者12例(17.14%),其中血液透析(Hemodialysis,HD)4例,腹膜透析(Peritoneal dialysis,PD)8例。免疫抑制劑組8例(12.5%)患者出現透析結局,其中4例HD,4例PD。免疫抑制劑組有16例患者(27.12%)達到了主要結局,而非免疫抑制劑組有28例(40.0%)。兩組間eGFR降低40%、透析和腎移植等主要結局差異無統計學意義(P>0.05)見表3。
表3 兩組患者的結局和不良事件統計[例(%)]
2.5 兩組患者不良反應比較 研究期間,免疫抑制劑組出現5例(8.47%)與疾病治療相關的非嚴重的發熱,2例(3.39%)非嚴重的肺炎,停藥后可緩解。免疫抑制劑組ADRs發生率明顯高于非免疫抑制劑組(χ2=8.225,P<0.05)。兩組患者均無死亡病例。見表3。
2.6 兩組患者生存率比較 以隨訪時間作為時間數據,以結局指標作為狀態變量,進行Kaplan-Meier生存分析并繪制曲線。結果顯示,兩組累積生存率差異無統計學意義(P>0.05,圖2)。總體的中位隨訪時間為6個月(四分位間距為3~15個月),免疫抑制劑組的中位隨訪時間為6個月(四分位間距為2~13個月),非免疫抑制劑組的中位隨訪時間為7個月(四分位間距為3~19個月)(表1)。非免疫抑制劑組的中位生存時間為21個月,免疫抑制劑組為23個月。
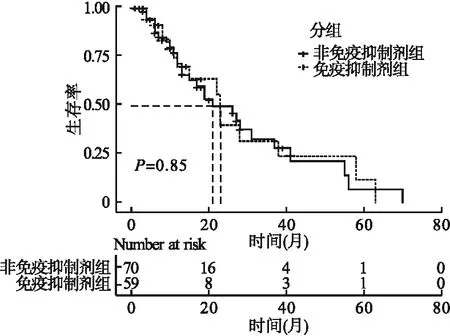
圖2 兩組患者Kaplan-Meier生存曲線比較
在免疫抑制劑組中,依據eGFR是否小于30 ml/(min·m2)進行了生存分析。22例eGFR<30 ml/(min·m2)的患者的中位生存時間為15個月,其中7例(31.8%)發生了結局事件。相比之下,37例eGFR≥30 ml/(min·m2)的患者的中位生存時間為28個月,其中9例(24.3%)發生了結局事件。在30 ml/(min·m2)≤eGFR<60 ml/(min·m2)的患者中,應用免疫抑制劑可能會延遲患者發生結局事件(P<0.05)。見圖3。
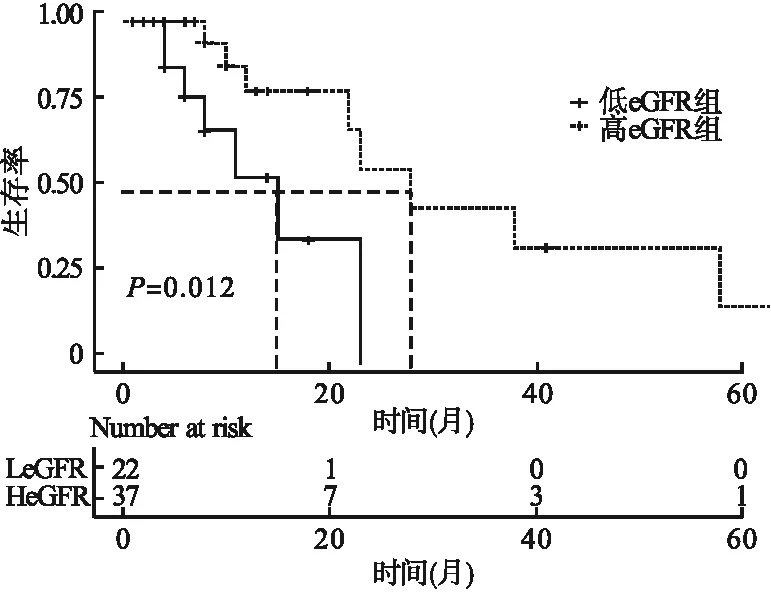
圖3 免疫抑制劑組高eGFR和低eGFR的Kaplan-Meier生存曲線比較
3 討論
慢性腎臟病(Chronic kidney disease,CKD)的發病率在全世界范圍內快速增長[6],不僅給經濟和社會增加了負擔,并且成為威脅壽命的一個極大的公共健康問題[7]。在中國,慢性腎小球腎炎是慢性腎臟病的常見病因,且腎小球腎炎最常見的類型是IgAN。IgAN患者中80%為青壯年,無明顯癥狀,25%~30%的IgAN患者在就診后20~25年內可進展為腎功能衰竭[2-3],IgAN在臨床和病理特征上明顯的異質性給治療帶來了極大的困難。對于存在腎功能不全的IgAN患者,免疫抑制劑的應用是否有利于緩解疾病進展,目前現有的研究缺乏一致的定論,并且在相關指南中也未推薦在這部分患者中使用免疫抑制劑來控制疾病進展。
本研究評估了免疫抑制劑對腎功能不全的IgAN患者的療效和安全性。結果表明,與非免疫抑制劑組相比,免疫抑制劑組的累積腎臟存活率沒有明顯改善,但不良事件的發生率有所增加。在隨訪期間出現感染病例,但患者癥狀較輕,無一例因感染死亡。然而,由于隨訪時間限制,不良事件的發生率可能被低估。
基線結果顯示,免疫抑制劑組的ALB低于非免疫抑制劑組,而甘油三酯、尿蛋白水平高于非免疫抑制劑組,兩組患者腎穿刺病理結果對比差異無統計學意義。免疫抑制劑組使用MMF的患者占大多數。目前,MMF在IgAN中的治療作用仍存在爭議,盡管國內研究已證實了其療效,但在某些情況下,MMF可能會導致嚴重的肺炎[8]。在STOP-IgAN研究中,與支持治療組相比,免疫抑制劑組的感染率更高,糖耐量更低,體重增加更顯著,沒有觀察到結局的顯著改善[9]。然而,一些研究表明,免疫抑制劑對腎功能不全的患者有效。一項研究納入了腎功能下降的患者[基線eGFR約為50 ml/(min·m2) ],旨在評估MMF在IgAN患者中的長期腎臟保護能力。結果表明,MMF可緩解患者的蛋白尿[10]。本研究中,患者平均eGFR值約為35 ml/(min·m2),兩組患者eGFR差異無統計學意義,免疫抑制劑組尿蛋白水平高于非免疫抑制劑組。即使免疫抑制劑可以延緩腎臟進展,但由于尿蛋白水平較高,這種作用也可能已經減弱[11]。隨機對照試驗結果顯示,與全劑量潑尼松相比,MMF聯合潑尼松治療有活動性增殖性病變(細胞和纖維細胞性新月體,毛細血管細胞增多或壞死)的IgAN患者的不良反應更少[12]。另一項雙盲隨機對照試驗納入了eGFR≥50 ml/(min·m2)的患者,得出了相反的結論,即MMF不能減輕IgAN患者的蛋白尿[13]。
Ma等[14]研究納入IgAN合并3或4期CKD患者。結果表明,對于腎功能不全的IgAN患者,低劑量糖皮質激素聯合口服CTX可能比支持治療更有效。本研究中,應用CTX的患者較少,未能進行亞組分析以評估CTX的有效性。建議CTX僅用于進行性腎功能不全或腎活檢有血管炎病變的IgAN患者[15]。相關研究報道了羥氯喹在IgAN患者中的有效性和安全性[16],此外,有研究得出相反的結論[17-19]。今后的研究應集中于有腎功能不全且疾病慢性化的IgAN患者。
STOP-IgAN試驗表明,嚴格的支持治療可以顯著延緩疾病進展。然而,在STOP-IgAN試驗中,在支持治療基礎上增加免疫抑制劑并未改變長期臨床結局(蛋白尿和eGFR)[9]。一項大型隨機臨床試驗(TESTING試驗)與STOP-IgAN試驗結論存在差異[20]。TESTING試驗中的eGFR甚至低于30 ml/(min·m2),這可能對研究結果產生了一定的影響。此外,IgAN的發病率和嚴重程度因種族而異[21-23]。Li等[21]發現IgAN人群之間存在顯著的等位基因異質性,這可能是中國和歐洲人群之間易感性不同的原因。與其他種族的個體相比,患有IgAN的亞太地區個體發展為終末期腎臟病(End-stage renal disease,ESRD)的風險增加(P=0.01)[22-23]。
本研究結果顯示,免疫抑制劑組不良事件的發生率較高(約12%),這可能與接受糖皮質激素的患者比例較高(約68%)有關。既往Pozzi等[24]發現,糖皮質激素可顯著降低血肌酐水平不超過1.5 mg/dl的IgAN患者的蛋白尿,并防止腎功能惡化。盡管使用糖皮質激素可以控制蛋白尿的進展,但可能會發生嚴重的不良事件,如感染、新發糖尿病、消化道出血、骨折/骨壞死、心血管事件等[20,25-27]。因此,在使用糖皮質激素時,需要充分評估患者的耐受性和風險收益比。TESTING試驗招募了750例疾病進展高風險的受試者,其中262例患者因嚴重不良事件而退出[20,28]。雖然糖皮質激素降低了主要腎臟結局的發生風險,包括終末期腎臟病、因腎功能衰竭導致的死亡或eGFR下降超過40%,但增加了嚴重不良反應的發生率[20]。指南建議對于優化治療超過90 d,且蛋白尿仍高于0.75~1 g/d的CKD進展高風險的IgAN患者,可考慮使用糖皮質激素治療。因此,本研究結果的差異可能與糖皮質激素和免疫抑制劑的使用有關。
綜上所述,免疫抑制治療并不能改善患有腎功能不全的IgAN患者的累積生存率。本研究發現,在免疫抑制劑組中,高eGFR組的累積生存率優于低eGFR組。本研究的缺點是隨訪時間短,沒有觀察到免疫抑制治療的長期效應。由于樣本量有限,未能對相同疾病狀態下的患者進行匹配,且未能對尿蛋白、是否應用糖皮質激素、免疫抑制劑類型等進行亞組分析,從而排除這些因素對研究結果的影響。因此,未來需要進行多中心前瞻性研究,針對腎功能不全的IgAN患者進行研究。
4 結論
本研究表明,免疫抑制劑未能改善腎功能不全的IgAN患者的生存率,但增加了不良反應的發生率。免疫抑制治療對eGFR較高的患者是有效的,必須進一步評估風險/益處,并密切監測應用糖皮質激素和免疫抑制劑期間不良反應的發生情況。

