實驗室制備高產率硫酸亞鐵銨條件的研究
常越凡,張慧捷,馬衛華
(山西工程職業學院,山西 太原 030009)
0 引言
(NH4)2Fe(SO4)2·6H2O 的實驗室制備過程涉及多個化學基本操作過程,作為一個綜合性實驗,成為了大學化學實驗內容之一[10-12]。但文獻研究發現[13-17],在實驗室制備的(NH4)2Fe(SO4)2·6H2O 產品往往存在產率較低或純度較低的問題,導致試劑的利用率降低,制得的產品由于雜質含量較高而無法直接利用。本文通過研究原材料鐵和硫酸的加入比例,在水浴條件下反應最終得到(NH4)2Fe(SO4)2·6H2O。通過表征產品的純度及產率,以期找到高純度、高產率的制備條件,為(NH4)2Fe(SO4)2·6H2O 的制備提供一定參考。
1 實驗原理
單質鐵與硫酸反應生成硫酸亞鐵,在酸亞鐵溶液中加入等物質的量的硫酸銨,待硫酸銨完全溶解后,將溶液蒸發結晶,得到六水合硫酸亞鐵銨,反應方程式如式(1)、式(2):
用目測比色法估計產品中所含雜質Fe3+的量,由于Fe3+與SCN-生成紅色配合物[Fe(SCN)n]3-n。當溶液的紅色越深,表明產品中的Fe3+越多;取一定質量的產品配制成一定濃度的溶液,加入KSCN 后,利用產品中Fe3+與SCN-生成配合物顏色的深淺,與含一定量Fe3+的標準物[Fe(SCN)n]3-n系列進行目視比色,根據顏色的深淺程度,即可知制得的(NH4)2Fe(SO4)2·6H2O 晶體中Fe3+的含量,從而確定產品等級。
采用1,10-菲啰啉分光光度法,在pH=2~9 的范圍內,Fe2+可以與1,10-菲啰啉生成穩定的橙色配合物。根據lambert-beer 定律,可以通過測定該配合物最大吸收波長處的吸光度,計算二價鐵離子含量,進而判定產品純度。
2 實驗部分
2.1 試劑與儀器
試劑:鹽酸(1∶1)、稀硫酸(3 mol/L)、硫酸銨(分析純)、無水碳酸鈉(分析純)、還原鐵粉(分析純)、無水乙醇(分析純)、六水合硫酸亞鐵銨(分析純)、硫酸高鐵銨(分析純)、硫氰化鉀(分析純)、緩沖試劑混合溶液(0.025 mol/L 鹽酸鄰菲啰啉溶液、0.5 mol/L 氨基乙酸溶液、0.1mol/L 氨三乙酸溶液,按體積比5∶5∶1配制)。
儀器:UV1800 紫外-可見分光光度計、AUW320電子分析天平、真空循環水泵。
隨著手工技藝在設計領域的不斷發掘,可以預見的是將來的設計領域將會越來越強調人性的關懷、個性的張揚以及文化屬性的體現,部落式的、階層性的消費符號通過手工的打造會不斷涌現。手工藝和設計之間的關系亦會越來越密切,兩者抑或成為互不可缺的組成部分。設計領域的新手工藝運動中的設計理念也會對設計教育提出新的要求,會要求設計教育不但要培養會設計的設計師,還要培養會動手的設計師。
2.2 硫酸亞鐵銨的制備
2.2.1 原料凈化
于燒杯中稱取一定量的還原鐵粉,加入一定體積的15%(質量分數)碳酸鈉溶液,加熱煮沸10 min,以除去表面少量的油污。傾瀉倒去碳酸鈉溶液后,所得鐵粉用去離子水洗至中性,最后用適量無水乙醇洗滌,晾干備用。
2.2.2 制備硫酸亞鐵
稱取一定質量的凈化后的鐵粉于錐形瓶中,并加入相應體積的稀硫酸,水浴加熱至不再有氣泡放出。反應結束后,趁熱過濾至蒸發皿中。所稱鐵粉中未反應完的部分晾干后稱量,以此計算實際與硫酸反應的鐵的質量。
2.2.3 制備硫酸亞鐵銨
根據反應生成硫酸亞鐵的量,按反應方程式計算并稱取所需(NH4)2SO4的質量。在室溫下將(NH4)2SO4緩慢加入盛有硫酸亞鐵溶液的蒸發皿中,攪拌使(NH4)2SO4溶解完全。將所得混合溶液用沸水浴加熱濃縮,待溶液中大部分水分蒸干,取下蒸發皿,靜置使其自然冷卻至室溫,待硫酸亞鐵銨晶體完全析出。
將所得產品減壓過濾,用少量無水乙醇洗滌晶體,過濾完畢后取出晶體,用濾紙吸除晶體表面殘留的水和乙醇,放置在室溫中待產品完全晾干(產品質量達到恒重),稱量產品質量。
2.3 Fe3+含量分析
2.3.1 標準色階溶液的配制
準確稱取一定質量的硫酸高鐵銨,配制成Fe3+質量濃度為1.000 g/L 的標準儲備溶液,再將儲備液稀釋成一定濃度的使用液,再分別準確移取3 個不同體積的使用液于3 支25 mL 比色管中,依次加入1 mL鹽酸溶液(1∶1)和2 mL 25%KSCN 溶液,用去離子水定容至刻線,搖勻。標準色階中Fe3+含量如表1所示。

表1 標準色階中Fe3+含量
2.3.2 產品溶液的配制
稱取0.50 g 硫酸亞鐵銨產品,置于25 mL 比色管中,加入一定體積的除氧水溶解晶體,然后依次加入1 mL 鹽酸溶液(1∶1)和2 mL 25%KSCN 溶液,最后用無氧水定容,搖勻。將配制好的溶液與標準色階進行目視比色,確定產品等級。
2.4 產品純度檢驗
2.4.1 吸收曲線和標準曲線的繪制
于分析天平上準確稱取一定質量的硫酸亞鐵銨,用一定體積稀硫酸溶解后定量轉移至容量瓶中,用無氧水稀釋至刻度,搖勻,配制成Fe2+質量濃度為1.500 g/L 的標準儲備溶液。準確移取一定體積儲備液于另一容量瓶中,用無氧水配制成Fe2+質量濃度為75 mg/L 的標準使用溶液。再從使用液中移取不同體積的溶液于7 個容量瓶中,加入20 mL 緩沖試劑混合溶液,無氧水稀釋定容后放置約20 min。
以標準系列中Fe2+質量濃度為0 μg/mL 的溶液作為參比溶液,選擇Fe2+質量濃度為2 μg/mL 左右的標準溶液作為待測溶液,測定400~800 nm 范圍內溶液的吸光度。以入射光波長為橫坐標,吸光度為縱坐標繪制光吸收曲線。
以標準系列中Fe2+質量濃度為0 μg/mL 的溶液作為參比溶液,在最大吸收波長處測定標準系列溶液的吸光度,以標準系列溶液濃度為橫坐標,吸光度為縱坐標繪制工作曲線。
2.4.2 產品純度的測定
準確稱取一定質量的硫酸亞鐵銨產品,用一定體積稀硫酸溶解后定量轉移至容量瓶中,用無氧水稀釋至刻度,搖勻。確定產品溶液的稀釋倍數,配制待測溶液,按照工作曲線繪制時的溶液顯色方法和測定方法,在最大吸收波長處測定其吸光度。再由測得吸光度從工作曲線查出待測溶液中Fe2+的質量濃度,計算出產品的純度。計算公式如式(1):
式中:ρx為從工作曲線查得的待測溶液中鐵質量濃度,mg/L;n 為產品溶液的稀釋倍數;V 為產品溶液定容后的體積,L;m 為準確稱取的產品質量,g;M1為鐵元素的摩爾質量,55.84 g/mol;M2為六水合硫酸亞鐵銨的摩爾質量,391.97 g/mol。
由產品的純度及稱得的產品質量,計算產品的產率。
式中:(NH4)2Fe(SO4)2·6H2O 的理論產量由實際與硫酸反應的鐵的質量計算得出。
3 結果分析與討論
3.1 (NH4)2Fe(SO4)2·6H2O 的粗產率及產品等級
調整加入稀硫酸溶液的量,按照n(Fe)∶n(H2SO4)分別為1∶1.1、1∶1.2、1∶1.3、1∶1.4、1∶1.5 加入相應體積的稀硫酸溶液,最終得到的(NH4)2Fe(SO4)2·6H2O 的產品粗產率及產品等級如表2 所示。
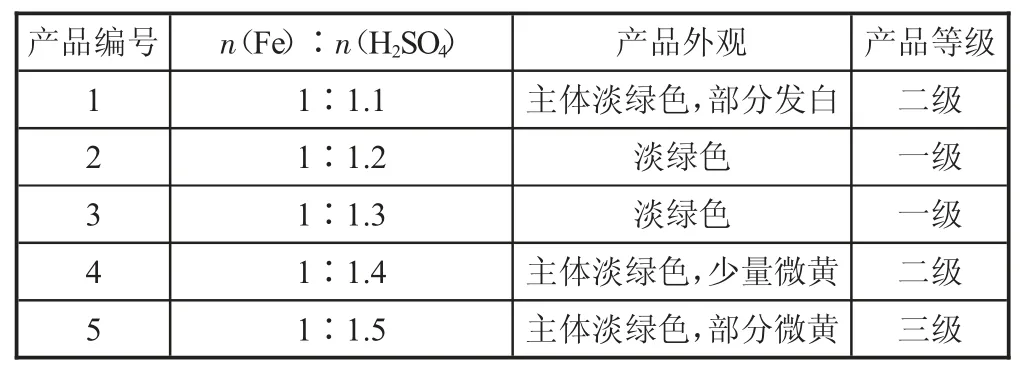
表2 按不同比例制備得到的(NH4)2Fe(SO4)2·6H2O 的產品外觀及產品等級
從表2 可以看出,加入的硫酸的量不同,制得的(NH4)2Fe(SO4)2·6H2O 的外觀和產品等級不同。其中,只有2 號和3 號產品的等級為一級,并且2 號和3 號產品的外觀為淡綠色,而其他產品的外觀上則出現少量微黃色或白色。這說明,當硫酸的量不足時,生成的FeSO4會發生部分水解,而水解后的Fe2+容易在后續的制備過程中被氧化為Fe3+,并且水解的Fe 不會和(NH4)2SO4繼續反應,因此產品中有少量(NH4)2SO4出現,產品外觀發白。因此整個制備過程中,為了提高鐵的轉化率以及防止溶液中生成的硫酸亞鐵水解,應過量加入硫酸,但過多地加入硫酸后,加速了Fe2+轉化為Fe3+的速率,導致有少量NH4Fe(SO4)2生成,產品外觀上有少量微黃色出現。實驗結果表明,加入的硫酸的量控制在1.2~1.3 之間,此時的產品等級可達到一級并且外觀呈淡綠色。
3.2 (NH4)2Fe(SO4)2·6H2O 的純度分析
含有Fe2+溶液的吸收曲線如圖1 所示。
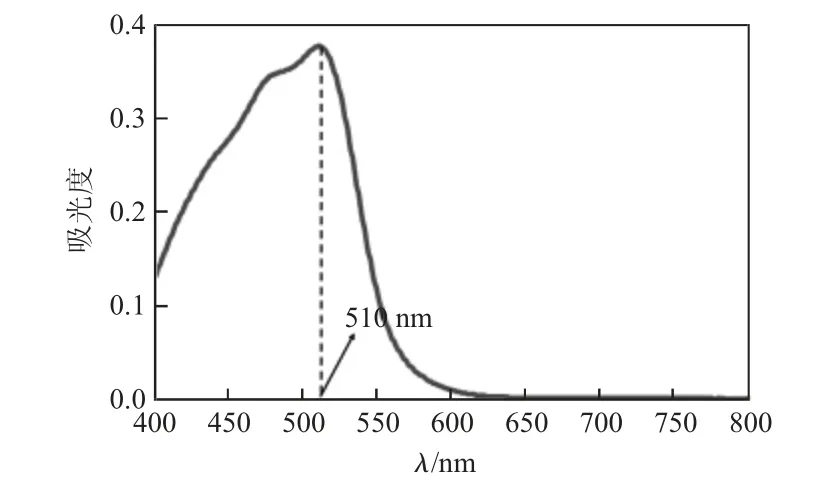
圖1 Fe2+與1,10-菲啰啉形成的配合物的吸收曲線
從圖1 吸收曲線圖可知,Fe2+與1,10-菲啰啉所形成的配合物在510 nm 處存在最大吸收。設置測定的入射光波長為510 nm,測得標準系列溶液的吸光度及標準工作曲線如表3、圖2。
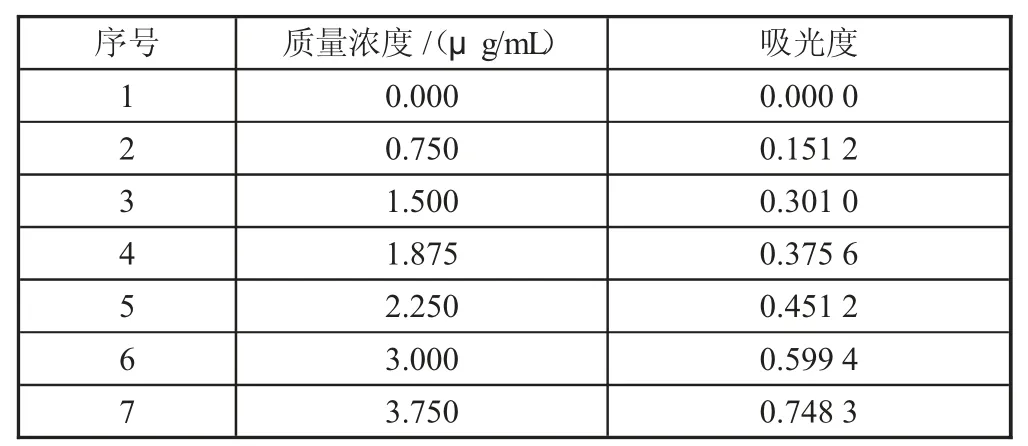
表3 標準系列濃度及相應吸光度
由標準工作曲線,結合測得的產品溶液的吸光度,再根據純度計算公式,得到產品的純度,如表4所示。
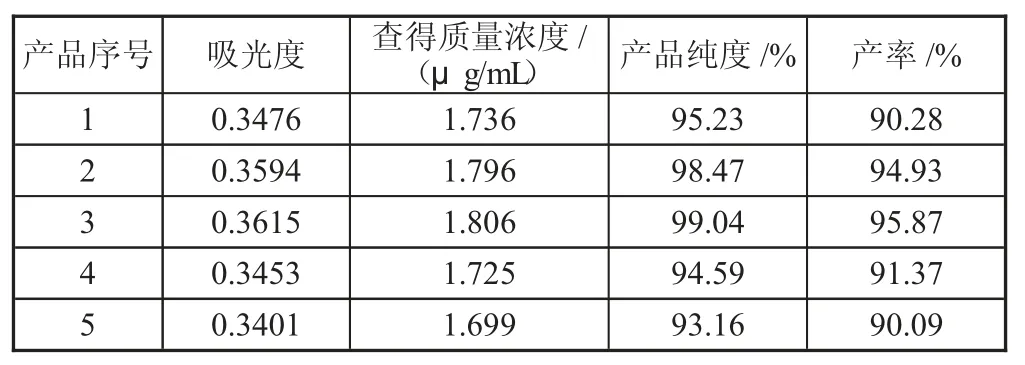
表4 根據Fe 與稀H2SO4 不同的比例得到的(NH4)2Fe(SO4)2·6H2O 的純度及產率
從表4 可知,所有(NH4)2Fe(SO4)2·6H2O 產品的產率均高于90%,當n(Fe)∶n(H2SO4)=1∶1.3 時,制備得到的(NH4)2Fe(SO4)2·6H2O 的純度最高,可達到99.04%,其產率也超過95%。這是由于該比例下合成(NH4)2Fe-(SO4)2·6H2O 時,硫酸既能很好地抑制Fe2+的水解,同時又不會加快Fe2+向Fe3+轉化的速率。
4 結論
本文研究了在制備(NH4)2Fe(SO4)2·6H2O 時,硫酸對于產品的產率及純度的影響。實驗結果表明,當硫酸過量30%時,得到的產品純度在99%以上且產率也在90%以上。產品純度接近分析純且產率較高,進而一定程度上提高了試劑的利用率,為實驗室制備硫酸亞鐵銨提供了一定的參考。

