聲帶脂肪注射術對單側聲帶麻痹患者的療效
盧柳斌,藍嘉蕓,周霓
(柳州市工人醫院耳鼻咽喉頭頸外科,廣西 柳州 545027)
聲帶麻痹是喉返神經受損引起的聲帶運動障礙,分為單側不完全麻痹、單側完全性麻痹、雙側不完全性麻痹、雙側完全性麻痹和雙側聲帶內收性麻痹五種類型[1]。單側聲帶麻痹以聲嘶、誤吸、咳嗽為主要表現,若未及時治療可誘發慢性咽喉炎、聲帶息肉等,極大的影響患者生活和工作。因此,尋求安全有效的治療手段是改善單側聲帶麻痹患者發音功能和吞咽功能成為臨床研究的熱點問題。
目前,治療單側聲帶麻痹患者的主要治療方法有藥物治療及外科手術治療,藥物治療主要作用為改善血液循環、抗炎消腫等,但其治療效果相對較差[2];外科手術治療是單側聲帶麻痹患者首選治療方案,聲帶脂肪注射術指將自體脂肪填充至聲帶不同層次或門旁間隙,可縮小聲門間隙,既往常用于治療聲帶溝疾病[3-4]。目前聲帶脂肪注射術在單側聲帶麻痹中的療效仍缺乏研究驗證,遠期效果也存在爭議[5]。基于此,本研究選取100例患者進行隨訪調查,觀察聲帶脂肪注射術對單側聲帶麻痹患者聲門裂隙、麻痹側聲帶表面積和嗓音聲學參數的影響。
1 資料與方法
1.1 一般資料
選取2020年1月至2021年1月柳州市工人醫院收治的100例單側聲帶麻痹患者作為研究對象,其中男性53例,女性47例;年齡(45.37±6.94)歲。納入標準:(1)患者均明確診斷為單側聲帶麻痹[6];(2)入組前僅接受藥物治療且均接受延期手術(聲帶麻痹病程>6個月);(3)患者均獲得隨訪結果及病歷資料均完整;(4)年齡≥18周歲。排除標準:(1)合并冠心病、肝衰竭、終末期腎病等重要臟器疾病者;(2)非首次發病患者,入組前接受過手術治療者;(3)合并呼吸道疾病者;(4)合并嚴重精神疾病者。本研究符合《赫爾辛基宣言》的基本原則,所有患者均簽署知情同意書。按照治療方法將患者不同分為研究組與對照組,每組各50例。兩組患者年齡、性別等一般資料比較,差異無統計學意義(P>0.05)。見表1。
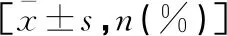
表1 兩組患者一般資料比較
1.2 方法
對照組接受藥物治療。(1)10 mL銀杏葉提取物注射液(悅康藥業)溶于250 mL生理鹽水中,1 mg甲鈷胺注射液(江蘇聯環藥業)溶于100 mL生理鹽水中,靜脈滴注,1次/d。(2)霧化吸入治療:將0.3~0.5 mg·kg-1·d-1地塞米松(杭州民生藥業)加入 20 mL 生理鹽水中。霧化治療期間將氧流量控制在4 L/min左右, 20 min/次,2次/d。(3)高壓氧治療:采用醫用氧艙,壓力0.2~0.5 MPa, 60 min/次,1次/d。治療1個月。
研究組接受聲帶脂肪注射術。對患者腹部進行消毒,做4~5 cm的橫切口,切開皮膚和皮下到達脂肪層,選取顆粒飽滿的脂肪粒用組織剪切下,棄去筋膜和血管組織,取得純脂肪顆粒3~5 mL放入1 mL注射器數支中備用。注射方法:囑患者仰臥在手術臺上,氣管插管,給予全身麻醉,將喉鏡經口腔插入,直達聲門上方,充分暴露聲門及麻痹側聲帶,在攝像系統監視下,經環甲膜和甲狀軟骨將長針頭刺入喉腔和患側聲帶,連接裝滿脂肪顆粒的1 mL注射器,注射量為2~4 mL,可根據患者聲帶位置調整劑量。在聲帶前、中、后3個位置進行注射,在每次注射時,均需先注射聲帶肌層,隨后再對聲帶粘膜下層進行注射,見患側聲帶比健側聲帶略飽滿即可。術后要求患者絕對禁聲3周,采用術后2~3 d予激素霧化吸入。腹部傷口1~2 d換藥1次,1周后拆線。
1.3 觀察指標
于治療前、治療1、6及12個月后檢測,(1)聲帶閉合時聲門裂隙、麻痹側聲帶表面積:檢測聲門裂隙、麻痹側聲帶表面積,檢測儀器為頻閃喉鏡。檢測步驟:表面麻醉后從鼻腔導入日本Olympus電子喉鏡,囑患者深吸氣5次和發元音“e”5次。在喉鏡圖像工作站中獲取聲門圖像5~7 s(25幀/s),按照幀數回放聲門圖像,保留最大吸氣與發音時的圖像。在最大吸氣相測出聲門中線的距離,與手術中測出的真實數值對比,從而推算出圖像中1 mm長度對應的真實尺寸,以此為標尺,將所有圖像導入由Adobe公司開發的Photoshop CS6 Extended,使用像素測量功能,在最大吸氣相測量麻痹側聲帶表面積,在發音相測量聲門裂隙面積。(2)嗓音聲學參數:進行嗓音聲學分析。儀器為上海泰億格公司提供的Dr Speech軟件,步驟:指導患者舒適、自然、平穩、持續地發元音“e”,將聲信號輸入頻譜分析儀,進行聲學參數分析,記錄頻率微擾、振幅微擾、標準化聲門噪聲能量(normalized noise energy,NNE)及最長聲時(maximum phonation time,MPT)。(3)嗓音障礙影響程度:采用嗓音障礙指數量表(voice handicap index,VHI)評估嗓音障礙影響程度,該量表包括功能、生理、心理3部分的自身感受,每個部分包含10個項目,各項目按照0(無影響)~4分(影響程度最嚴重)計分。量表最高分120分,得分越高表示對患者生活的影響程度越嚴重[7]。(4)嗓音嘶啞評估(GRBAS scale):進行GRBAS評估,評價指標包括總嘶啞度(G)、粗超聲(R)、氣息聲(B);每個指標均按照0~4分計分,0分為正常,1分為輕度異常,2分為中度異常,3分為重度異常[8]。(5)并發癥:包括胃腸道不適、皮疹、呼吸困難、喉部血腫、感染等,并對比兩組不良反應發生情況。
1.4 統計學分析

2 結果
2.1 兩組患者治療前后閉合時聲門裂隙、麻痹側聲帶表面積比較
兩組患者治療前聲帶閉合時聲門裂隙和麻痹側聲帶表面積比較,差異均無統計學意義(P>0.05)。治療后,兩組麻痹側聲帶面積比治療前均增加,且研究組高于對照組;聲帶閉合時聲門裂隙比治療前均縮小(P<0.05),且研究組小于對照組(P<0.05)。見表2。

表2 兩組患者治療前后閉合時聲門裂隙、麻痹側聲帶表面積比較
2.2 兩組患者前后頻率微擾、振幅微擾、NNE、MPT比較
兩組患者治療前頻率微擾、振幅微擾、NNE、MPT比較,差異無統計學意義(P>0.05)。治療后,兩組患者MPT均比治療前延長,且研究組長于對照組(P<0.05);NNE、頻率微擾、振幅微擾比治療前降低,且研究組治療后各時間點均低于對照組(P<0.05)。見表3。

表3 兩組患者治療前后頻率微擾、振幅微擾、NNE、MPT比較
2.3 兩組患者治療前后VHI評分比較
兩組患者治療前VHI評分功能、生理、情感各維度評分及總分比較,差異均無統計學意義(P>0.05)。治療后,兩組患者各維度評分及總分均低于治療前,且研究組低于對照組(P<0.05)。見表4。
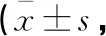
表4 兩組患者治療前后VHI評分比較分)
2.4 兩組患者治療前后GRBAS比較
兩組患者治療前GRBAS評分比較,差異無統計學意義(P>0.05)。治療后,兩組患者G、R、B評分均降低(P<0.05),且研究組治療后各時間點均低于對照組(P<0.05)。見表5。
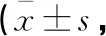
表5 兩組患者治療前后G、R、B評分比較分)
2.5 兩組患者并發癥發生情況比較
對照組出現1例胃腸道不適,研究組未出現并發癥。兩組患者并發癥發生率比較,差異無統計學意義(χ2=1.010,P=0.315)。
3 討論
聲帶麻痹的藥物治療主要以改善微循環、營養神經因子、抗炎消腫等,如地塞米松主要有抗炎消腫等作用,高壓氧治療則可以促進側支循環的建立,改善微循環以及受損神經[2]。但目前關于藥物治療聲帶麻痹的療效還未明確,因此聲帶麻痹患者的主要治療方式仍以外科手術為主。其中外科手術治療包括即刻手術和延時手術兩種方案,部分經保守治療無效或觀察一段時間后治療無效的患者以延期手術為主,其經典術式包括聲帶內注射術、喉支架成形術、喉神經修復手術等[9-10]。
聲帶內注射術具有操作簡單、效果顯著等優勢,應用頻率較高[11-12]。一直以來,聲帶內注射術的注射物質包括自體脂肪、特氟隆、液體石蠟組織、膠原蛋白生物和透明質酸等。各類注射物質均有其優缺點,特氟隆、液體石蠟組織填充后排異反應大,已較少應用[13]。膠原蛋白生物發生過敏或排異反應的概率較高,而透明質酸易吸收,但遠期療效不穩定[14]。自體脂肪的網狀纖維成分中存在脂肪顆粒、單細胞、脂滴組織等,其結構與粘彈性與聲帶結構相似,注射后更容易存活[15-16]。本研究結果顯示,治療后1、6個月,研究組患者后聲門裂隙、麻痹側聲帶表面積、頻率微擾、振幅微擾、NNE、最長聲時MPT、VHI評分總分和GRBAS評分均優于治療前和對照組,這與Van Doren等[17]研究結果基本一致,證實聲帶脂肪注射術可縮小聲帶麻痹患者聲門裂隙,改善患者發音效果。其原因可能在于,自體脂肪注射后可使恢復縮小的聲帶體積,發聲時聲帶隆起和內移,且其柔軟性可保持聲帶黏膜振動質量,因此患者術后發音質量顯著提升[18-19]。
本研究顯示,研究組患者治療后12個月閉合時聲門裂隙、麻痹側聲帶表面積和頻率微擾、振幅微擾、NNE、MPT與治療6個月比較,差異無統計學意義。這可能是因術后6個月脂肪的吸收已趨于穩定,成活的脂肪細胞中有新生血管形成,大部分聲帶結構問題和聲音嘶啞已得到改善[20]。然而對照組患者治療后12個月各指標較治療后6個月卻有所上升,可見與藥物治療相比,聲帶脂肪注射術治療單側聲帶麻痹患者遠期療效確切。此外,因聲帶填充物壓迫、脂肪注射過量等原因,聲帶脂肪注射術患者有可能并發呼吸困難、喉部血腫和取脂部位感染等并發癥。但本研究中,研究組未出現并發癥,這與本研究在術中多采用在患側聲帶三個平面、多個角度的方式注射,可以使脂肪顆粒均勻分布于甲杓肌的深面、淺面和聲帶黏膜下,避免了填充物壓迫,也保證了脂肪注射量。
綜上,聲帶脂肪注射術有助于消除單側聲帶麻痹患者聲門裂隙,提高者嗓音質量,遠期效果較藥物治療穩定,值得推廣。

