膀胱癌全切術患者術前中性粒細胞-淋巴細胞比率對生存結局的預測分析
李明東,鐘鑫,汪朗錕,豆鵬,林天海,張朋
(四川大學華西醫院泌尿外科,四川 成都 610041)
膀胱癌在全世界男性常見確診癌癥中發病率位列第七,在全人群中發病率排名第十[1]。根治性膀胱切除術是高風險浸潤性膀胱癌的標準手術療法。得益于手術方法和相關技術的改良與進步,膀胱癌患者的預后有了顯著提升。然而,由于膀胱癌隱匿性轉移的可能性高,大約50%的患者在RC術后5年內出現復發[2-4]。因此,高危患者通常先接受新輔助治療以求降低術后復發率,提高整體生存預期。但根據臨床分期選擇高危膀胱癌患者術前新輔助治療對于總生存期(OS)的改善并沒有取得預期效果。因此,臨床需要更好的術后生存預測指標,借此更精確的劃定高危膀胱癌患者的范圍。目前指南[5-6]推薦的預后參考指標大多基于組織病理學(腫瘤分期、淋巴結狀態、腫瘤位置等),而這些指標只有在病檢后才能得到準確結果。信息不完整的術前評估無法指導制定最佳的治療策略。因此,急需尋找出具有理想預測價值且低成本、易于獲得的術前生物標志物[7-8]。
炎癥生物標志物對于腫瘤患者預后的預測價值已引起人們的關注[9]。研究[10-12]表明,外周血中炎癥指標的變化與膀胱癌預后有關,其中,中性粒細胞與淋巴細胞比值(NLR)是研究最多的參數。匯總分析表明治療前NLR升高人群的生存率較差,而在一項隨機III期試驗[13]中,NLR在MIBC上的預后和預測價值均未達到預期。因此,術前NLR作為膀胱癌RC預后指標的臨床效用仍然存在爭議。本研究旨在探討接受RC的膀胱癌患者的術前NLR水平是否具備評估RC預后的價值及其預測效能。
1 資料和方法
1.1 一般資料
選取2010年12月至2020年5月四川大學華西醫院收治并接受了RC術式的482例膀胱癌患者作為研究對象。納入標準:(1)經病檢確診為膀胱腫瘤且行膀胱全切術的患者;(2)術前已完善血常規檢驗,且無感染性疾病或其他可引起查血指標異常的情況。排除標準:(1)非膀胱尿路上皮癌;(2)腫瘤遠處轉移;(3)未行盆腔淋巴結清掃;(4)心、肺、肝、腎等重要臟器功能不全;(5)伴發其他系統惡性腫瘤;(6)接受過新輔助治療;(7)聯系方式變更、失訪、臨床資料不全。方案符合《赫爾辛基宣言》要求,且患者及家屬均簽署知情同意書。
1.2 觀察指標
(1)收集患者的臨床和手術相關數據,包括年齡、性別、體質量指數(BMI)、吸煙狀況、糖尿病史、高血壓史、輔助治療方法以及手術方法。(2)病理數據從術后病理報告中獲得,腫瘤分級、TNM分期、手術邊緣陽性(PSM)的判定由兩位經驗豐富的特定病理專家根據WHO國際泌尿病理學會共識分類(2004年)標準[14]和美國癌癥聯合委員會(AJCC,2017年,第8版)TNM分期標準[15]進行進一步評估。(3)中性粒細胞與淋巴細胞比值(NLR)定義為行術前7 d內血常規檢查的中性粒細胞計數除以淋巴細胞計數。(4)總生存期(Overall survival,OS)定義為從接受RC至因任何原因引起的死亡時間。(5)無復發生存期(Recurrence-free survival,RFS)定義為從接受RC到任何影像學或病理證實的復發或隨訪截止的時間。(6)患者在第1年每3個月接受一次影像學隨訪(包括胸部、腹部CT),第2年每6個月接受1次影像學隨訪,之后每年進行1次。(7)必要時進行尿液脫落細胞學檢查和骨掃描。
1.3 統計學分析

2 結果
2.1 患者基本情況
本研究納入患者中位隨訪時間為44個月(四分位距:16-65),其中男性410例,女性72例,患者平均年齡65歲。本研究截止時(2022年11月8日),復發患者共計205例(42.5%),死亡患者共計209例(43.4%,死亡原因不限)。基于ROC曲線下面積(AUC)OS(0.565)比AUCRFS(0.541)具有更好的功效,因此選擇AUCOS對應的最佳截止值(3.89),將患者分為高NLR組(n=120),低NLR組(n=362)。
2.2 基于NLR的人口統計學和病理學相關一般資料
與低NLR組比較,高NLR組中高齡男性患者占比更高,BMI更低,TNM分期中晚期(pT≥pT3,pN+)、手術切緣陽性患者占比更高,以上指標均具有統計學意義(P<0.05)。見表1。
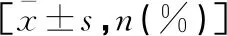
表1 膀胱癌全切術患者的一般資料
2.3 NLR對病理結果的預測價值
Logistic 回歸分析顯示,高NLR水平與晚期病理分期(pT≥pT3)、合并淋巴管侵犯具有相關性(P<0.05)。兩組間的Kaplan-Meier及Log-rank分析顯示,高NLR組患者的OS及RFS更差(P<0.05)。見表2及圖1。


表2 NLR的Logistic 回歸分析及其對于病理指標的預測價值
2.4 NLR對OS的預測價值
高NLR組的5年總生存率為46.6%,而低NLR組為59.2%。單因素cox回歸提示高NLR與更差的OS顯著相關。在多變量分析中,高級別腫瘤、晚期病理分期、合并淋巴管侵犯及高水平NLR是致使OS更差且具有統計學意義的預后因素。進一步分析顯示,高NLR患者若術后病檢提示合并淋巴管轉移和晚期病理分期,特別是pT4分期,則術后總生存時間將顯著降低。見表3及表4。

表3 Cox比例風險模型(基于OS)

表4 高NLR亞組的Cox回歸分析(基于OS)
2.5 NLR對RFS的預測價值
高NLR組及低NLR組的的5年無復發生存率分別為39.4%和58.6%。單因素Cox回歸提示高NLR患者的RFS明顯縮短。將余下有統計學意義的變量共同納入多因素分析后,發現只有晚期病理分期及合并淋巴管侵犯是RFS的獨立影響因素;而術前NLR的高低對于RFS的影響無統計學意義(P>0.05)。見表5。

表5 Cox比例風險模型(基于RFS)
3 討論
在膀胱癌全程規范化治療的過程中,對患者的病情發展進行準確的分類判斷至關重要,因此本研究旨在引入NLR這個低成本、易獲得、易評估的預測指標,使得對膀胱癌患者的病情評估更加完善,進而得到恰當的處理。
RC患者臨床預后與多種因素相關,而大量的研究表明炎癥反應對癌癥進展有一定的影響。如針對接受了TURBT和BCG免疫治療的非肌層浸潤性膀胱癌患者SII(系統免疫炎癥指數)與術后生存率關聯性的研究[16],提示了高SII與膀胱癌不良預后相關。此外,也有研究[17]提示慢性炎癥有助于侵襲性/轉移性膀胱癌的發展。炎癥反應中有代表性的量化指標主要包括不同細胞類型之間的比率,如LMR、NLR、PLR等[10-11]。其中,NLR是預測眾多腫瘤存活率或腫瘤狀態時研究最多的參數,據報道[18]它與各種實體瘤的不良OS相關,而其預后價值的一致性和程度至今仍然存在爭議[19]。
關于炎癥指標與膀胱癌之間關聯的研究已經發表,其中大多數肯定了術前NLR水平升高與生存率降低有關。國內的一項涵蓋214例MIBC患者的回顧性研究[20]表明,高NLR是影響患者OS的獨立危險因素。劉靜等[21]報道的252例接受RC的MIBC患者中,高NLR組預后明顯優于低NLR組,且兩組間差異有統計學意義,這與本研究結果相符。但是,NLR能否實現對膀胱癌某些組織病理學特征的準確預測,目前尚未達成共識[22]。國內吳心寬等[23]發現高NLR患者相較于低NLR患者,更易發生淋巴血管受侵,且病理分期、病理分級及腫瘤大小也更高,與本研究結果基本一致。而另一項研究[24]則顯示在TNM分期、腫瘤分級及淋巴血管侵犯方面,高NLR和低NLR兩組之間無明顯差異。但當前研究通常受到樣本量不足和隨訪期較短的限制。
本研究回顧性調查了482名接受RC的膀胱癌患者。基于術前NLR水平,將研究群體分為高NLR組和低NLR組進行分析。通過全面的分析證明了術前NLR水平升高(NLR=3.89)、高病理分級、淋巴脈管侵犯及病理分期≥pT3是降低OS的獨立危險因素,與上述文獻報道結果基本一致。此外,高水平NLR和晚期病理分期(pT≥pT3)、合并淋巴管血管侵犯、手術切緣陽性、高齡、低BMI及男性占比高存在相關性。在單因素分析中,盡管高NLR與高腫瘤分級呈正相關,且腫瘤分級在OS的多因素分析中有統計學差異,但其在RFS的多因素分析和高NLR亞組分析中并不顯著,表明NLR升高用于預測腫瘤分級的作用還有待證實。
綜上,對于接受RC的膀胱癌患者,術前NLR水平升高(≥3.89)對腫瘤晚期病理分期和淋巴結受累等不良預后具有一定的預測價值。另外,術前NLR水平升高(≥3.89)可作為OS降低的獨立預測指標。進一步的分析驗證了高NLR水平患者若合并晚期病理分期或淋巴管侵犯,則其OS將顯著縮短。因此NLR可以作為膀胱癌RC術前的生存結局預測指標。

