EGFR突變對肺腺癌預后及治療意義生物信息分析
朱明雪,閆清,王鵬,王曄,牟曉峰
(青島大學,山東 青島 266071 1 醫學部; 2 附屬青島市中心醫院檢驗科)
肺癌是全球范圍內發病率和死亡率最高的惡性腫瘤之一。由于缺乏有效的早期篩查和診斷方法,肺癌總體預后很差[1-2]。吸煙、職業性接觸致癌物是肺癌發生的常見原因[3]。遺傳易感性也是肺癌發生重要原因之一,其中主要的方式就是表皮生長因子受體(EGFR)的突變[4-6]。表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI)的興起使EGFR突變陽性的肺腺癌病人的病情得到緩解,但仍有20%~30%的病人出現EGFR-TKI耐藥[7]。研究發現,免疫細胞浸潤和鐵死亡在癌癥發生發展過程中起重要作用[8-9]。但其與EGFR突變肺腺癌的關系仍未闡明。本研究旨在通過生物信息學分析探討EGFR突變與肺腺癌預后、免疫細胞浸潤和鐵死亡的關系,以期為EGFR突變型肺腺癌的治療提供思路。
1 材料與方法
1.1 數據獲取
從癌癥基因組圖譜(TCGA)數據庫下載肺腺癌RNA測序數據、基因表達矩陣及臨床信息。共獲得肺腺癌樣本513例、癌旁正常組織樣本59例。將肺腺癌樣本分為EGFR突變組與野生組,比較兩組樣本的臨床特征差異。
1.2 基因突變景觀分析
基因突變景觀分析用于了解EGFR在肺腺癌基因組層面的突變情況。對肺腺癌EGFR突變數據、轉錄組數據和臨床數據進行分析,并利用R軟件包maftools可視化肺腺癌病人的體細胞突變,包括突變物理位置、突變類型的全景瀑布圖及突變亞組的進一步分析。
1.3 肺腺癌差異基因分析
使用R軟件包中的limma包分析肺腺癌RNA測序數據中基因的差異表達。以|log2FC|>1、P<0.05為篩選條件,篩選EGFR突變型、野生型肺腺癌和癌旁正常組織樣本中兩兩比較的差異表達基因(DEGs)。然后利用Venn圖獲取3組DEGs的重疊基因。
1.4 預后模型構建及評價
基于DEGs的重疊基因構建LASSO-Cox風險預后模型,依據模型風險評分中位值將樣本分為高、低風險組進行Kaplan-Meier(KM)生存分析。R軟件包glmnet用于signature模型的分析,Log rank檢驗用于比較高、低風險組的生存差異,時間依賴的受試者工作特征(ROC)曲線用于分析特征基因和風險評分預測的準確性,單因素Cox風險比例回歸分析用于篩選對肺腺癌有預后意義的基因。采用Spearman相關性分析方法分析EGFR突變與關鍵基因之間的相關性,利用R軟件包pheatmap展示多基因相關性熱圖。
1.5 肺腺癌EGFR突變與免疫細胞關系分析
利用R軟件包immunedeconv對EGFR突變組和野生組肺腺癌樣本進行免疫評分評估,使用Wilcox檢驗比較兩組之間的差異。采用Spearman相關性分析方法分析肺腺癌中EGFR突變與免疫細胞之間的相關性。利用R軟件包pheatmap繪制熱圖。
1.6 肺腺癌EGFR突變與鐵死亡基因關系分析
分析肺腺癌中24個鐵死亡相關基因在EGFR突變型、野生型肺腺癌組織中的差異表達。
1.7 統計學方法
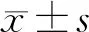
2 結 果
2.1 EGFR在肺腺癌中的突變率
EGFR在肺腺癌中存在突變,體細胞突變率為11.64%(圖1A)。瀑布圖顯示,81.48%的樣本出現突變(圖1B)。
A:EGFR在肺腺癌中突變的棒棒糖圖;B:瀑布圖顯示了肺腺癌的體細胞突變景觀。
2.2 EGFR突變與臨床特征的關系
EGFR突變與性別(χ2=5.139,P<0.05)和吸煙(χ2=36.822,P<0.01)有關,而與其他臨床特征無關。見表1。

表1 兩組臨床特征比較(例)
2.3 肺腺癌差異基因分析
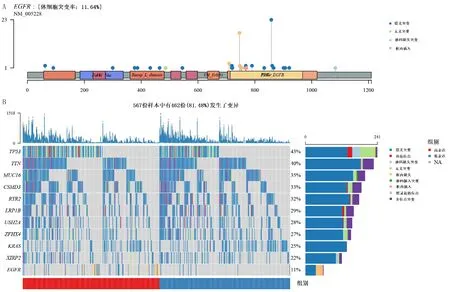
對EGFR突變型、野生型肺腺癌和癌旁正常組織樣本進行兩兩比較,得到3組DEGs。火山圖顯示,EGFR突變型與野生型肺腺癌組織DEGs中有42個上調基因,30個下調基因(圖2A);EGFR突變型肺腺癌與癌旁正常組織DEGs中有1 809個上調基因,2 143個下調基因(圖2B);EGFR野生型肺腺癌和癌旁正常組織DEGs中有1 517個上調基因,2 388個下調基因(圖2C)。對這3組DEGs取交集,得到31個重疊基因(圖2D)。
A:EGFR突變型和野生型肺腺癌組織的差異基因分析;B:EGFR突變型肺腺癌和癌旁正常組織的差異基因分析;C:EGFR野生型肺腺癌和癌旁正常組織的差異基因分析;D:利用Venn圖獲取3組DEGs的重疊基因。
2.4 預后風險模型構建及評價
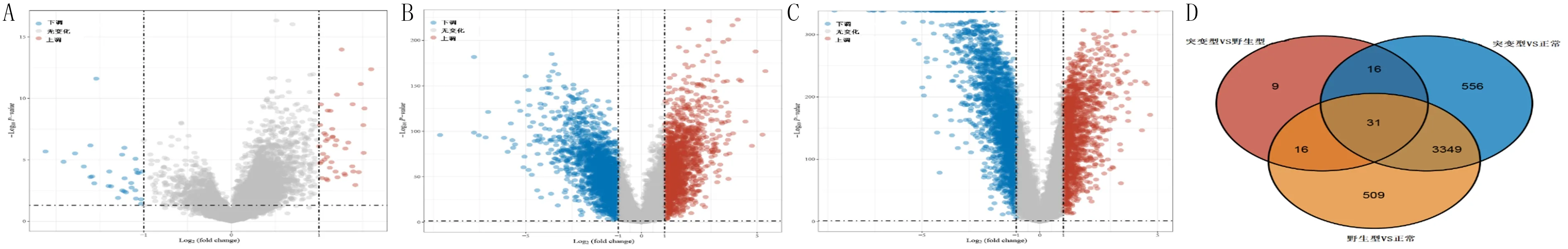
用LASSO回歸分析從31個重疊基因中篩選出4個(GLB1L3、TMEM63C、FAM83A、GPX2)建立預后模型,基因篩選過程見圖3A、B。模型風險評分的計算公式:風險評分=(-0.002 9)×GLB1L3表達量+(-0.035 2)×TMEM63C表達量+0.145 7×FAM83A表達量+0.004 6×GPX2表達量。計算出每個樣本的風險評分值,依據中位值將樣本分為高風險組和低風險組。KM曲線分析結果顯示,高風險組生存率較低(HR=1.932,95%CI=1.433~2.606,P<0.05)(圖3C)。ROC曲線分析顯示,風險評分預測病人1、3、5年生存率的曲線下面積(AUC)分別為0.700、0.658和0.622(圖3D)。單因素Cox風險比例回歸分析顯示,在31個重疊基因中,GLB1L3、TMEM63C、FAM83A是肺腺癌的預后特征基因(圖3E)。相關性分析結果顯示,EGFR突變與GLB1L3和TMEM63C呈正相關(r=0.383 1、0.382 6,P<0.05),而與FAM83A無顯著相關性(r=0.081 0,P>0.05)(圖3F)。
A:LASSO回歸系數分布圖,λ取最小值時對應的基因數為4個;B:根據十折交叉驗證結果選擇最優λ值,在λ值最小時篩選出4個基因;C:高、低風險組的KM生存曲線;D:預后風險模型預測病人1、3、5年總生存率的ROC曲線與AUC;E:單因素Cox風險比例回歸分析預后特征基因;F:預后特征基因與EGFR突變的相關性。
2.5 肺腺癌EGFR突變與免疫細胞關系
免疫細胞評分熱圖顯示,有6種免疫細胞在EGFR突變型和野生型肺腺癌中的分布差異具有顯著性(P<0.05),其中CD8+T細胞分布差異最大(圖4A)。利用CIBERSORT算法估算22種免疫細胞在肺腺癌樣本中的浸潤豐度,其中CD8+T細胞的浸潤豐度最大(圖4B)。分析預后特征基因與免疫細胞的相關性,其中B細胞和CD4+T細胞均與GLB1L3、TMEM63C有顯著相關性(P<0.01)(圖4C)。
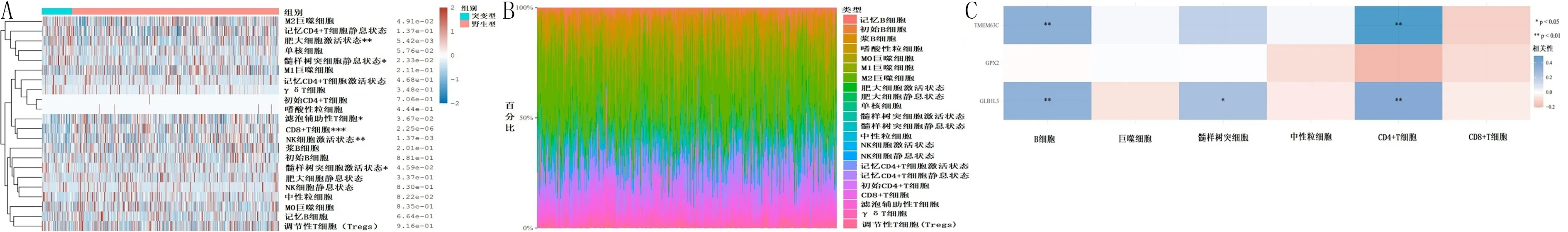
A:免疫細胞評分熱圖,*P<0.05,**P<0.01,***P<0.001;B:腫瘤免疫浸潤細胞在每個樣本中的百分比豐度;C:預后特征基因與免疫細胞的相關性分析。
2.6 肺腺癌EGFR突變與鐵死亡基因關系
在EGFR突變型和野生型肺腺癌中,ATL1、SLC7A11、GLS2等10個鐵死亡基因表達差異具有顯著性(t=1.896~3.765,P<0.05)(圖5)。

圖5 鐵死亡相關基因在EGFR突變型及野生型肺腺癌組織中的表達熱圖
3 討 論
肺腺癌是肺癌最常見的類型。EGFR基因突變是導致肺腺癌發生的重要因素。EGFR突變型肺腺癌病人預后較差[10-12]。即使臨床上廣泛應用EGFR-TKI治療EGFR突變型肺腺癌病人,最終也不可避免產生耐藥性,進而影響預后。本研究通過生物信息學分析探討EGFR突變與肺腺癌預后、免疫細胞浸潤和鐵死亡的關系,以期為EGFR突變型肺腺癌的治療提供思路。
本研究生物信息學分析顯示,EGFR在肺腺癌中的體細胞突變率為11.64%。一項口腔腫瘤研究結果表明,吸煙可以上調EGFR信號,并且能夠促進體外和體內口腔腫瘤的發生[13]。本文研究結果顯示,EGFR突變與肺腺癌病人性別和吸煙有關,進一步印證了EGFR與吸煙的關系。本研究建立了預后風險模型,并且發現GLB1L3、TMEM63C、FAM83A是肺腺癌的預后特征基因,這3個基因或將成為未來預測肺腺癌預后的重要因子。進一步分析發現,EGFR突變與GLB1L3、TMEM63C呈正相關,這2個基因的表達或許促進了EGFR的突變,下一步可以通過細胞和動物實驗進行驗證。
免疫療法具有提高腫瘤緩解率、毒副作用小的特點。然而不同EGFR突變狀態的腫瘤對免疫治療的反應不同。T細胞在腫瘤細胞免疫中起到中心調控作用[14]。CD8+T細胞作為效應細胞,其在免疫微環境中的比例升高通常與病人的良好預后相關[15]。本研究結果顯示,肺腺癌組織中CD8+T細胞比例較高,且與EGFR突變狀態相關,預后特征基因與B細胞和CD4+T細胞具有顯著相關性,表明EGFR突變可能通過影響免疫細胞浸潤進而影響免疫治療。鐵死亡是一種鐵依賴性的細胞程序性死亡,它通過改變細胞代謝方式,使細胞大量積累脂質過氧化物和活性氧來誘導細胞程序性死亡[16]。既往有研究表明,肺癌組織中血清鐵蛋白的表達普遍增高,血清鐵蛋白的高表達在肺癌的遠處轉移中起著重要作用,并導致較差的遠期預后[17-18]。本研究結果顯示,鐵死亡相關基因CIDS1和ATP5MC3與EGFR突變具有顯著相關性,這或許提示鐵死亡對于肺腺癌的重要作用可細分至EGFR基因的突變狀態。
綜上所述,EGFR突變與肺腺癌的不良預后相關,且與腫瘤免疫細胞浸潤和鐵死亡存在緊密聯系,這為肺腺癌的進一步研究和治療提供了新思路。

