rhTPO聯合異基因造血干細胞移植對AML患者血小板恢復的影響*
朱鴻燕 譚鷹 王清松 周莉 陽梅
(四川大學華西醫院血液內科,四川 成都 610041)
急性髓系白血病(Acute myeloid leukemia,AML)是在多種因素的作用下髓系原始細胞惡性增殖,導致骨髓造血功能異常的惡性克隆性疾病,患者多表現為貧血等癥狀[1]。大多數AML患者病情兇險,若是治療不當會威脅生命。既往治療AML多采用化療,雖可延長生存期,但是化療后會引起骨髓抑制等多種并發癥[2-3]。隨著移植技術的發展,異基因造血干細胞移植(Allogeneic hematopoietic stem cell transplantation,allo-HSCT)成為治療AML最為有效的方法,使得AML的根治成為可能[4]。但是,allo-HSCT治療AML后,患者血小板會減少,而多次輸注血小板會增加病毒感染的風險,進而導致患者出血甚至死亡[5-6]。重組人血小板生成素(Recombinant human thrombopoietin,rhTPO)能縮短血小板恢復時間,減少血小板輸注,對于治療血小板減少癥療效顯著[7]。但rhTPO聯合allo-HSCT治療AML的療效尚不明確。因此,本研究以AML患者為對象,探討rhTPO聯合allo-HSCT治療對血小板恢復的影響。
1 資料與方法
1.1 一般資料 選取2020年1月—2021年12月在本院就診的74例AML患者為研究對象,隨機分為對照組和觀察組,每組37例。納入標準:①符合AML的診斷標準[8]。②18歲<年齡<65歲。③接受allo-HSCT。排除標準:①心肝腎肺功能障礙患者。②合并其他血液系統疾病患者。③存在出血或感染患者。④本研究藥物不耐受患者。⑤其他原因導致的血小板減少患者。⑥近3個月使用免疫抑制劑等對血小板有影響的藥物。⑦妊娠期或哺乳期婦女。本研究通過醫院倫理委員會審批,所有患者或者家屬均簽署知情同意書。兩組患者一般資料比較差異均無統計學意義(P>0.05),見表1。
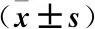
表1 兩組患者一般資料比較
1.2 干預方法 兩組患者術前均接受預處理:BFA+ATG方案:1~3 d,給予白消安(浙江大冢制藥有限公司,國藥準字J20171051)60 mg/kg;1~4 d,給予氟達拉賓50 mg(廣東嶺南制藥有限公司,國藥準字H20065121);1~4 d阿糖胞苷(ActavisltalyS.p.a.批準文號:H20100594)3 g/m2;2~8 d,兔抗人胸腺細胞免疫球蛋白(福建科瑞藥業有限公司,國藥準字H10930026)2.5 mg/kg·d。對照組予以allo-HSCT治療:先予以供者粒細胞集落刺激因子,皮下注射,每天(5~10)μg/kg,治療5 d后,下一天使用血細胞分離機,分離供者外周血造血干細胞輸注給患者,輸注量根據患者體重,(4~8)×108/kg。觀察組予以rhTPO聯合allo-HSCT治療。allo-HSCT治療方法同對照組,rhTPO治療:在干細胞植入后第3 d皮下注射rhTPO注射液(商品名特比澳,沈陽三生制藥有限責任公司,國藥準字S20050048),1500 U/d,血小板>50×109/L或治療十天后停藥。兩組患者在血小板<20×109/L時均輸注新鮮單采血小板,每次1個治療量。
1.3 觀察指標 ①血小板恢復指標:于干細胞輸注后進行血常規檢查,每天一次,記錄血小板重建時間以及血小板恢復時間。造血重建標準:停止輸注血小板后,血小板>20×109/L,并持續5 d,將血小板>20×109/L的第1 d作為血小板重建起始時間。以及血小板恢復時間:從開始治療到血小板>50×109/L的時間。檢查均由本院實驗醫學科完成。②凝血恢復指標:于治療前后測定部分凝血活酶時間(APTT)、纖維蛋白(FIB)水平、凝血酶原時間(PT)。檢查均由本院實驗醫學科完成。③炎癥指標:于治療前后測定C反應蛋白(CRP)、白細胞介素-6(IL-6)及降鈣素原(PCT)。檢查均由本院實驗醫學科完成。④血管指標:于治療前后測定血管內皮生長因子(Vascular endothelial growt factor,VEGF)和血管內皮生長因子C(Vascular endothelial growt factor-C,VEGF-C)。檢查均由本院實驗醫學科完成。⑤治療相關不良反應:記錄治療開始至治療完成期間,兩組患者主觀感受到的發熱、頭暈、感染、出血、惡心嘔吐和肌肉酸痛情況。
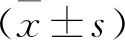
2 結果
2.1 兩組患者血小板恢復情況比較 治療后,觀察組血小板重建時間以及血小板恢復時間均短于對照組(P<0.05),見表2。
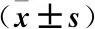
表2 兩組血小板重建時間和血小板恢復時間比較
2.2 兩組患者凝血功能指標比較 與治療前相比,治療后兩組APTT和PT水平更低,FIB水平更高,且觀察組APTT和PT水平低于對照組,FIB水平高于對照組(均P<0.05),見表3。
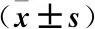
表3 兩組凝血功能指標比較
2.3 兩組患者炎癥指標比較 與治療前相比,治療后兩組PCT、CRP及IL-6水平更低,且觀察組PCT、CRP及IL-6水平低于對照組(均P<0.05),見表4。
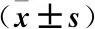
表4 兩組炎癥指標比較
2.4 兩組患者血管指標比較 與治療前相比,治療后兩組VEGF和VEGF-C水平更高,且觀察組VEGF和VEGF-C水平高于對照組(均P<0.05),見表5。

表5 兩組血管指標比較
2.5 兩組患者不良反應情況比較 治療期間,對照組不良反應總發生率低于觀察組(P>0.05),見表6。

表6 兩組不良反應發生情況比較[n(×10-2)]
3 討論
AML病因尚未明確,有學者認為,其發病原因可能與病毒感染、化學藥物刺激和放射性輻射有關,該病男性多于女性[9-10]。臨床上多采用allo-HSCT治療AML,由于造血干細胞移植前會對患者進行預處理,破壞了原有的造血功能,allo-HSCT治療的患者中,均會出現血小板減少[11-13]。臨床主要通過血小板輸注為AML患者補充血小板,而這種治療方式也會帶來一系列的負面影響,比如患者體內產生血小板抗體,使輸注的血小板并不能發揮效果,反而由于液體容量超負荷造成心肌損傷[14-16]。rhTPO初始只應用于癌癥患者經化療后體內血小板減少的治療,后來開始推廣,有研究[17]報道,rhTPO治療膿毒癥后血小板減少癥療效顯著,但在AML中的探究不足。
本研究結果提示rhTPO聯合allo-HSCT治療可以縮短血小板重建時間和血小板恢復時間。楊金樂等[18]研究發現,rhTPO可以促進allo-HSCT治療后血小板的恢復,減少血小板輸注量。allo-HSCT移植后,患者體內血小板生成素(Thrombopoietin,TPO)的表達受到抑制,影響下游信號通路,致使血小板減少[19]。rhTPO與天然的TPO結構相似,具有相同的生理功能,可以激活TPO受體,經過一系列生化反應后,誘導血小板生成,進而提高血小板水平。因此,rhTPO可以促進血小板重建和恢復。
APTT、PT及FIB均是常見的凝血功能指標,在凝血系統疾病中具有重要應用[20]。本研究結果顯示,治療后觀察組APTT和PT水平低于對照組,FIB水平高于對照組,說明在allo-HSCT治療的基礎上使用rhTPO能提高凝血功能。rhTPO可以加快巨噬細胞和造血干細胞分化,提高血小板水平,并促進血小板集聚,從而促進FIB和相關凝血因子表達,降低APTT和PT水平,進而增強凝血功能。治療后觀察組PCT、CRP及IL-6水平低于對照組,提示rhTPO聯合allo-HSCT治療可以降低炎癥反應。陶紅等[21]研究指出,rhTPO對炎癥因子具有調控作用,本研究結論與其一致。VEGF和VEGF-C與血管生成密切相關,是重要的血管調控因子[22]。本研究結果提示rhTPO聯合allo-HSCT治療可以改善造血微環境。造血微環境損傷,會引起骨髓中血管密度下降,血管生成數量和通透性降低,部分區域會出現缺血、缺氧,致使造血組織功能下降,嚴重影響正常的生理造血[23]。rhTPO可以提高血小板的水平,進而修補血管內皮細胞,促進VEGF和VEGF-C的表達,致使新生血管數量增加,提高造血微環境的血流供應,從而改善造血微環境[24]。治療期間,對照組不良反應總發生率低于觀察組,說明rhTPO聯合allo-HSCT治療安全性好。
4 結論
rhTPO聯合allo-HSCT治療AML可以縮短血小板重建時間和血小板恢復時間,增強凝血功能,緩解炎癥反應,提高造血微環境的血流供應,安全性好。

