GQDs/WS2/Fe3O4 磁分離適配體熒光傳感器構建及其在甲胎蛋白中的應用
李肖沙,劉瑩,申炳俊,金麗虹,夏冰
(1.長春理工大學 生命科學技術學院,長春 130022;2.杭州隆基生物技術有限公司,杭州 311121)
甲胎蛋白(Alpha-Fetal Protein,AFP)是白蛋白家族中一種糖蛋白,其分子量約為67~70 kDa。1956 年,Bergstrand 等人[1]首先在胎兒的臍帶血清中發現了AFP,之后Abelev 等人[2]證實了AFP 主要來源于胚胎卵黃囊和胎盤。1968 年,Tatarinov[3]在肝癌患者血清中檢測到了大量AFP。自此以后,AFP 作為一種重要的血清腫瘤標志物,被廣泛應用于原發性肝癌、睪丸、卵巢腫瘤早期診斷以及胎兒先天畸形排查等臨床檢測領域[4]。由于成人血清AFP 含量極低,如何低檢測限、寬線性范圍進行血清AFP 定量檢測,具有重要的臨床意義。
AFP 從發現至今已經發展了多種檢測方法,如放射免疫分析法[5]、熒光免疫分析法[6]、酶聯免疫吸附法[7]、化學發光免疫分析法[8]、電化學免疫傳感器[9]和電化學適配體傳感器等[10]。適配體(Aptamer,Apt)是一種人工篩選出來的單鏈DNA 或RNA 分子[11-12],它能夠高特異性和高親和力與靶標結合,過程類似抗原-抗體的結合反應。然而,適配體本身不具有信號指示作用,以適配體分子為識別元件的傳感器需要結合可識別信息,如電、光、熱、質或聲等[13-14]。熒光適配體傳感器兼具熒光檢測的高靈敏性和適配體傳感器的高選擇性,還具有精度高、檢測速度快、操作簡單和成本低等優點,是近年來生物傳感器的重點發展方向之一[15-16]。
本文以聚乙二醇化石墨烯量子點標記的適配體(GQDs-PEG-Apt)作為信標探針,利用載有四氧化三鐵納米顆粒的二硫化鎢納米片(WS2/Fe3O4)對單鏈適配體的吸附作用、熒光猝滅能力以及磁分離性質,構建一種GQDs/WS2/Fe3O4磁分離適配體熒光傳感器并用于AFP 定量檢測,原理如圖1 所示。從聚乙二醇鈍化石墨烯提高其熒光性能、磁分離WS2/Fe3O4納米復合物吸附GQDs-PEG-Apt 降低熒光背景值兩方面,來提高傳感器檢測AFP 線性范圍及檢測限。根據AFP 含量對體系中能量供體與受體間非輻射共振能力轉移(Forster Resonance Energy Transfer,FRET)效應引起熒光信號恢復信息,建立一種寬線性范圍、低檢測限的AFP 定量檢測方法。
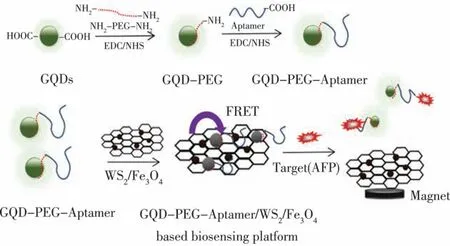
圖1 GQDs/WS2/Fe3O4 磁分離適配體熒光傳感器檢測AFP 原理
1 實驗部分
1.1 儀器與試劑
瀝青基碳纖維購自日本東麗;二硫化鎢粉末、乙酰丙酮鐵購自美國Sigma 公司;聚乙二醇(NH2-PEG-NH2)購自于芃碩生物科技公司;1-乙基-3-(3-二甲基氨基丙基)碳二亞胺(EDC)和N-羥基琥珀酰亞胺(NHS)均購自美國Sigma 公司;meso-2,3-二巰基琥珀酸(DMSA)購自上海阿拉丁;其他試劑均購自北京化工;甲胎蛋白(AFP)、糖蛋白19-9(CA19-9)、糖蛋白242(CA242)和人血清白蛋白(HSA)均購自于上海領潮生物科技公司;適配體(Apt,5?-COOH-TAG ATATGGCAGGAAGACAAACAAGCTTGGCGGCGGG AAGGTGTTTAAATTCCCGGGTCTGCGTGGTCTGTG GTGCTGT-3?)購自上海生工。
1.2 實驗方法
1.2.1 GQDs-PEG-Apt 制備及表征
首先,制備羧基化GQDs(GQDs-COOH),采用自上而下法制備GQDs,檸檬酸孵育使GQDs 表面引入羧基,得到GQDs-COOH,調節溶液pH 值,透析袋透析,濃縮后冷凍干燥。其次,制備PEG功能化GQDs(GQDs-PEG),EDC/NHS 法進行PEG功能化GQDs,微孔膜過濾大團聚體,得到小粒徑GQDs-PEG。最后,制備PEG 功能化GQDs 標記的適配體(GQDs-PEG-Apt),EDC/NHS 法使適配體5'端羧基與GQDs-PEG 氨基進行偶聯,產物GQDs-PEG-Apt 溶液采用超濾離心管進行純化和濃縮。實驗過程需要避免GQDs 發生光漂白。
1.2.2 WS2/Fe3O4納米復合物制備及表征
首先,采用水熱合成法制備WS2納米片,得到的固體用超純水充分洗滌,分散在乙醇中固體,超聲、離心,上清液為WS2納米片溶液。然后,溶劑熱合成法制備Fe3O4納米顆粒,與DMSA孵育,獲得DMSA 修飾的Fe3O4納米顆粒。最后,制備WS2/Fe3O4納米復合物,DMSA 修飾WS2納米片和Fe3O4納米顆粒孵育,獲得WS2/Fe3O4納米復合物。
1.2.3 GQDs/WS2/Fe3O4磁分離適配體熒光傳感器熒光猝滅條件優化
一定量WS2/Fe3O4納米復合物溶液和200 μL的GQDs-PEG-Apt 溶液孵育,摸索孵育溫度、時間、pH 值和WS2/Fe3O4納米復合物投入量對GQDs/WS2/Fe3O4磁分離適配體熒光傳感器性能影響。熒光測量條件為:熒光發射譜波長(λem)范圍為400~600 nm,激發波長(λex)固定為359 nm,激發/發射狹縫為10 nm/5 nm。
1.2.4 AFP 檢測條件優化
GQDs-PEG-Apt 與WS2/Fe3O4納米復合物構成的GQDs/WS2/Fe3O4磁分離適配體熒光傳感體系,黑暗條件下分別與0、2、10、50、100、300、500、800、1 000 和1 500 ng/mL 的AFP 抗體靶蛋白進行孵育,摸索孵育溫度、時間、pH 值和靶蛋白投入量對pH 檢測影響。熒光測量條件同1.2.3 節。
1.2.5 血清AFP 檢測
腫瘤標志物AFP、CA19-9 和CA242 加入到人血清中,利用GQDs/WS2/Fe3O4磁分離適配體熒光傳感體系進行血清AFP 檢測,研究傳感器特異性、靈敏度和準確性等性能。
2 實驗結果與分析
2.1 功能化GQDs 制備及表征
由圖2(a)可見,羧基化GQDs(GQDs-COOH)呈現近圓形,分散性良好,平均粒徑約5 nm,GQDs 的晶格結構清晰可見,晶格間距0.21 nm,與文獻[17]報道GQDs 的(002)晶面間距相吻合。PEG 功能化GQDs(GQDs-PEG)在乙醇中呈現類方形聚集體,如圖2(b)所示,平均粒徑8 nm,較GQDs-COOH 粒徑有所增加,這應與GQDs 表面羧基與PEG 氨基發生鍵合作用有關。
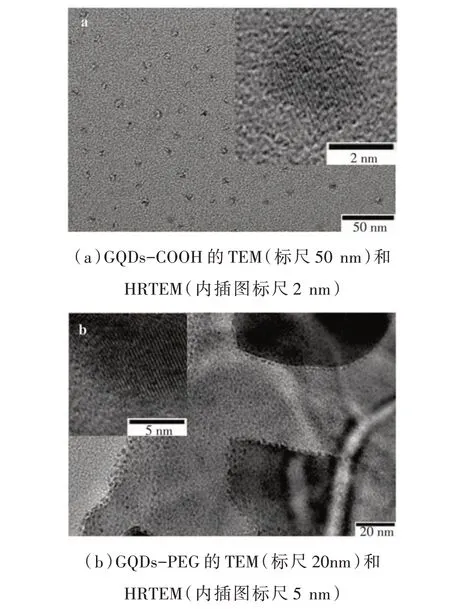
圖2 羧基化和聚乙二醇化石墨烯量子點的TEM和HRTEM
GQDs 進行PEG 功能化前后最大激發和最大發射光譜如圖3 所示。GQDs-COOH 熒光激發(λex)和發射波長(λem)分別為468 nm 和504 nm,斯托克斯位移為36 nm。PEG 功能化后GQDs 熒光強度顯著增高,359 nm 激發時,GQDs-PEG 在444 nm 和485 nm 兩波長處出現明顯的熒光發射峰,485 nm 熒光峰強度略高于444 nm,斯托克斯位移為126 nm,λex和λem分別藍移109 nm 和60 nm。在可見光照射下,GQDs-COOH 呈現棕黃色、GQDs-PEG 則呈現淡黃色。365 nm 紫外光照射下,GQDs-COOH 發出藍綠色熒光,GQDs-PEG 則發出強藍色熒光。此外,放置時間對PEG 功能化前后GQDs 熒光強度影響有所差別,GQDs-COOH 溶液熒光強度隨著放置時間增加而逐漸降低,放置時間為20 天時,熒光強度降低43.2%,表明羧基化GQDs 在溶液中并不穩定。而PEG 功能化GQDs,放置時間對其溶液熒光強度影響較小,即使放置30 天,GQDs-PEG 熒光強度變化不明顯,說明PEG 功能化有利于提高了GQDs 熒光穩定性。
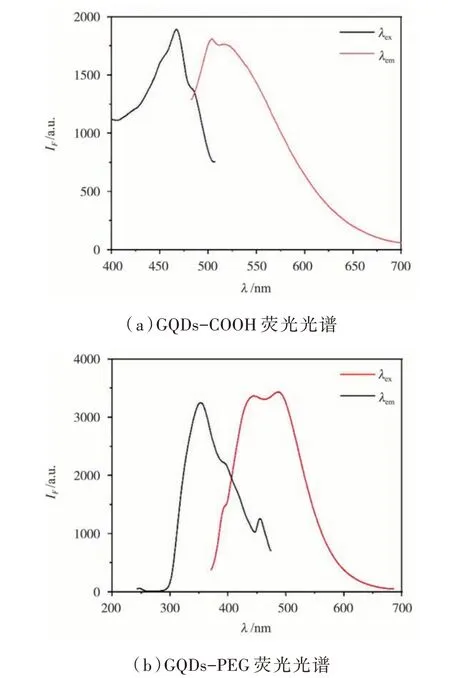
圖3 石墨烯量子點PEG 化前后熒光光譜
2.2 WS2/Fe3O4 納米復合物制備及表征
WS2/Fe3O4納米復合物透射電鏡(TEM和HRTEM)如圖4 所示,其平均直徑在220±35 nm,WS2納米片則呈現不規則片狀形態。HRTEM 清晰地呈現0.62 nm 和0.253 nm 兩種晶格間距,分別對應WS2的(002)和Fe3O4的(311)晶面結構[18]。

圖4 WS2/Fe3O4 納米復合物TEM(標尺20 nm)和HRTEM(標尺5 nm)
2.3 GQDs/WS2/Fe3O4 磁分離適配體熒光傳感器可行性分析
WS2/Fe3O4納米復合物吸收光譜如圖5 藍色曲線,在370~680 nm 范圍內該復合物存在吸收帶,吸收峰出現在648 nm。GQDs-PEG-Apt 熒光光譜(圖5 紅色曲線)與WS2/Fe3O4納米復合物吸收光譜有重疊,這是產生FRET 的前提條件。WS2/Fe3O4(100 μL,600 μg/mL)納米復合物加入到GQDs-PEG-Apt 體系后,其熒光強度被猝滅高達69.8%,如圖6 所示。因此,以適配體為AFP 分子識別元件、GQDs-PEG-Apt 為熒光探針構建GQDs/WS2/Fe3O4磁分離適配體熒光傳感器是可行的。
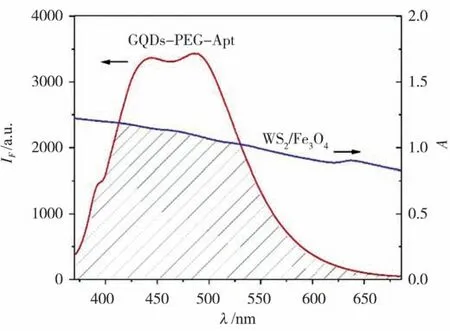
圖5 WS2/Fe3O4吸收光譜和GQDs-PEG-Apt熒光光譜重疊
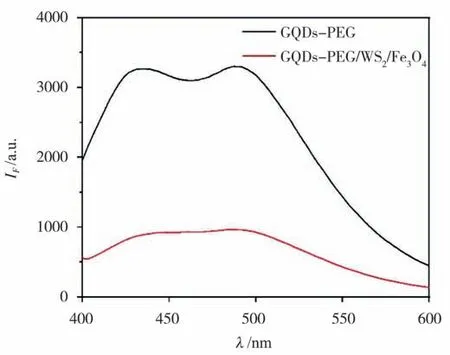
圖6 WS2/Fe3O4 對GQDs-PEG-Apt 熒光光譜影響
2.4 GQDs/WS2/Fe3O4 磁分離適配體熒光傳感器及AFP 檢測條件優化
建立具有高熒光猝滅效率的FRET 檢測體系,對FRET 能量供體GQDs-PEG-Apt 與熒光猝滅劑WS2/Fe3O4納米復合物能量受體孵育條件進行了優化。WS2/Fe3O4納米復合物對GQDs-PEGApt 在487 nm 處熒光強度(IF)和熒光猝滅效率(QE=(I0-I)/I0,I0和I分別為WS2/Fe3O4加入前、后GQDs-PEG-Apt 熒光強度)影響如圖7 所示。可以看出,WS2/Fe3O4濃度在0~420 μg/mL 時,GQDs-PEG-Apt 在487 nm 處熒光強度隨WS2/Fe3O4濃度增加呈現先降低后增加趨勢,對熒光猝滅效率影響則相反。WS2/Fe3O4濃度為300 μg/mL 時,GQDs-PEG-Apt 在487 nm 處熒光強度和熒光猝滅率分別達到了最小值和最大值。GQDs-PEG-Apt熒光被猝滅原因在于,GQDs-PEG-Apt 與WS2/Fe3O4間π-π 堆積作用和FRET。
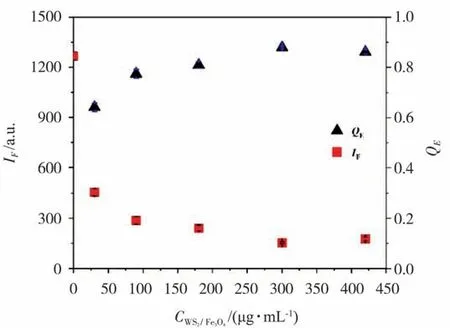
圖7 WS2/Fe3O4 對GQDs-PEG-Apt熒光強度和熒光猝滅率影響
孵育溫度、體系pH 值和孵育時間對GQDs/WS2/Fe3O4體系487 nm 處熒光強度和熒光猝滅率影響結果如圖8 所示。可以看出,孵育溫度為37 ℃時,GQDs/WS2/Fe3O4體系487 nm 熒光強度最低,37 ℃是構建傳感器GQDs-PEG-Apt 與WS2/Fe3O4最佳孵育溫度。pH 值在6.0~8.6 范圍內,各GQDs/WS2/Fe3O4體系間熒光猝滅率間差異不大,但pH值會改變適配體空間結構,進而影響GQDs-PEG-Apt 與靶受體AFP 間特異性結合和結合常數。此外,AFP 的檢測樣本為血清,為此采用生理環境7.4 為傳感器體系構建pH 值。孵育時間在25 min 時,WS2/Fe3O4對GQDs-PEG-Apt 在487 nm熒光猝滅程度最大,25 min 為兩者間的最佳孵育時間。
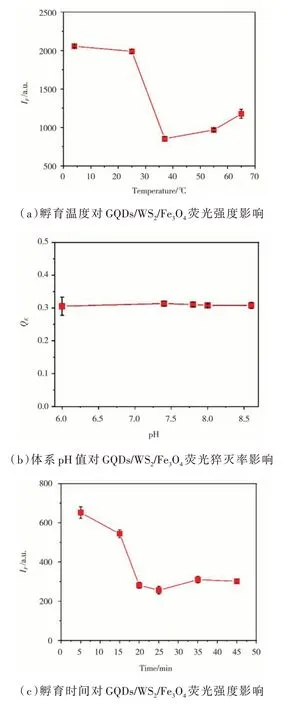
圖8 孵育溫度、體系pH 值和孵育溫度對GQDs/WS2/Fe3O4 熒光強度和熒光猝滅率影響
GQDs/WS2/Fe3O4體系構建條件為:WS2/Fe3O4投入量300 μg/mL,GQDs-PEG-Apt 與WS2/Fe3O4間孵育溫度、pH 值和孵育時間分別為37 ℃、7.4 和45 min。
2.5 AFP 檢測線性范圍、靈敏度及特異性
GQDs/WS2/Fe3O4體系在487 nm 處熒光強度隨AFP 濃度增加而增大,以AFP 濃度(CAFP)為橫坐標、熒光相對恢復值(ΔIF=I1-I2,I1和I2是加入AFP 前后的熒光強度)為縱坐標進行線性擬合,其結果如圖9 所示。可以看出,濃度在5~1 000 ng/mL 范圍內,CAFP和ΔIF具有良好的線性相關性,其線性方程為y= 4.000 036x+363.771 46(R2=0.977 53)。根據這一結果,可獲得3 倍SD(3SD)下,GQDs/WS2/Fe3O4熒光適體傳感器檢測AFP 的最低檢測限(LOD)為0.5 pg/mL。
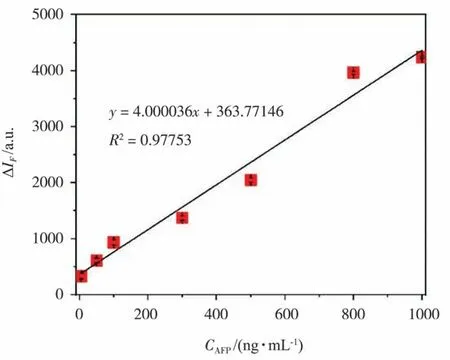
圖9 AFP 濃度與體系487 nm 處熒光恢復值線性關系
AFP、PSA 和HSA 濃度為1 000 ng/mL、CA19-9和CA242 濃度為1 000 U/mL。分別以AFP、CA242、CA19-9、PSA 和HSA 為靶標,考察不同檢測物對磁分離適配體熒光傳感體系熒光恢復率(增強)的影響,結果如圖10 所示。可以看出,文中構建的傳感體系中加入AFP 后,可顯著提高熒光強度,而CA242、PSA 和HSA 對體系熒光增強效果不明顯。原因是傳感器中的適配體僅能特異性識別AFP,并與之結合。因此,GQDs/WS2/Fe3O4磁分離熒光增強型適配體傳感可用于AFP 的特異性檢測。
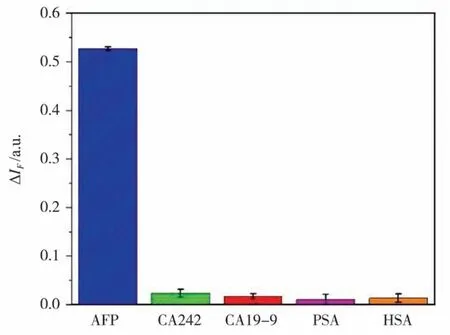
圖10 干擾物對GQDs/WS2/Fe3O4 磁分離適配體熒光傳感體系熒光恢復率影響
與現有AFP 檢測方法相比,文中構建的GQDs/WS2/Fe3O4磁分離適配體熒光傳感器對AFP 檢測線性范圍更寬,達到5~1 000 ng/mL;檢測限(LOD)更低,其值為0.5 pg/mL。文獻所述方法[19-25]與本文方法的性能比較結果如表1 所示。
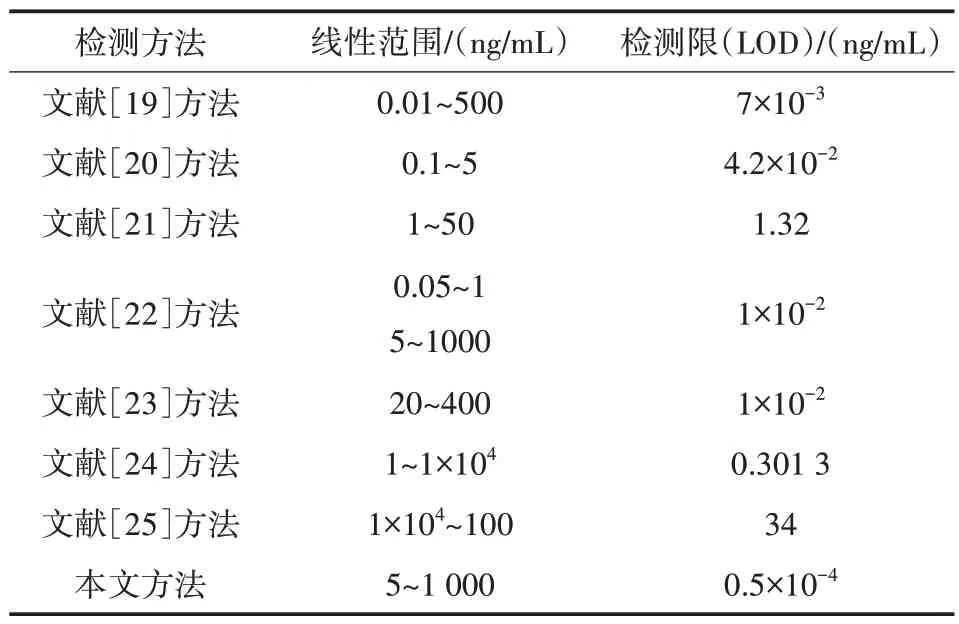
表1 用于腫瘤標志物AFP 檢測的不同方法的性能比較
2.6 血清AFP 定量檢測
磁分離熒光增強型適配體傳感檢測AFP(10、20 和50 ng/mL)血清樣本結果(n=3)、相對標準偏差(RSD)和回收率如表2 所示。實驗結果表明,AFP 的RSD 在3.32%~6.41%,回收率為91.92%~99.28%。因此,傳感器適用于實際血清樣本AFP 的測定。
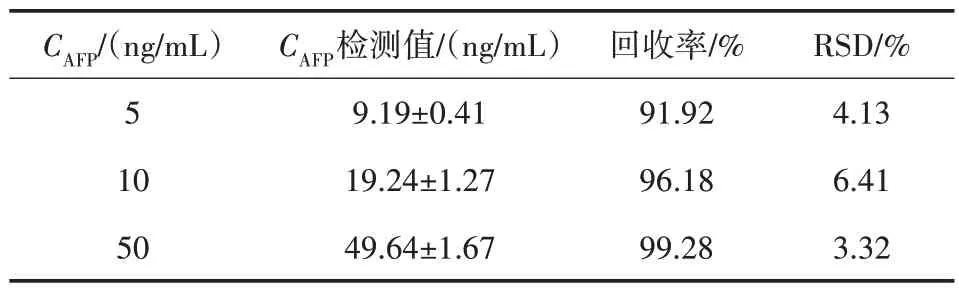
表2 血清腫瘤標志物AFP 加標真實樣品的回收率
3 結論
文中制備了具有藍色熒光性能GQDs 和磁分離WS2/Fe3O4納米復合物,基于適配體特異性結合靶標性質和FRET 原理,以GQDs-PEG-Apt 作為AFP 特異性識別分子和能量供體,WS2/Fe3O4納米復合物為能量受體,構建磁分離適配體熒光傳感器并檢測血清腫瘤標志物AFP,明確傳感器構建和AFP 檢測實驗條件。結果顯示,GQDs/WS2/Fe3O4磁分離適配體熒光傳感器定量檢測AFP 線性范圍為5~1 000 ng/mL,檢測限為0.5 pg/mL。構建的傳感器實現了血清中AFP 定量檢測,其具有特異性好、靈敏度高、檢測范圍寬、低檢測限和操作簡單等優勢。更重要的是,文中建立的GQDs/WS2/Fe3O4磁分離適配體熒光傳感體系還為其他糖蛋白生物標記物等定量檢測提供了技術理論和實驗基礎,在臨床血液腫瘤標志物檢測領域具有較高的應用價值和市場發展空間。

