通脈逐瘀顆粒聯(lián)合CPAP治療血瘀證不穩(wěn)定型心絞痛合并OSAHS的臨床研究
譚玉婷,盧英紅,王迎春,紀文巖
阻塞性睡眠呼吸暫停低通氣綜合征(OSAHS)是由于上呼吸道完全/部分阻塞而引起的反復的呼吸暫停及低氧血癥,以慢性間歇低氧、高碳酸血癥和睡眠紊亂為特征[1]。OSAHS與包括不穩(wěn)定型心絞痛在內(nèi)的急性冠狀動脈事件密切相關,慢性間歇性缺氧引起交感神經(jīng)興奮性增高,心率加快,增加心肌收縮力,誘發(fā)冠狀動脈痙攣,引起易損斑塊破裂、血管不完全阻塞,導致不穩(wěn)定型心絞痛發(fā)作[2]。目前,對OSAHS的治療包括手術治療和非手術治療,手術治療雖然臨床療效確切,但存在手術風險大、費用高、病人依從性差的問題。中藥具有標本兼治、價格實惠、安全性較好的治療優(yōu)勢,因此研究中藥對OSAHS的治療作用有較大的臨床價值。中醫(yī)對OSAHS的認識如巢元方在《諸病源候論》中所指:“鼾眠者,眠里咽喉間有聲也。人喉嚨上下也,氣血若調(diào),雖寤寐不妨宣暢,氣有不和,則沖擊咽喉,澀而不利亦作聲”,認為本病與氣血瘀滯密切相關,通脈逐瘀顆粒為臨床上的理氣活血代表方。本研究旨在探索通脈逐瘀顆粒在血瘀證不穩(wěn)定型心絞痛合并OSAHS病人炎癥反應中的作用。
1 資料與方法
1.1 一般資料
選取2020年5月—2021年10月就診于我院心臟中心門診及住院治療的血瘀證不穩(wěn)定型心絞痛合并OSAHS病人90例。采用隨機數(shù)字表法分為對照組、持續(xù)氣道正壓通氣(CPAP)組、中藥+CPAP組,每組30例。對照組,男18例,女12例;平均年齡57.6歲;合并高血壓11例,高脂血癥10例,超重/肥胖6例,腦血管病2例,吸煙8例;中度OSAHS病人14例,重度OSAHS病人16例。CPAP組,男19例,女11例;平均年齡58.2歲;合并高血壓12例,高脂血癥9例,超重/肥胖5例,腦血管病1例,吸煙11例;中度OSAHS病人14例,重度OSAHS病人16例。中藥+CPAP組,男19例,女11例;平均年齡57.4歲;合并高血壓9例,高脂血癥8例,超重/肥胖6例,腦血管病2例,吸煙10例;中度OSAHS病人16例,重度OSAHS病人14例。3組一般資料比較,差異均無統(tǒng)計學意義(P>0.05)。本研究經(jīng)醫(yī)院臨床醫(yī)學倫理委員會審查通過,倫理批號:2020HC12LS007。
1.2 診斷標準
不穩(wěn)定型心絞痛診斷參照《急性冠脈綜合征急診快速診治指南(2019)》[3]:肌鈣蛋白(cTn)陰性,缺血性胸痛,心電圖表現(xiàn)為一過性ST段壓低或T波低平、倒置,少見ST段抬高(血管痙攣性心絞痛)。OSAHS診斷標準參照《成人阻塞性睡眠呼吸暫停多學科診療指南》[4]:1)出現(xiàn)以下癥狀:病人主訴日間嗜睡、精神倦怠,夜寐多夢易醒或失眠;睡眠期間自覺憋氣或喘息而被迫醒來;他人描述病人在睡眠期間打鼾和(或)呼吸中斷。2)多導睡眠圖監(jiān)測(PSG)證實監(jiān)測期間發(fā)生呼吸事件頻率在5~30次/h。滿足上述1)+2)。根據(jù)睡眠呼吸暫停低通氣指數(shù)(AHI),結合夜間最低血氧飽和度(LSaO2)分為輕、中、重度,其中,輕度為AHI 5~<15次/h,LSaO285%~90%;中度為AHI 15~30次/h,LSaO280%~<85%,重度為AHI>30次/h,LSaO2<80%。冠心病血瘀證診斷標準參照《冠心病血瘀證診斷標準》[5]血瘀證診斷量表。
1.3 納入與排除標準
納入標準:年齡40~75歲;符合中西醫(yī)診斷標準,中醫(yī)辨證為血瘀證;多導睡眠監(jiān)測提示符合中度及以上睡眠呼吸暫停;治療前2周內(nèi)未合并使用其他影響試驗結果的藥物;能夠積極配合研究并簽署知情同意書者。排除標準:急性心肌梗死、惡性心律失常、心臟瓣膜病、嚴重心力衰竭、主動脈夾層、肺栓塞者;神經(jīng)肌肉病變、內(nèi)分泌疾病(垂體瘤、甲狀腺功能減退)、慢性阻塞性肺疾病(COPD)引起的睡眠障礙者;合并肝、腎、造血系統(tǒng)等嚴重原發(fā)性疾病、精神病者;妊娠及哺乳期婦女;過敏體質(zhì)者;近期服用或正在服用對本研究有影響的藥物;多導睡眠監(jiān)測有效睡眠時間<5 h者。
1.4 治療方法
對照組給予常規(guī)西藥包括抗血小板聚集、抗凝、調(diào)脂藥、硝酸酯類和鈣拮抗劑、β受體阻滯劑、血管緊張素轉換酶抑制劑(ACEI)/血管緊張素Ⅱ受體拮抗劑(ARB)類等治療。CPAP組在對照組基礎上加CPAP治療,采用NLF-200A型持續(xù)氣道正壓通氣呼吸機(北京普朗新技術有限公司)進行治療,使用方法:設置為機械通氣模式,調(diào)節(jié)濕化器穩(wěn)定為35~37 ℃,并根據(jù)病人自主吸氣力量調(diào)整觸發(fā)靈敏度,調(diào)節(jié)呼氣末正壓(PEEP)≥60 mmHg,進行機械通氣治療。中藥+CPAP組在CPAP組治療基礎上聯(lián)合通脈逐瘀顆粒治療,組方:桃仁12 g,紅花12 g,當歸9 g,生地9 g,牛膝9 g,赤芍6 g,川芎6 g,首烏9 g,澤瀉9 g,枳實6 g,生山楂6 g。以上中藥均為免煎顆粒,一次性購入同批次北京康仁堂藥業(yè)有限公司,室溫保存,開水沖服,每日1付,早晚分溫服。3組療程均為4周。
1.5 觀察指標
1.5.1 中醫(yī)證候積分
參照《中藥新藥臨床研究指導原則》[6],主癥:胸痛、胸悶,依據(jù)癥狀嚴重程度無、輕度、中度、重度分別計0、2、4、6分;次癥:心悸、氣短乏力、不寐,依據(jù)癥狀嚴重程度無、輕度、中度、重度分別計0、1、2、3分,總分21分,積分越高癥狀越嚴重。
1.5.2 西雅圖心絞痛量表評分
賦分包括軀體活動受限程度(PL)、心絞痛穩(wěn)定狀態(tài)(AS)、心絞痛發(fā)作情況(AF)、治療滿意程度(TS)、疾病認知程度(DP)五大項。對五大項19個條目逐項評分并計算總分,將得分按公式轉換成標準積分,標準積分=(實際得分-該方面最低得分)/(該方面最高分-該方面最低分)×100,評分越高病人生活質(zhì)量及機體功能狀態(tài)越好。
1.5.3 OSAHS治療效果
多導睡眠儀(萬脈醫(yī)療,型號SF-A18)監(jiān)測AHI、LSaO2、平均夜間血氧飽和度(SaO2)。
1.5.4 血清缺氧誘導因子1α(HIF-1α)、單核細胞趨化蛋白-1(MCP-1)、白細胞介素-1β(IL-1β)測定
HIF-1α試劑盒購自北京百奧萊博科技有限公司(貨號GH0006),MCP-1試劑盒購自上海科艾博生物技術有限公司(貨號CB16058-Hu),IL-1β試劑盒購自武漢賽培生物科技有限公司(貨號SP10180)。檢測方法:采集病人晨起空腹靜脈血5 mL,室溫血液自然凝固10 min,3 000 r/min離心20 min,收集上清,保存于-70 ℃冰箱待測,根據(jù)試劑盒說明書采取酶聯(lián)免疫吸附法進行測定。
1.6 統(tǒng)計學處理
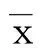
2 結 果
2.1 3組中醫(yī)證候積分比較
治療前,3組中醫(yī)證候積比較,差異無統(tǒng)計學意義(P>0.05)。治療后,CPAP組、中藥+CPAP組中醫(yī)證候積分較治療前降低(P<0.05),且CPAP組、中藥+CPAP組中醫(yī)證候積分低于對照組(P<0.05),中藥+CPAP組中醫(yī)證候積分低于CPAP組(P<0.05)。詳見表1。
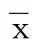
表1 3組中醫(yī)證候積分比較(±s) 單位:分
2.2 3組治療后西雅圖心絞痛量表評分比較
治療后,與對照組比較,中藥+CPAP組、CPAP組PL、AS、DP方面評分較高,差異均有統(tǒng)計學意義(P<0.05);與CPAP組比較,中藥+CPAP組PL、AS、TS方面評分較高,差異均有統(tǒng)計學意義(P<0.05)。詳見表2。
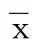
表2 3組治療后西雅圖心絞痛量表評分比較(±s) 單位:分
2.3 CPAP組、中藥+CPAP組OSAHS治療效果比較
治療前,CPAP組、中藥+CPAP組AHI、LSaO2、平均夜間SaO2比較,差異均無統(tǒng)計學意義(P>0.05);治療后,CPAP組、中藥+CPAP組AHI、LSaO2、平均夜間SaO2較治療前明顯改善,且中藥+CPAP組AHI、LSaO2、平均夜間SaO2較CPAP組改善更明顯(P<0.05)。詳見表3。
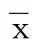
表3 CPAP組、中藥+CPAP組AHI、LSaO2、平均夜間SaO2比較(±s)
2.4 3組血清HIF-1α、MCP-1、IL-1β水平比較
3組治療前HIF-1α、MCP-1、IL-1β水平比較,差異均無統(tǒng)計學意義(P>0.05)。治療后,CPAP組、中藥+CPAP組HIF-1α、MCP-1、IL-1β水平低于治療前(P<0.05)。治療后,CPAP組、中藥+CPAP組HIF-1α、MCP-1、IL-1β水平低于對照組(P<0.05);中藥+CPAP組HIF-1α、MCP-1、IL-1β水平低于CPAP組(P<0.05)。詳見表4。
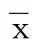
表4 3組HIF-1α、MCP-1、IL-1β水平比較(±s) 單位:pg/mL
3 討 論
隨著生活方式的改變、肥胖人群增加,OSAHS患病率呈增高趨勢,人群中OSAHS患病率為10%~20%,男性多于女性,且OSAHS與多種心血管疾病密切相關,研究較多的是OSAHS與冠心病[7]。不穩(wěn)定型心絞痛建立在動脈粥樣硬化易損斑塊基礎上,OSAHS病人反復發(fā)生的缺氧事件,易引起機體神經(jīng)-內(nèi)分泌系統(tǒng)激活,導致血管內(nèi)皮損傷,促進氧化應激和炎癥反應,誘發(fā)不穩(wěn)定粥樣硬化斑塊破裂[8]。
CPAP能夠明顯改善OSAHS合并冠心病病人的低氧血癥,改善病人臨床癥狀及心肌缺血發(fā)生率[9]。本研究結果表明,不穩(wěn)定型心絞痛合并OSAHS病人CPAP治療后,心絞痛癥狀明顯減輕,發(fā)作次數(shù)明顯減少,病人身心狀態(tài)得到顯著改善,治療依從性提高,CPAP能夠明顯改善病人夜間低氧狀態(tài),減輕間歇性低氧引起的自主神經(jīng)功能紊亂、心臟缺血事件的發(fā)生、炎性因子激活、血液黏滯等,延緩冠狀動脈粥樣硬化的病理進程。
中醫(yī)根據(jù)動脈粥樣硬化的臨床表現(xiàn),將其歸屬于“血瘀”范疇,正如《素問·痹論》云:“脈者,血之府也,澀則心痛”。另中醫(yī)對鼾聲呼吸的初步認識見于張仲景《傷寒論·辨太陽病脈證并治第一》所云:“脈陰陽俱浮,自汗出,身重,多眠睡,鼻息必鼾,語言難出”。中醫(yī)認為OSAHS為本虛標實、虛實夾雜之候,虛是先天稟賦不足,或臟腑虛弱,實是血瘀、氣滯、痰濕為患,主要病機為氣滯血瘀、痰濕內(nèi)阻、臟腑失調(diào),與肺、脾、腎、心等臟密切相關,尤以脾失健運、肺氣不利為關鍵。患病早期以瘀血、痰濁為主,隨著病程延長、年齡增大,相繼出現(xiàn)氣滯、濕阻、氣虛等兼證。針對這一病機,臨床上治療不穩(wěn)定型心絞痛合并OSAHS多從逐瘀化痰入手,方擬通脈逐瘀顆粒,桃仁、紅花、赤芍、牛膝、山楂活血化瘀,為君;當歸、生地、首烏養(yǎng)血、活血,為臣;枳實行氣消積、川芎行氣活血,澤瀉利濕,以為佐使,全方共奏活血化瘀、養(yǎng)血行氣之功效,使血行、瘀化,心脈得通。前期研究已證實,通脈逐瘀顆粒可減少黏附因子的表達以抑制免疫炎癥,下調(diào)促炎因子高遷移率族蛋白B1(HMGB1)、上調(diào)抗炎因子,叉頭框蛋白p3(Foxp3)表達,從而發(fā)揮抗動脈粥樣硬化的作用[10-11]。本研究結果顯示,通脈逐瘀顆粒從理氣化痰、通脈逐瘀著手,能夠降低冠心病血瘀證病人的中醫(yī)證候積分,與CPAP聯(lián)合能夠更加顯著的降低不穩(wěn)定型心絞痛合并OSAHS病人軀體活動受限程度,提高心絞痛穩(wěn)定狀態(tài)、治療滿意度,進一步降低AHI,提高LSaO2和平均夜間SaO2,更加顯著的降低病人缺氧嚴重程度,降低HIF-1α表達,抑制炎性因子表達,降低MCP-1、IL-1β水平,通脈逐瘀顆粒聯(lián)合CPAP在提高臨床療效、改善病人預后方面作用顯著。
HIF-1α是一類無氧轉錄調(diào)節(jié)因子,當人體組織處于缺氧條件時,血清中HIF-1α表達顯著升高,是缺氧狀態(tài)時人體維持內(nèi)環(huán)境穩(wěn)態(tài)的重要物質(zhì),該因子可加重缺血缺氧狀態(tài)時的組織損傷[12]。研究表明,當心肌細胞缺血缺氧時,HIF-1α表達水平增高,且增高幅度與心肌缺血缺氧嚴重程度密切相關[13]。與穩(wěn)定型心絞痛病人相比,不穩(wěn)定型心絞痛病人血清HIF-1α水平更高,其水平與心肌缺血嚴重程度呈正相關[14]。MCP-1是人類由基因編碼的一種蛋白質(zhì),屬于趨化因子家族,對單核/巨噬細胞有特異性趨化激活作用,對炎癥有啟動和擴大的作用[15]。研究發(fā)現(xiàn),OSAHS病人血清MCP-1含量高于對照組,且血清MCP-1含量與LSaO2呈負相關,與AHI呈正相關性,MCP-1可能通過調(diào)節(jié)機體免疫反應和炎癥反應發(fā)揮作用,且與心血管疾病的發(fā)病風險具有相關性[16]。白細胞介素IL-1家族主要表現(xiàn)為與炎癥的先天免疫有關,其中IL-1β是一種關鍵的促炎細胞因子,參與多種自身免疫性炎癥反應和多種細胞活動,包括細胞增殖、分化和凋亡,IL-1β通過多種下游機制協(xié)調(diào)免疫反應[17]。重度OSAHS病人血清IL-1β水平升高,與AHI呈正相關,經(jīng)過治療AHI與IL-1β均明顯下降[18]。冠心病病人介入治療后血清IL-1β水平明顯下降,證實炎性因子IL-1β在冠心病發(fā)生、發(fā)展及預后中發(fā)揮重要作用,在評估經(jīng)皮冠狀動脈介入(PCI)治療效果中有一定的臨床意義[19]。本研究結果顯示,中藥聯(lián)合CPAP治療后,血清HIF-1α、MCP-1、IL-1β水平均明顯下降,下降程度較CPAP組更明顯,表明通脈逐瘀顆粒能減輕不穩(wěn)定型心絞痛合并OSAHS病人炎癥反應,起到延緩、抑制冠心病進展的作用。
綜上所述,通脈逐瘀顆粒可改善不穩(wěn)定型心絞痛合并OSAHS病人臨床癥狀,減輕低通氣狀態(tài),抑制炎癥反應,為中藥防治動脈粥樣硬化提供方法。未來可從動物實驗方面進一步探索其機制,探究具體作用靶點,明確通脈逐瘀顆粒的作用機制。

