非生物脅迫誘導的棉花酵母雙雜交文庫構建及GhJAZ1互作蛋白篩選
蔡 肖 李興河 王海濤 劉存敬 唐麗媛 張素君 張建宏
(河北省農林科學院棉花研究所/農業(yè)農村部黃淮海半干旱區(qū)生物學與遺傳育種重點實驗室/國家棉花改良中心河北分中心,河北 石家莊 050051)
JAZ(Jasmonate ZIM-domain)蛋白作為E3泛素連接蛋白降解復合體SCFCOI1的靶蛋白,是茉莉素(jasmonic acid,JA)信號轉導途徑中重要的轉錄抑制因子之一[1-2]。JAZ蛋白不僅廣泛參與植物生長發(fā)育、次生代謝物合成等生物學進程[3-4],而且在抵御生物及非生物脅迫逆境中扮演著重要角色[5]。不同JAZ基因調節(jié)逆境響應的方式不同:水稻(Oryzasativa)OsJAZ9過表達能顯著提高水稻對鹽和干旱的耐受性[6],OsJAZ1的超量表達則使水稻的抗旱能力降低[7];OsJAZ11能夠參與調控水稻對低磷脅迫的響應[8];ZmJAZ14可增強擬南芥干旱耐受性[9];ZmJAZ15參與玉米(Zeamays)對赤霉素莖腐病的免疫調節(jié)[10];大豆(Glycinesoja)GsTIFY10和GsJAZ2在擬南芥中過量表達可提高轉基因擬南芥耐鹽堿的能力[11-12],而GsTIFY11b的過量表達會增加擬南芥對鹽堿脅迫的敏感性[13]。
棉花(Gossypium)是重要的經濟作物之一。近年來,極端天氣等自然災害頻發(fā),造成棉花生長環(huán)境和條件惡化,嚴重影響著棉花的產量和品質。棉花JAZ基因的鑒定分析和功能研究相繼被報道,為研究其在棉花生長及逆境響應中的作用機制提供了理論依據[14-16]。Hu 等[17]發(fā)現GhJAZ2通過與R2R3-MYB 轉錄因子GhMYB25-like互作來負調控纖維發(fā)育。GhJAZ2還通過與GhbHLH171互作,增強植株對大麗輪枝孢菌和取食性昆蟲的敏感性[18]。Xia等[19]發(fā)現GhJAZ3參與了擬南芥表皮毛的分化和伸長。GhJAZ10轉基因擬南芥氣孔數量顯著減少,對干旱脅迫的耐受性提高[20]。過表達GaJAZ1基因的陸地棉植株耐鹽性顯著提高[21]。然而,有關棉花JAZ基因在非生物脅迫中的作用機制研究還少有報道。前期研究表明,陸地棉GhJAZ1基因是一個低溫相關的抑制因子[22],受脫落酸和茉莉酸甲酯和低溫脅迫誘導表達,在不同低溫耐性棉花材料中表達量變化程度不同,但GhJAZ1在低溫調控中的分子作用機理尚不清楚。
酵母雙雜交技術是一種研究蛋白之間相互作用的有力工具[23]。通過構建酵母雙雜交cDNA 文庫,利用酵母雙雜交技術篩選鑒定與目的蛋白(誘餌)相互作用的蛋白質,對于深入研究目的蛋白的作用機理、理解蛋白參與的信號傳導途徑和調控網絡具有重要的理論指導意義。目前,利用酵母雙雜交cDNA 文庫篩選鑒定蛋白質相互作用關系已經在小麥[24]、棉花[25]、苦瓜[26]等多種農作物得到了廣泛應用。
鑒于此,本研究以陸地棉標準系TM-1 為材料,構建棉花非生物脅迫誘導的酵母雙雜交文庫,以期為棉花非生物脅迫響應信號途徑和蛋白互作機制的研究奠定基礎,并通過對GhJAZ1 互作蛋白進行篩選,為進一步解析GhJAZ1在低溫應答中的調控網絡和分子作用機理提供參考依據。
1 材料與方法
1.1 試驗材料和處理方法
將陸地棉標準系TM-1種子浸泡24 h,待種子露白后播種于濕潤的沙子中,子葉展開后轉移到Hoagland營養(yǎng)液中進行水培。培養(yǎng)條件為白天28 ℃ 16 h/夜晚26 ℃ 8 h,濕度70%。待植株第3 片真葉完全展開時,進行脅迫處理[27]。低溫處理:將生長一致的棉苗移到4 ℃的培養(yǎng)室中處理6 h;聚乙二醇(polyethylene glycol,PEG)模擬干旱處理:17% PEG6000 處理棉苗6 h;NaCl處理:200 mmol·L-1NaCl處理棉苗6 h。脅迫處理后迅速剪取棉苗的幼嫩葉片和根,液氮速凍,-80 ℃保存。
1.2 非生物脅迫誘導的棉花酵母雙雜交cDNA 文庫構建
將低溫、PEG、NaCl脅迫處理6 h的根和葉片進行取樣,采用十六烷基三甲基溴化銨(cetyltrimethylammonium bromide,CTAB)法進行植物總RNA 的提取,瓊脂糖凝膠電泳對總RNA的質量進行檢測。將提取的各處理樣品的總RNA等量混合,得到非生物脅迫處理的總RNA。參考Oligotex mRNA Midi Kit(70042,QIAGEN,德國)說明書進行mRNA分離純化,瓊脂糖凝膠電泳鑒定分離結果。
cDNA 文庫的構建采用Gateway 位點特異性重組技術完成,具體方法參照CloneMiner? II cDNA 文庫制備試劑盒(A11180,Invitrogen,上海)說明書,初級文庫載體為pDONR222 vector,次級文庫載體為pGADT7-DEST。重組質粒電轉大腸桿菌DH10B,取轉化后細菌原液10 μL 稀釋1 000 倍后,從中取出50 μL 涂布含相應抗性(初級文庫菌液為卡那霉素抗性,次級文庫菌液為氨芐青霉素抗性)的LB平板。第二天計數進行庫容量鑒定,計算方法如下:
每毫升大腸桿菌文庫菌液庫容量(CFU·mL-1)=50 μL菌液涂布的平板上的克隆數/50 μL×100倍×1 000 μL
文庫總克隆數(CFU)=每毫升大腸桿菌文庫菌液庫容量(CFU·mL-1)×文庫菌液總體積(mL)。
隨機挑取克隆,分別以M13-F/R和pGADT7-DESTF/R 為引物對初級文庫和次級文庫進行菌落PCR 檢測,鑒定重組率和插入片段長度。
構建好的次級文庫菌液加入含氨芐青霉素的LB培養(yǎng)基過夜擴增培養(yǎng),利用PureLink? HQ 小提質粒DNA純化試劑盒(K210001,Invitrogen,上海)進行文庫質粒抽提,將質粒轉化酵母菌株Y187(CC306,Coolaber,北京),在SD/-Leu 平板上檢測轉化效率并篩選收集轉化子,獲得酵母AD文庫菌液,計算酵母文庫滴度:
文庫滴度(cells·mL-1)=平板生長的克隆數/涂板體積×稀釋倍數。
1.3 pGBKT7-GhJAZ1 誘餌載體構建、自激活檢測及毒性檢測
根據GhJAZ1基因編碼序列(coding sequence,CDS)和pGBKT7 載體設計引物pGBKT7-GhJAZ1-F 和pGBKT7-GhJAZ1-R,以pEASY-T3-GhJAZ1質粒為模板擴增并回收目的片段,利用EcoRⅠ(FD0275,Thermo,上海)和BamHⅠ(FD0054,Thermo,上海)雙酶切載體pGBKT7 并回收線性化載體,采用T4 DNA 連接酶(EL0011,Thermo,上海)將上述目的片段和線性化載體連接,重組產物轉化DH5α 大腸桿菌化學感受態(tài)細胞(C502,Vazyme,南京),提取大腸桿菌中pGBKT7-GhJAZ1bait 質粒,酶切后用1%瓊脂糖凝膠電泳檢測,經測序驗證后利用質粒抽提試劑盒(DP116,天根,北京)進行bait質粒抽提。
將誘餌載體質粒pGBKT7-GhJAZ1和pGADT7-T共轉化Y2H Gold 酵母菌株感受態(tài),涂布在SD/-Leu/-Trp/X-α-gal(DDO/X)、SD/-Trp/-Leu/-His/X-α-gal(TDO/X)和SD/-Trp/-Leu/-His/-Ade/X-α-gal/AbA(DDO/X/A)培養(yǎng)基上,30 ℃倒置培養(yǎng),觀察生長情況,以確定誘餌蛋白的自激活活性及對酵母細胞的毒性。以pGBKT7-Lam + pGADT7-T為陰性對照,pGBKT7-53 + pGADT7-T為陽性對照。
1.4 酵母雙雜交文庫篩選及回轉驗證
將誘餌質粒pGBKT7-GhJAZ1 轉化酵母感受態(tài)Y2HGold,取4~5 mL含誘餌質粒pGBKT7-GhJAZ1的新鮮酵母菌液,與1 mL酵母AD次級文庫菌液混合加入到滅菌錐形瓶中,加入45 mL 含50 μg·mL-1kanamycin 的2×酵母膏胨葡萄糖瓊脂培養(yǎng)基(yeast extract peptone dextrose medium with agar,YPDA)(PM2011,Coolaber,北京)液體培養(yǎng)基中,30 ℃、50 r·min-1條件下低速培養(yǎng)24 h,顯微鏡下觀察酵母雜交液中出現三葉草狀結合子,停止培養(yǎng)。1 000 ×g離心10 min 收集菌體重懸于含50 μg·mL-1kanamycin 的0.9% NaCl 液體培養(yǎng)基中,將菌液涂布SD/-Trp/-Leu/-His/X-α-Gal/AbA(TDO/X/A)初篩平板,30 ℃恒溫培養(yǎng)3~5 d,將初篩平板上的藍色克隆轉移到高強度篩選QDO/X/A 培養(yǎng)基上,進一步觀察酵母克隆生長情況。
參照酵母質粒提取試劑盒(DP112,天根,北京)對QDO/X/A 上生長的藍色陽性克隆抽提酵母質粒,轉化大腸桿菌DH5α,挑取含氨芐青霉素的溶菌肉湯(lysogeny broth,LB)平板上生長的單菌落進行質粒擴增,抽提的質粒用于測序和一對一回轉驗證。測序得到確定陽性克隆的序列信息,即為GhJAZ1 的候選互作蛋白。將構建好的pGBKT7-GhJAZ1bait 質粒分別與抽提的陽性克隆質粒共轉化Y2H Gold酵母菌株,在QDO/X/A 平板上培養(yǎng)篩選再次生長藍色克隆的質粒。
1.5 酵母雙雜交一對一互作驗證
克隆候選互作蛋白對應基因的CDS,參考1.3中的載體構建方法,構建pGADT7-GhJAZ12_A、pGADT7-GhJAZ12_D、pGADT7-GhPP2-A13和pGADT7-GhKINB1重組質粒。分別將重組質粒與pGBKT7-GhJAZ1質粒共轉酵母菌株Y2HGold,涂布DDO固體培養(yǎng)基,待菌斑生長至2~3 mm,挑取菌斑于100 μL 0.9% NaCl溶液中震散混勻并按梯度稀釋后,點板到QDO/X/A 固體培養(yǎng)基。30 ℃條件下倒置培養(yǎng)3~5 d,直至菌落長出。以質粒pGBKT7-53×pGADT7-T 和pGBKT7-Lam×pGADT7-T作為陽性對照和陰性對照。引物列表見表1。
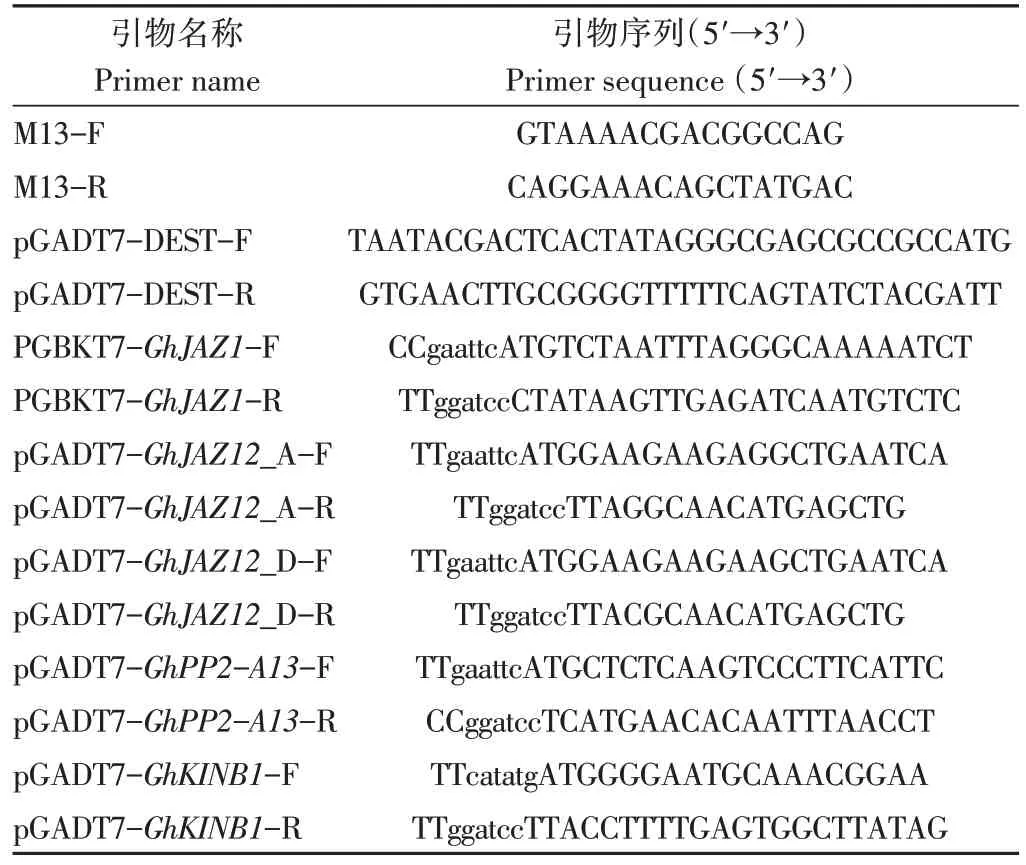
表1 本研究所用引物列表Table 1 Primers used in this study
2 結果與分析
2.1 非生物誘導的棉花酵母雙雜交文庫的構建
將提取的低溫、PEG、NaCl 脅迫處理6 h 的棉花根和葉片總RNA 等量混合,瓊脂糖電泳檢測結果顯示總RNA 質量良好(圖1-A),可用于酵母雙雜交文庫的構建。對總RNA 進一步分離純化mRNA,結果顯示mRNA帶型分布正確(圖1-B)。反轉錄合成雙鏈cDNA(double strand cDNA,ds cDNA),電泳結果表明,mRNA有效反轉錄且得到的cDNA分布正常(圖1-C),可以用于后續(xù)試驗。將dscDNA 與三框attB1 重組接頭連接,BP重組反應后轉化大腸桿菌,經鑒定,初級文庫總克隆數為1.2×107CFU,重組率100%,平均插入片段長度>1 000 bp(圖1-D、F)。將初級文庫質粒與線性化質粒pGADT7-DEST進行LR重組反應,轉化大腸桿菌后,獲得的次級文庫總克隆數為1.6×107CFU,重組率100%,平均插入片段長度>1 000 bp(圖1-E、G)。以上結果表明,構建的初級文庫和次級文庫庫容量均大于107CFU。轉化酵母菌株Y187 后,獲得的酵母文庫滴度為5.0×107cells·mL-1,酵母克隆PCR鑒定結果顯示平均插入片段長度>1 000 bp(圖1-H)。以上結果表明,所構建的酵母文庫符合雙雜交篩選的要求,可以用于后續(xù)試驗篩選。
2.2 pGBKT7-GhJAZ1自激活活性檢測與毒性檢測
根據GhJAZ1基因CDS序列設計引物,通過酶切連接將目標序列連接到載體pGBKT7,構建誘餌載體pGBKT7-GhJAZ1。將誘餌載體質粒pGBKT7-GhJAZ1和pGADT7-T共轉化Y2HGold酵母菌株,從圖2可以看出,陽性對照pGBKT7-53+pGADT7-T在SD/-Leu/-Trp/X-α-gal(DDO/X)上生長且變藍,陰性對照pGBKT7-Lam+pGADT7-T在DDO/X上正常生長但不變藍,pGBKT7-GhJAZ1+pGADT7在DDO/X上正常生長且變藍,表明3組質粒均轉化正常,且pGBKT7-GhJAZ1對酵母生長無毒性。pGBKT7-GhJAZ1能夠在DDO/X上生長且變藍,但在SD/-Leu/-Trp/-His/X-α-gal(TDO/X)和SD/-Leu/-Trp/-His/-Ade/X-α-gal/AbA(QDO/X/A)上均不能生長,表明GhJAZ1 在Y2H Gold 酵母菌株中無自激活活性,可以用于進行后續(xù)酵母文庫篩選試驗。
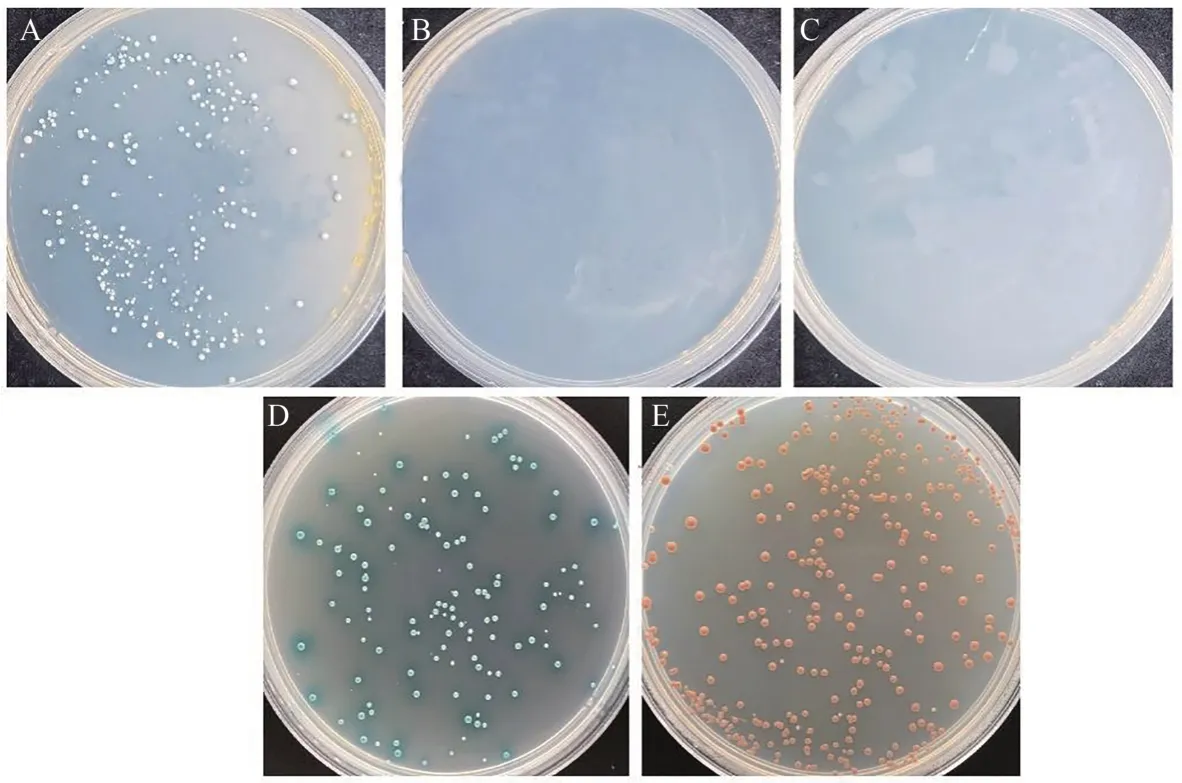
圖2 GhJAZ1誘餌蛋白毒性和自激活活性檢測Fig.2 Assessment of toxicity and self-activation activity of GhJAZ1 bait plasmid
2.3 酵母雙雜交文庫篩選GhJAZ1互作蛋白
以pGBKT7-GhJAZ1為誘餌,采用Mating法篩選構建的非生物脅迫誘導的棉花酵母雙雜交cDNA 文庫。在SD/-Leu/-Trp/-His/-Ade/X-α-gal/AbA(QDO/X/A)平板上篩選培養(yǎng),有72個克隆生長變藍(圖3)。對QDO/X/A 上生長的藍色陽性克隆抽提酵母質粒,轉化大腸桿菌進行陽性克隆prey 質粒擴增,測序確定陽性克隆的序列信息。除去比對到未知蛋白以及重復比對到同一個蛋白的陽性克隆后,將構建好的pGBKT7-GhJAZ1質粒分別與陽性克隆prey質粒共轉化Y2HGold酵母菌株,在QDO/X/A平板上篩選再次生長為藍色克隆的文庫質粒,共獲得11個回轉陽性的互作蛋白(表2)。對篩選到的靶蛋白進行分析發(fā)現,互作蛋白功能涉及碳水化合物代謝、脂肪酸生物合成、氧化還原反應、防御反應、蛋白質折疊以及蛋白質泛素化修飾等多種生物學過程。
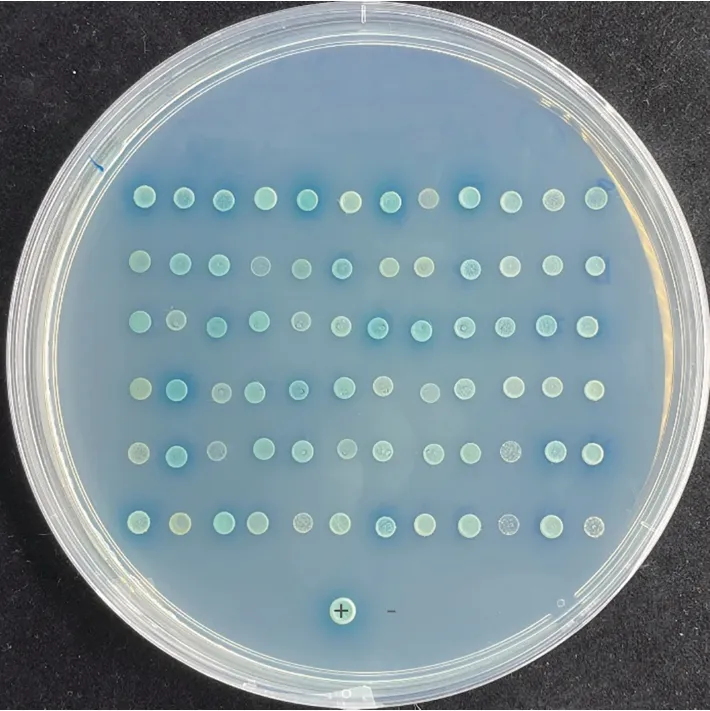
圖3 高嚴謹度平板篩選的陽性克隆(QDO/X/A)Fig.3 Clones on highly stringent screening plate(QDO/X/A)
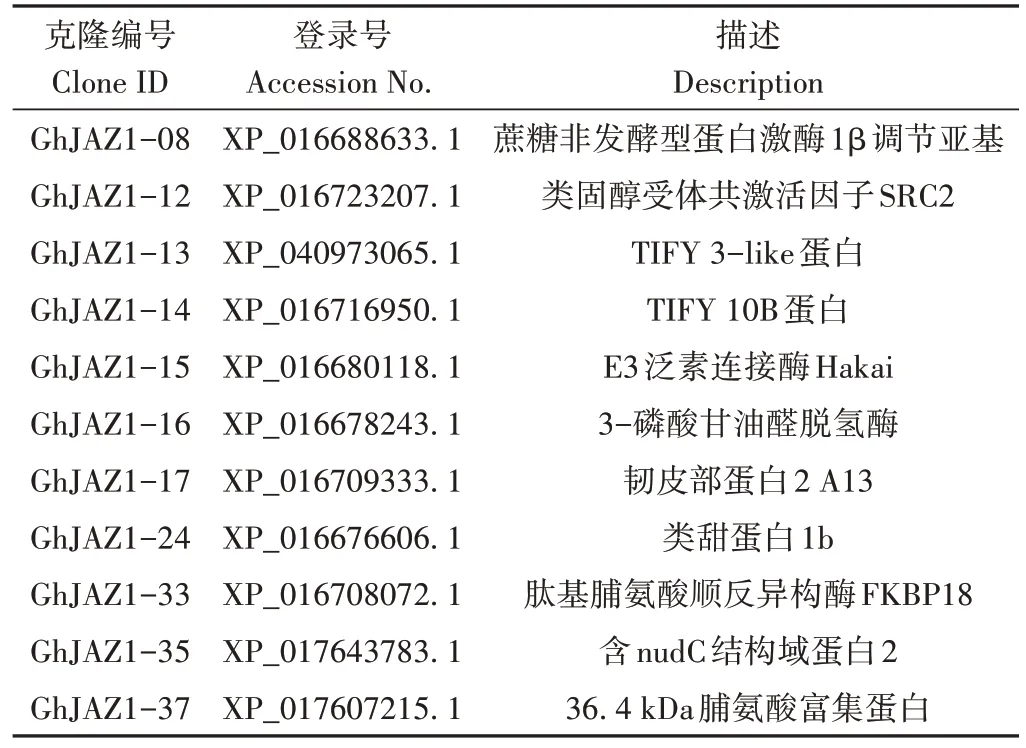
表2 酵母陽性克隆質粒測序結果Table 2 Plasmids sequencing results of positive clones in yeast
2.4 Y2H一對一驗證蛋白的相互作用關系
為了驗證陽性克隆的準確性,降低酵母雙雜交篩選的假陽性率,根據篩選陽性克隆的注釋結果、公共數據庫中基因非生物脅迫的表達模式,并結合已有文獻報道等信息,選取4 個候選互作蛋白克隆其對應基因的全長CDS,構建到pGADT7 載體,分別與pGBKT7-GhJAZ1質粒共轉酵母菌株Y2HGold,確認4 個候選互作蛋白與GhJAZ1 的互作關系。4 個蛋白中,包括2 個TIFY/JAZ 家族成員GhJAZ12_A(XP_040973065.1)和GhJAZ12_D(XP_016716950.1)、1 個F-box 蛋白GhPP2-A13(XP_016709333.1)以及1 個蛋白激酶調節(jié)亞基GhKINB1(XP_016688633.1)。點板驗證結果顯示,pGBKT7-GhJAZ1×pGADT7-GhJAZ12_A、pGBKT7-GhJAZ1×pGADT7-GhJAZ12_D、pGBKT7-GhJAZ1×pGADT7-GhPP2-A13、pGBKT7-GhJAZ1×pGADT7-GhKINB1以及陽性對照pGBKT7-53×pGADT7-T 和陰性對照pGBKT7-Lam×pGADT7-T 在二缺板(DDO)上均可以長出菌斑并正常生長(圖4),說明質粒轉化成功。除陰性對照外,所有共轉質粒均能在QDO/X/A 上生長且變藍(圖4),表明在酵母細胞內GhJAZ1 與4 個候選蛋白GhJAZ12_A、GhJAZ12_D、GhPP2-A13和GhKINB1均存在相互作用。

圖4 GhJAZ1與部分候選互作蛋白的酵母雙雜交驗證Fig.4 Verification of interaction relationships between GhJAZ1 and candidate proteins by yeast two-hybrid
3 討論
JAZ 蛋白在植物抵御非生物脅迫中發(fā)揮著重要作用。前人發(fā)現,GhJAZ1基因表達受低溫脅迫誘導且在不同低溫耐性棉花材料中存在表達量的差異,表明GhJAZ1 參與了棉花低溫響應[22],但GhJAZ1 參與低溫應答的分子機制及其可能發(fā)揮的其他生物學功能還不明確。酵母雙雜交是一種高效篩選互作蛋白、研究蛋白相互作用的分子生物學方法,是解析蛋白質的分子作用機制和調控網絡常用的一項技術手段。本研究利用Gateway 方法構建了棉花非生物脅迫誘導的酵母雙雜交cDNA文庫,為互作蛋白的篩選奠定了基礎。
提高文庫質量有利于減少酵母雙雜交結果的假陰性[23]。高質量的酵母雙雜交cDNA 文庫構建依賴于高質量cDNA 文庫的制備。本研究對獲得的cDNA 初級和次級文庫的滴度、重組率及插入片段大小的檢測結果表明,構建的cDNA 文庫具有較好的完整性,較廣泛的覆蓋度以及良好的cDNA 片段多態(tài)性等特點,滿足酵母文庫構建的要求。
本研究構建的pGBKT7-GhJAZ1誘餌載體在酵母系統(tǒng)中無毒性和自激活活性。通過篩選酵母雙雜交文庫獲得了11 個可能與GhJAZ1 相互作用的蛋白。由于酵母雙雜交文庫篩選結果存在假陽性的問題,有必要利用Y2H 技術對候選互作蛋白的互作關系進行一對一驗證[23]。本研究利用Y2H 技術證明了GhJAZ1 蛋白與GhJAZ12、GhPP2-A13 和GhKINB1 之間存在相互作用,后續(xù)仍需利用其他蛋白互作技術,如雙分子熒光互補(bimolecular fluorescence complementation,BiFC)、免疫共沉淀(co-Immunoprecipitation,Co-IP)、Pull down等技術對互作關系深入確認。
研究表明,JAZ 蛋白在棉花纖維發(fā)育、生物脅迫和非生物脅迫響應等生物學進程中發(fā)揮著重要作用,但在不同生理過程中與JAZ互作的蛋白質及其調控機制不盡相同。Li 等[16]分析GhJAZ 蛋白的互作模式發(fā)現,大多數GhJAZ 蛋白不僅可以與GhCOI1、GhMYC2/3 和GhNINJA 等蛋白相互作用參與JA 信號轉導,還可以有選擇性地通過與其他JAZ蛋白形成同源或異源二聚體的形式來發(fā)揮功能。GhJAZ2通過與R2R3-MYB 轉錄因子GhMYB25-like互作從而負調控棉花纖維發(fā)育[17],還可以通過與GhbHLH171互作增強植株對大麗輪枝孢菌和取食性昆蟲的敏感性[18]。GhJAZ11_D 可以與棉花GhHOX3、GhEIN3蛋白發(fā)生相互作用,進一步轉基因試驗結果表明GhJAZ11_D 可能是通過與EIN3 之間互作使JA 和乙烯(ethylene,ET)信號途徑協(xié)同,從而正向調控棉花纖維的伸長發(fā)育[28]。在花粉發(fā)育過程中,轉錄抑制因子GhWRKY22可以與多個GhJAZs基因的啟動子直接結合從而調控JAZs基因的表達,進一步酵母雙雜交發(fā)現,GhJAZ8-A、GhJAZ13-A通過與GhMYB24相互作用調控JA 信號轉導從而影響棉花花藥/花粉的發(fā)育[29]。本研究篩選的GhJAZ1 互作蛋白中也包括了2個JAZ 家族蛋白,分別是與擬南芥JAZ12同源的陸地棉A亞組蛋白GhJAZ12_A(XP_040973065.1)和D亞組蛋白GhJAZ12_D(XP_016716950.1),說明GhJAZ1 可以與GhJAZ12互作形成異源二聚體來發(fā)揮功能。本研究未篩選鑒定到與GhJAZ1相互作用的COI1、MYC2等JA 信號通路關鍵因子,GhJAZ1 是否可以通過與這些關鍵因子互作來參與JA 信號通路轉導仍需要后續(xù)的深入驗證。
F-box家族蛋白韌皮部蛋白2(phloem protein 2,PP2)被認為在植物多種逆境脅迫中發(fā)揮重要的調節(jié)作用。AtPP2-B11負調控擬南芥干旱脅迫響應,而在鹽脅迫響應中則發(fā)揮正調控作用[30-31]。AtPP2-B11 能與SCF復合體蛋白SKP1 互作,暗示了其具有F-box 蛋白的功能,可以作為SKP1/Cullin/F-box E3 連接酶復合體SCFAtPP2-B11的底物受體[32]。小麥PP2-A13基因響應逆境脅迫,并與SCF復合體接頭蛋白SKP1相互作用[24]。擬南芥PP2-A13基因受光周期誘導表達,僅在短的光周期下表達,對于植物對短光條件的適應至關重要[33]。本研究鑒定到一個與擬南芥PP2-A13同源的GhJAZ1互作蛋白GhPP2-A13(XP_016709333.1),推測其可能參與了棉花對非生物脅迫的響應,二者互作調控脅迫響應的分子機制有待深入研究。
GhKINB1編碼一個SnRK1(蔗糖非發(fā)酵-1-型相關蛋白激酶1,SNF1-related protein kinase 1)的β1 調節(jié)亞基。已有研究表明,JA 可能與SnRK 信號協(xié)同作用以響應應激條件。例如,JA 響應元件是大麥SnRK1基因啟動子區(qū)最常見的元件之一[34];超表達OsSnRK1a啟動了JA 介導的防御反應[35]。然而目前為止鮮有關于JAZ 蛋白與SnRK 及其復合體直接相互作用參與防御反應的報道,GhJAZ1 是否通過與GhKINB1 互作調控棉花逆境響應及其可能的互作調控方式仍需后續(xù)試驗進一步驗證。
4 結論
本研究開展了陸地棉低溫、PEG、NaCl處理的非生物脅迫酵母雙雜交cDNA 文庫構建,經鑒定,構建的文庫滴度為5.0×107cells·mL-1,平均插入片段長度>1 000 bp,可以用于蛋白互作篩選。以pGBKT7-GhJAZ1為誘餌,篩選上述酵母文庫,共獲得11個與GhJAZ1相互作用的候選蛋白,功能涉及碳水化合物代謝、脂肪酸生物合成、氧化還原反應、防御反應、蛋白質折疊以及泛素化修飾等多種生物學進程。利用酵母雙雜交點對點技術進一步確認了GhJAZ1 與GhJAZ12_A、GhJAZ12_D、GhPP2-A13 和GhKINB1的相互作用關系。進一步闡明了GhJAZ1與候選蛋白的互作機制將是今后的重點研究方向。

