基于MRI影像組學特征的機器學習模型預測胰腺癌CD8+T細胞浸潤及預后的研究
盧明智 劉芳 方旭 邊云 邵成偉 陸建平 李晶
1海軍軍醫大學第一附屬醫院放射治療科,上海 200433;2海軍軍醫大學第一附屬醫院放射診斷科,上海 200433
胰腺癌是一種對放化療敏感性差、手術切除率低的致死性惡性腫瘤[1-2],亟需新的系統治療手段出現。近年來,以免疫檢查點抑制劑為代表的免疫治療雖然在實體腫瘤中取得一定的進展[3-4],但在胰腺癌的應用中卻令人失望[5-6],這可能與胰腺癌復雜的免疫抑制性微環境有關。腫瘤浸潤性淋巴細胞(tumor infiltrating lymphocytes,TILs)是存在于腫瘤實質和間質內的異質性淋巴細胞群體,其不僅是體內免疫系統對腫瘤局部免疫應答的直接反應,也是腫瘤免疫微環境的主要組成部分[7]。其中CD8+T細胞的存在與對免疫檢查點抑制劑療法的強力應答相關。此外,有研究表明富含CD8+T細胞的患者對放化療的應答效果更好[8]。已有研究證實在多種實體瘤(包括胰腺癌)中CD8+T細胞是重要的預后因素[9]。因此CD8+T細胞數量對患者預后以及治療策略的制定均有一定的臨床價值。目前術前檢測CD8+T細胞數量的主要方法為采用穿刺活檢,其局限性是獲得的標本量極少,不能反映腫瘤的整體情況。而影像組學可從醫學圖像中提取高通量特征并分析腫瘤信息,能夠對病變圖像進行全面精準的評價,而且具有無創、經濟和快捷等優勢[10-13]。本研究旨在探討基于MRI圖像影像組學的機器學習模型評估胰腺癌CD8+T細胞浸潤的可行性,期望有助于篩選可以從免疫治療中獲益的胰腺癌患者。
資料與方法
一、一般資料
回顧性收集2017年1月至2018年4月間海軍軍醫大學第一附屬醫院156例經手術病理證實為胰腺癌患者的臨床、影像、病理及隨訪資料。納入標準:(1)患者接受手術切除,術后病理為胰腺導管腺癌;(2)術前7 d內行標準MRI增強檢查。排除標準:(1)術前接受過放療、化療或放化療的患者;(2)術后病理未進行免疫組織化學CD8染色;(3)存在MRI無法顯示的胰腺病變以及圖像質量不滿足分析要求。依據國際預測模型建模共識,按照時間順序將2017年1月至12月共116例患者納入訓練集,2018年1月至4月共40例納入驗證集。本研究獲得醫院倫理委員會批準(批號:CHEC-Y2020-011)。
二、MRI掃描方法
患者于MRI檢查前6 h禁食禁水。MRI設備為美國GE公司Signa HDxt 3.0 T、美國GE公司Discovery 750 3.0 T掃描儀和8通道體部線圈。掃描序列:(1)橫斷面呼吸觸發脂肪抑制快速自旋回波T2WI序列。重復時間(time of repetition, TR)6 316 ms,回波時間(time of echo,TE)85 ms,層數20,層厚5 mm,層間距1 mm,視野440 mm×440 mm,矩陣224×320。(2)肝臟快速容積成像(liver acquisition with volume acceleration,LAVA)T1WI序列。TR 2.58 ms,TE 1.18 ms,層厚5 mm,無層間距,視野440 mm×440 mm,矩陣224×320。增強掃描采用高壓注射器以2.0 ml/s的流率經前臂靜脈注入對比劑釓噴替酸葡甲胺(Gd-DTPA)0.2 ml/kg,注射結束后用20 ml生理鹽水以同樣流率沖洗。分別在注射對比劑后15、20、40 s行動脈期、門靜脈期、延遲期掃描。
三、圖像分析
由2名具有10年以上腹部影像診斷經驗的放射科醫師在臨床和病理學診斷不知曉的情況下采用盲法閱片,意見不同時,協商達成一致。觀察指標包括:腫瘤部位、腫瘤大小、腫瘤T1W及T2W圖像的信號強度(與周圍胰腺組織相比)、腫瘤和血管的關系、胰腺是否有炎癥、是否伴有主胰管截斷和擴張(直徑>3 mm)及膽管截斷和擴張(直徑>10 mm)、胰腺實質有無萎縮、胰腺輪廓有無異常、胰腺是否有囊腫等。
四、影像組學分析和預測模型構建
影像組學分析的過程包括MRI圖像分割、組學特征提取、組學特征降維。選取T1W、T2W以及3期動態增強原始橫斷面圖像進行分析。
采用3D Slicer 4.8.1軟件對胰腺腫瘤進行分割。為降低采集條件差異的影響,在提取特征前對圖像進行歸一化處理。為評價特征的穩定性,使用簡單隨機化法抽取50例患者的圖像,由2名放射科醫師分別對感興趣區(region of interest,ROI)進行勾畫、測量,計算觀察者間組內相關系數(intraclass correlation coefficient,ICC);由1名放射科醫師間隔1周再次勾畫腫瘤,計算觀察者內ICC。當觀察者間與觀察者內ICC均>0.75,認為一致性良好,所提取的影像組學特征可靠,數據可以用作后續分析。
組學特征提取采用Python 1.2.0軟件。提取的組學特征包括原始特征和濾波器特征,其中濾波器特征包括拉普拉斯高斯濾波、小波分析、平方值、平方根、對數和指數特征6類。每一類特征值所包括的具體特征有一階統計量、形狀特征、三類紋理特征,合計1 409個。先分別剔除組間差異無統計學意義和無顯著相關的組學特征,再通過最小絕對收縮和選擇算子(least absolute shrinkage and selection operator,Lasso)進一步對高維的組學特征進行降維和選擇,最后根據Lasso回歸方程公式計算每位患者的組學分值(radscore),建立極端梯度提升(eXtreme gradient boosting,XGBoost)預測模型,模型包含的變量為MRI特征和組學分值。
五、病理學圖像分析
使用免疫組織化學法評價腫瘤CD8+T細胞數量。將CD8染色切片通過掃描儀(NanoZoomer S60,Hamamatsu Healthcare,japan)轉換為數字病理圖像。由1名病理科醫師對切片內的腫瘤區域進行標注,注意避開正常胰腺、胰周脂肪及十二指腸,使用數字顯微鏡分析平臺(Visiopharm)對標注區進行細胞識別和計數,自動計算出CD8染色陽性的細胞密度。
根據病理學診斷報告,記錄:(1)根據第8版美國癌癥聯合委員會TNM分期手冊評估T和N分期;(2)分化程度;(3)十二指腸有無侵犯;(4)膽總管有無侵犯;(5)脈管內癌栓浸潤;(6)胰周神經侵犯。
六、隨訪
以手術當天為隨訪開始時間,截止時間為2020年8月1日。任何原因引起的死亡定義為事件發生,該時間段為總生存時間,隨訪過程中的失訪按截尾數據處理。
七、統計學處理
結 果
一、CD8+T細胞高、低組的臨床、病理和影像學特征比較
根據X-Tile確定的CD8+T細胞水平截點值為19.09%(圖1A、1B),將83例CD8>19.09%者歸入高CD8+T細胞組,73例CD8≤19.09%者歸入低CD8+T細胞組(圖1C),兩組CD8表達水平分別為(28.06±8.72)%和(14.48±2.93)%。隨訪至2020年8月1日,高CD8+T細胞組死亡人數43例,低CD8+T細胞組死亡人數31例,兩組中位總生存時間分別為25.51和22.92個月,差異有統計學意義(P=0.007,圖1D)。訓練集中T分期(P=0.027)和驗證集中MRI圖像測量的腫瘤大小(P=0.041)與CD8+T細胞浸潤程度有關,其余臨床、病理、影像學特征差異均無統計學意義(P值均>0.05,表1)。
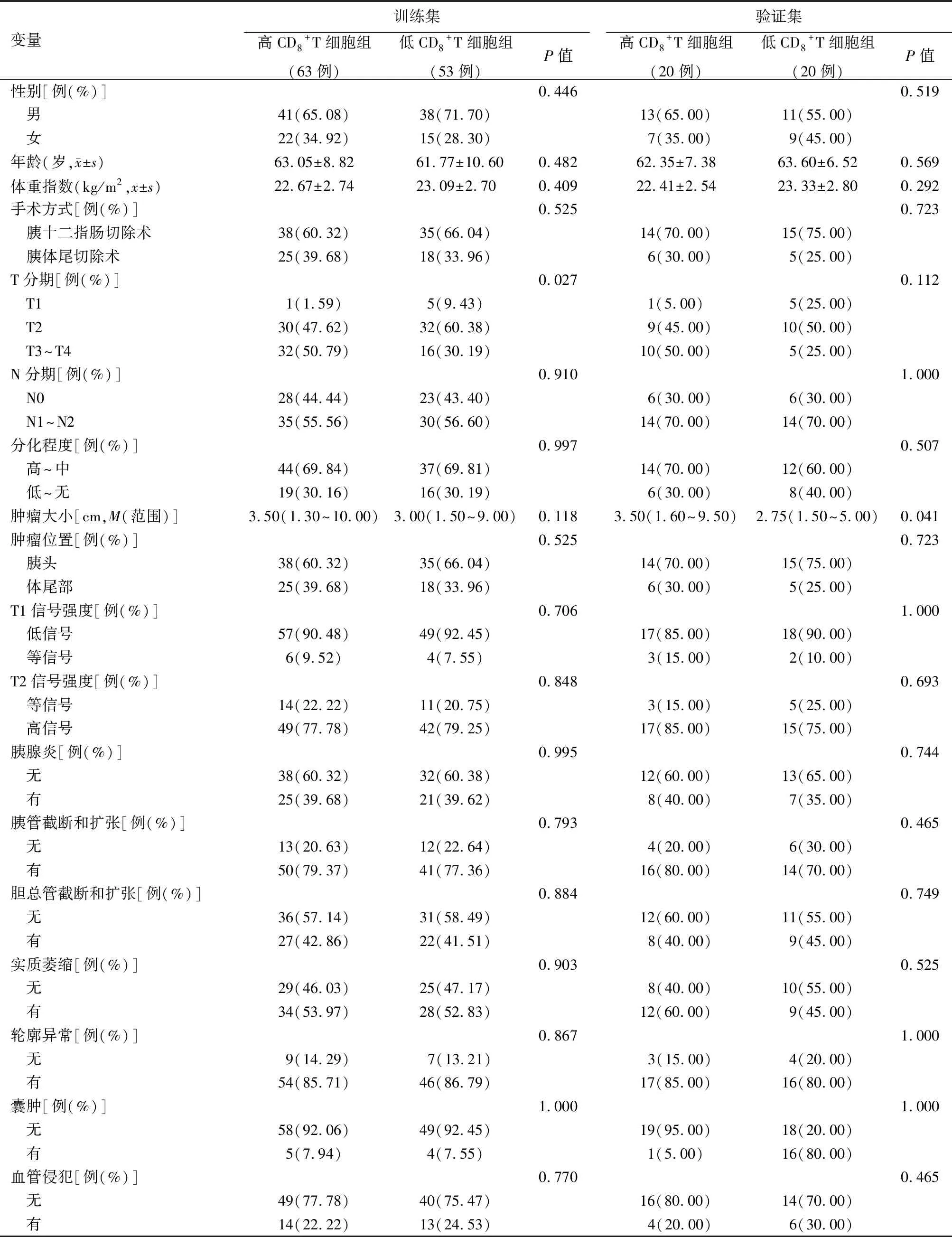
表1 胰腺癌患者的臨床、病理及影像學特征基線資料
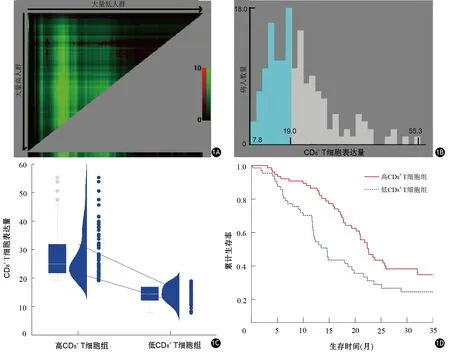
圖1 胰腺癌患者生存數據的X-Tile分析。1A、1B 由X-Tile確定的CD8+ T細胞的最佳截斷值為19.09%;1C 依據截斷值19.09%,將患者分為高CD8+ T細胞組和低CD8+ T細胞組;1D CD8+ T細胞高、低組患者的Kaplan-Meier曲線
二、影像組學分析結果
50例患者間ICC為0.81~0.90,患者個體內ICC為0.83~0.91,表明一致性均良好。
從T1WI、T2WI、動脈、門靜脈和延遲期圖像中總計提取的1 409個影像組學特征經過組間方差分析、Person相關分析后,獲得79個顯著相關的組學特征,經Lasso回歸降維至19個組學特征(圖2A、2B)。通過Lasso回歸公式獲得組學分值(表2)。高CD8+T細胞組的組學分值為-0.43(范圍:-1.55~0.65),低組的組學分值為0.22(范圍-0.68~2.54),兩組間差異有統計學意義(P<0.001,圖2C)。
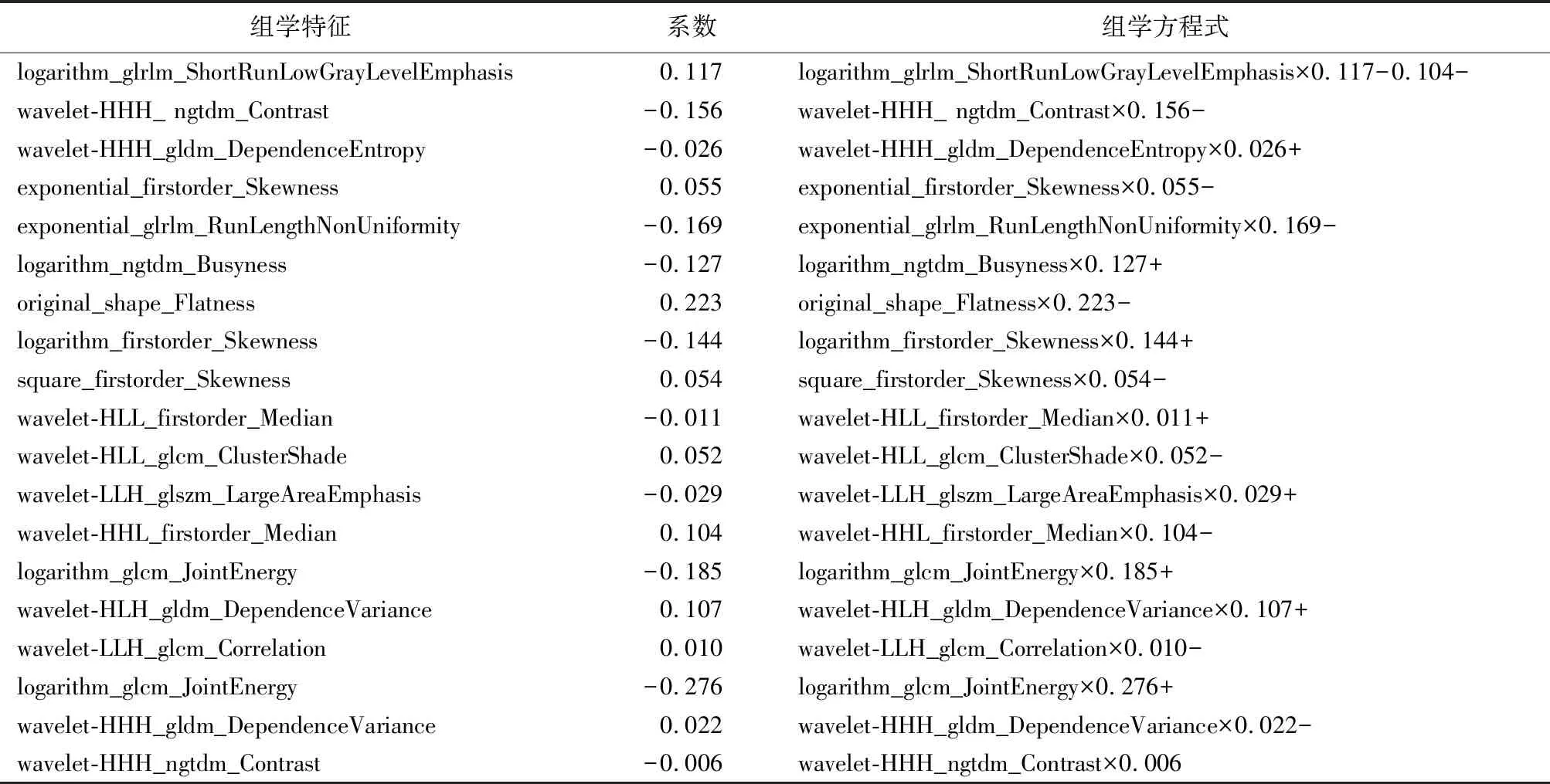
表2 Lasso回歸篩選的影像組學特征與組學方程式
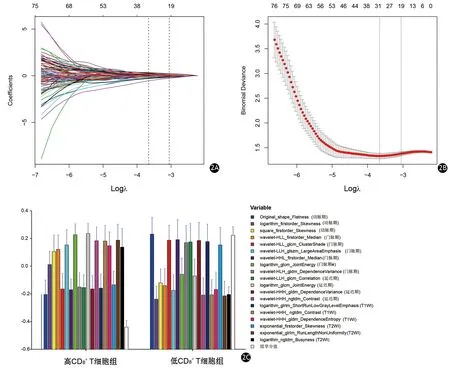
圖2 Lasso回歸特征降維。2A λ參數與變量的選擇路徑圖;2B λ參數和模型誤差;2C 經Lasso回歸降維后的19個組學特征誤差條形圖
三、機器學習模型的構建和性能驗證
將腫瘤大小和組學分值納入XGBoost模型。在訓練集中,XGBoost模型預測胰腺癌CD8+T細胞浸潤程度的AUC值、靈敏度、特異度、準確度、陽性預測值和陰性預測值分別為0.90(95%CI0.85~0.95)、75.47%、90.48%、0.84、0.87和0.81。在驗證集中,XGBoost模型預測胰腺癌CD8+T細胞浸潤程度的AUC值、靈敏度、特異度、準確度、陽性預測值和陰性預測值分別為0.79(95%CI0.63~0.96)、90.00%、80.00%、0.85、0.82和0.89(圖3A)。校準曲線顯示訓練集(P=0.767)和驗證集(P=0.101)模型擬合度均較好(圖3B)。圖4為臨床實際應用中的2個病例。利用預測模型可以準確區分胰腺癌CD8+T細胞高、低組患者。
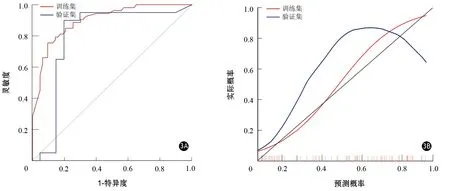
圖3 基于XGBoost分類器的訓練集和驗證集的ROC曲線(3A)和校準曲線(3B)
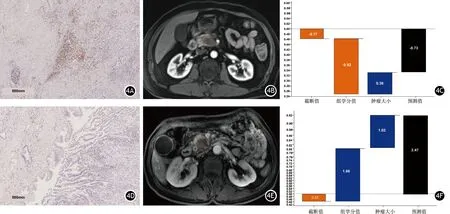
圖4 男性,60歲,胰腺癌,高CD8+T細胞組患者。CD8免疫組織化學染色圖像,紅色為CD8染色陽性細胞(4A,×20);胰腺癌MRI圖像感興趣區勾畫示意圖(4B);XGBoost分類器預測該患者為低CD8+T細胞組的概率為32.50%(4C)。男性,50歲,胰腺癌,低CD8+T細胞組患者。CD8免疫組織化學染色圖像,紅色為CD8染色陽性細胞(4D,×20);胰腺癌MRI圖像感興趣區勾畫示意圖(4E);XGBoost分類器預測該患者為低CD8+T細胞組的概率為92.20%(4F)
討 論
免疫治療給惡性腫瘤的治療帶來曙光。對胰腺癌患者免疫狀態的充分評估可以幫助臨床醫師篩選出免疫治療獲益患者,以延長生存,獲得更好預后。本研究以病理學結果為金標準,基于腫瘤大小和影像組學特征建立的機器學習模型為指導臨床治療提供了重要的預測信息。
在目前的臨床實踐中,胰腺癌患者預后評估主要依靠TNM分期系統,但TNM分期不能反映患者之間的異質性[14],因此,即使相同疾病分期的患者,其預后也存在較大差異。盡管一些用于胰腺癌預后評價的生物化學和遺傳生物標志物取得研究進展,但它們受限于高成本和操作復雜性等束縛,因此,在胰腺癌患者中開發一種新的個性化預測模型具有重要的臨床應用價值。越來越多的證據支持腫瘤微環境中的CD8+T細胞與胰腺癌的預后密切相關[15-21],而活化的細胞毒性T淋巴細胞可通過識別腫瘤特異性抗原發揮免疫殺傷作用[22-23]。因此,定量CD8+T細胞可用來預測患者的預后。本研究結果顯示,高CD8+T細胞組患者的總體生存期顯著長于低CD8+T細胞組,也證實了這一相關性。
CD8+T細胞的定量分析依賴于病理學,但病理醫師閱片主要根據其知識儲備和臨床經驗,存在一定的主觀性,不能精確地定量診斷,且術前活檢組織樣本量小并具有異質性;而常規術前影像圖像對腫瘤評價均是基于解剖學和生物學評價,很難與病理微觀成分建立聯系。本研究通過對腫瘤進行三維勾畫并提取影像組學特征,能夠更直觀、便捷且無創地觀察腫瘤的總體特征,這一點對于無法切除的胰腺癌患者尤為重要。Sun等[9]構建了基于CT的影像組學模型評估15種實體腫瘤(但未包括胰腺癌)中CD8+T細胞浸潤程度,并可預測免疫治療的療效。Liao等[12]基于CT圖像篩選7個組學特征構建的組學分值可以預測原發性肝癌患者的生存結局、CD8+T細胞浸潤程度、免疫表型和PD-1/PD-L1表達。在胰腺癌方面,Li等[24]發現基于CT的影像組學模型在評估腫瘤浸潤CD8+T細胞的訓練集和驗證集的AUC值分別為0.75和0.67。本研究基于MRI的機器學習預測模型在訓練集(AUC值為0.90)和驗證集(AUC值為0.79)中均具有較高診斷效能。與CT相比,MRI成像具有軟組織分辨率高、多序列多參數成像的優勢。
本研究存在一些不足之處。第一,本研究為單中心回顧性研究,未來需納入多中心數據做驗證集;第二,只納入了手術后患者,不可避免的存在偏倚;第三,由于胰腺癌呈浸潤性生長,邊緣較模糊,本研究仍采用手工勾畫腫瘤感興趣區,存在勾畫者間的經驗差異,導致可重復性差,且耗時費力,未來可借助人工智能算法實現腫瘤的全自動分割。
綜上所述,基于MRI影像組學特征的機器學習模型在預測胰腺癌CD8+T細胞浸潤上具有較高價值,有助于篩選可以從免疫治療中獲益的患者。但本研究僅探討了CD8+T細胞,而胰腺癌的腫瘤微環境組成復雜,且各組分間存在交互作用,因此該指標在臨床預后評估的價值仍有待進一步研究。
利益沖突所有作者聲明無利益沖突
作者貢獻聲明盧明智:研究操作、論文撰寫;劉芳、方旭:數據整理、統計學分析; 李晶、邊云:研究醞釀、研究指導、工作支持;邊云、邵成偉、李晶、陸建平:研究設計、研究指導、論文修改、經費支持

