pH響應/H2O2自供型金屬過氧化物在腫瘤化學動力學治療中的應用
高銘英,趙婷婷,姜 宇,馬佳悅,韓育衡,李妍妍,王 霆
(東北林業大學化學化工與資源利用學院,黑龍江 哈爾濱 150040)
1 前 言
癌癥(惡性腫瘤)作為最復雜的疾病之一,目前依然是造成人類死亡的主要原因。根據聯合國最新的預測,截至2030年,全球的癌癥死亡總人數將達到1320萬[1]。常見的癌癥治療策略主要包括手術切除、化學藥物治療、放射治療、消融治療、免疫治療和光學治療(包含光動力療法和光熱療法)等。其中,手術切除、化學藥物治療、放射治療、消融治療和免疫治療等技術已經應用于臨床實踐,并且取得了一定的療效,但它們都還存在著諸多問題(比如容易引起強烈的并發癥、產生嚴重的毒副作用、缺乏靶向性等),有待進一步解決。
與人體正常的器官組織相比,腫瘤病灶區的局部微環境(tumor microenvironment,TME)一般會呈現一些特異性,如局部微酸性、富含過表達的H2O2、組織乏氧等[2]。當前,根據腫瘤區域的這些特征,人們設計了多種多樣的能夠響應TME(如低pH敏感、H2O2響應、低氧靶向等)的生物醫藥材料,并將該材料作為藥物載體應用于腫瘤治療[3]。然而,通過對納米材料自身的巧妙設計實現基于TME區域特異性激活的高效腫瘤治療策略目前依然面臨著巨大的挑戰。化學動力學療法(chemodynamic therapy,CDT)是一種新型前沿的腫瘤治療技術,近些年來發展非常迅速[4]。CDT無需借助O2和外部能量(光能或超聲)即可進行治療,能被腫瘤內源性刺激激活,這使得該技術更適用于具有弱酸性、高H2O2濃度和低O2含量的TME,對光學治療敏感性差的深部腫瘤組織具有高度的選擇特異性[5,6]。然而遺憾的是,當前CDT的治療效果嚴重受限于腫瘤區域H2O2含量和離子(Fe2+、Cu+等)代謝水平,因而如何提高腫瘤病灶區H2O2和具有催化活性的金屬離子的濃度是實現高效CDT治療的關鍵。
金屬過氧化物(metal peroxides,MO2,M為Ca,Cu和Mg等)是人們最新開發出來用于治療腫瘤的生物納米材料,在TME中具有低pH響應、快速分解和自供H2O2等特點,可以顯著提升腫瘤病灶區H2O2水平,使腫瘤細胞發生金屬離子過載,通過芬頓或類芬頓反應使活性氧自由基(reactive oxygen species,ROS)急劇增多,同時釋放的某些金屬離子也會抑制細胞線粒體電子傳遞鏈協同殺死腫瘤細胞,因此MO2在應用于腫瘤CDT時表現出了巨大的優勢[7]。本文首先介紹CDT的基本概念和治療原理,接著總結MO2納米材料的種類及應用于腫瘤CDT治療時的反應原理與機制,并評述近年來國內外報道的不同pH響應/H2O2自供型MO2納米材料的研究進展情況,最后展望這類材料在腫瘤治療領域的應用前景和發展趨勢,并指出存在的挑戰,為該類材料未來發展提供借鑒性研究思路。
2 化學動力學療法的概念和治療原理
CDT是一種新興的基于ROS殺傷腫瘤細胞的治療技術,主要機制是基于芬頓或類芬頓反應,利用納米材料催化腫瘤區域過表達的H2O2,以產生高細胞毒性的羥基自由基(·OH)等強氧化性活性物種,用該活性物種破壞細胞生物大分子如脂質、蛋白質和DNA,引發細胞死亡,從而達到腫瘤治療的目的[8,9]。芬頓和類芬頓反應在形成ROS的過程中主要依賴金屬催化劑離子與H2O2之間的相互作用,無需O2和外部能量的輸入[10]。
正常體內的H2O2來源一般有幾種,如主要是在細胞新陳代謝時,胞內各種物質的氧化分解過程中產生;線粒體呼吸鏈電子傳遞過程中存在電子漏途徑,漏出的電子并沒有參與正常三磷酸腺苷合成的能量代謝過程,而是與O2反應,產生超氧陰離子(·O2-),最后通過鏈式反應進一步還原為H2O2,這些H2O2在細胞新陳代謝、信號傳遞和機體免疫等方面都發揮著重要作用[11]。由于腫瘤細胞的基因活性、細胞受體信號傳導和線粒體功能與正常細胞有異,因而該細胞間隙或內部往往會比正常細胞產生更多的H2O2(濃度為0.1~1.0 mmol/L)[12-14]。CDT技術正是利用這些過量表達的H2O2,以腫瘤局部微環境的弱酸性為反應條件、過渡金屬材料為納米催化劑,誘使細胞內發生芬頓或類芬頓反應,催化H2O2產生·OH等強氧化性ROS物種,引發腫瘤細胞凋亡。CDT不需要外界光能或超聲能量刺激,也不需要O2參與,有望克服腫瘤光/聲動力療法(目前基于ROS治療最常用的技術)遇到的一些難題,比如腫瘤組織內光穿透深度不足和乏氧環境下單線態氧生成效率低下等。
近些年,可用于腫瘤CDT的納米材料受到了廣大科研工作者們的強烈關注[15-17]。譬如,最經典的CDT納米材料是Fe3O4納米粒子,主要利用Fe3O4納米粒子中的Fe2+與H2O2在酸性條件下發生芬頓反應,如式(1)和式(2)所示[18]:
Fe2++H2O2→Fe3++·OH+OH-
(1)
Fe3++H2O2→Fe2++·O2H+H+
(2)
可以看出,H2O2與Fe2+反應后生成Fe3+、·OH和OH-。與其他類型的ROS相比,·OH能夠以更高的速率去攻擊和氧化大多數有機分子,對細胞造成更大的破壞[19]。此外,還有一些其他過渡金屬離子(如Mn2+、Ti3+、Cu2+和Co2+等),也可以作為類芬頓反應的催化離子,用于實現腫瘤CDT[20-23]。
3 不同類型的金屬過氧化物材料
MO2可以認為是H2O2分子中的2個氫原子被金屬離子取代后的產物,因此可以看成是H2O2的衍生物,主要包括CaO2、CuO2和MgO2等。MO2材料在水中或加熱條件下可以緩慢分解釋放O2,而在酸性條件下可以與水快速發生反應,生成金屬氫氧化物(或金屬離子)和H2O2,表現出強烈的氧化作用[24],如式(3)~式(5)所示[15]:
MO2+2H2O→M(OH)2+H2O2
M=Ca,Cu,Mg,Zn,etc.
(3)
M(OH)2+2H+→M2++2H2O
(4)
2H2O2→O2+2H2O
(5)
反應中生成的H2O2產物:① 會直接導致腫瘤細胞內的氧化應激水平增加;② 可以進一步與解離出來的或者通過外源性添加的過渡金屬離子(比如Cu+、Fe2+、Mn2+和Co2+等)發生芬頓或類芬頓反應生成·OH,實現CDT;③ 可以被機體內過氧化氫酶或一些納米酶材料(如MnO2納米顆粒)催化分解而產生氧氣,用于提高光/聲動力療法和放射療法等O2依賴治療技術的療效。此外,上述反應過程釋放的過量金屬離子有時候也能起到抑制腫瘤細胞生長與增殖的作用,例如CaO2釋放的Ca2+引起細胞鈣超載[25]和ZnO2釋放的Zn2+會抑制細胞線粒體電子傳遞鏈的活性[26],從而起到協同殺死腫瘤細胞的效果。
3.1 過氧化鈣(CaO2)
Ca2+廣泛存在于機體各種細胞中,在體內各項生理活動如維持細胞膜生物電位、細胞增殖等中均扮演著重要的角色。在腫瘤細胞內,由于過氧化氫酶表達下調,氧化應激水平的增加會改變一些蛋白質的功能,導致鈣相關的離子通道脫敏,引發Ca2+在腫瘤細胞內發生不可控積累,因而腫瘤細胞內Ca2+濃度高于正常細胞[27,28]。CaO2納米材料是最先開發出來也是研究最多的一類用于腫瘤治療的MO2材料,該材料可以在酸性條件下分解為Ca2+和H2O2,Ca2+本身具有一定的化學惰性,很難像Fe2+或Mn2+催化劑一樣直接與H2O2發生芬頓反應,但CaO2分解生成的H2O2可對芬頓反應產生顯著的促進作用[29]。此外,釋放的過量Ca2+會誘使腫瘤細胞的細胞質內Ca2+異常積累,引起細胞發生鈣超載,從而加劇誘導細胞死亡[25]。
2020年,Han等[30]將合成的Fe3O4納米粒子與CaO2納米粒子結合在一起,聯合花青素Cy7近紅外染料熒光標記技術,采用透明質酸(hyaluronic acid,HA)穩定劑進行共包覆,構建了一種新型的基于CaO2的H2O2自供型用于增強CDT療效的納米診療平臺(CaO2-Fe3O4@HA NPs)。該納米體系特異性響應腫瘤弱酸環境,首先與H2O反應生成H2O2,其中的Fe3O4組分進一步將H2O2轉化為·OH,誘導腫瘤細胞死亡,增強CDT治療效果,如圖1所示。利用體系中Fe3O4納米粒子的T2型磁共振增強和Cy7染料的近紅外熒光性能,也實現了實時監測材料的靶向腫瘤富集效果和體內CDT可視化治療。
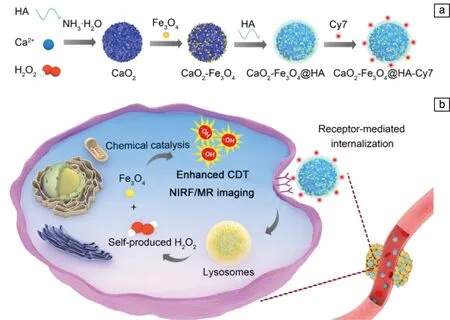
圖1 CaO2-Fe3O4@HA NPs的合成過程示意圖(a)和化學動力學療法機理示意圖(b)[30]Fig.1 Schematic diagram of synthetic procedures (a)and schematic illustration for the chemodynamic therapy mechanism (b)of CaO2-Fe3O4@HA NPs[30]
2021年,Yan等[31]將光敏分子Ce6、MnO2與黑色素納米顆粒整合在一起,修飾具有靶向腫瘤細胞表面受體CD44功能的HA,制備了MCMnH納米材料,并將該納米材料和CaO2納米顆粒聯用,組裝到殼聚糖溫敏性水凝膠里,得到了一種多重TME刺激響應的診療材料平臺。受益于體系中使用的CaO2納米顆粒在弱酸下可分解產生大量H2O2的特性,該納米平臺在近紅外輻射下不僅能產生強烈的光熱轉換效應,還可以顯著促進光敏劑產生單線態氧,同時MnO2分解產生的Mn2+可以進一步發生芬頓反應產生大量ROS,從而同時提高CDT、光動力療法和光熱療法聯合抗腫瘤的作用。此外,MCMnH+CaO2納米平臺還顯示出優異的磁共振和紅外光熱成像能力,為監測治療過程提供了多種可視化方案。同年4月,Chen團隊[32]設計并合成了具有多酚化合物單寧酸(tannic acid,TA)和Fe3+配位化合物TA-Fe納米涂層的CaO2納米藥物(CaO2@TA-FeⅢ),該藥物合成方法簡單便捷,易于快速大量合成。應用于腫瘤治療時,CaO2@TA-FeⅢ納米藥物可以靶向到達腫瘤部位,其中包含的CaO2納米球會逐漸發生解離,生成的H2O2與納米涂層中被TA還原生成的Fe2+發生芬頓反應,產生的·OH誘導腫瘤細胞發生氧化應激,促進“鈣超載”過程的發生,從而加速腫瘤細胞死亡。體外細胞和動物體內的實驗結果表明,CaO2@TA-FeⅢ納米體系能夠有效殺傷腫瘤細胞,顯著抑制腫瘤生長,具有優異的腫瘤治療效果,在腫瘤治療領域具有廣闊的應用前景。
3.2 過氧化銅(CuO2)
與Fe2+催化的芬頓反應相比,Cu2+催化的類芬頓反應在弱酸性或者中性條件下都可以高效地發生,且反應速率更快,可達到Fe2+芬頓反應速率的160倍[33]。Cu2+與H2O2產生的類芬頓反應過程如式(6)和式(7)所示[34]:
Cu2++H2O2→Cu++·O2H+H+
(6)
Cu++H2O2→Cu2++·OH+OH-
(7)
可以看出,Cu2+與H2O2反應后生成Cu+、·O2H和H+;而Cu+可與H2O2繼續反應,生成Cu2+、·OH和OH-。此外,Cu+也可以來源于Cu2+與腫瘤內高濃度的谷胱甘肽(glutathione,GSH)之間發生的氧化還原反應,如式(8)所示:
Cu2++GSH→Cu++GSSG(氧化型谷胱甘肽)
(8)
在2019年,Lin等[35]將聚乙烯吡咯烷酮作為保護劑,加入Cu2+和H2O2在堿性條件下反應,得到了粒徑為5 nm左右的CuO2納米點,并將該納米點開發為一種用于腫瘤CDT的納米藥物。研究表明,該CuO2納米點在小鼠尾靜脈注射后能夠通過腫瘤組織特有的高通透性和滯留效應被動靶向富集到腫瘤組織內,并特異性地響應腫瘤弱酸微環境,逐漸分解為Cu2+和H2O2,進一步發生類芬頓反應產生大量·OH,·OH通過誘導溶酶體脂質過氧化而影響溶酶體膜滲透功能,從而介導腫瘤細胞凋亡,實現了H2O2自供型CDT,如圖2所示。這項工作首次將CuO2材料開發為一種新型的H2O2自體供給型的CDT納米藥物,該藥物具有腫瘤被動靶向、體內特異性可降解等優點,有效解決了當前很多CDT納米材料應用時面臨的腫瘤內H2O2不足等問題,對今后開發其他類型的用于腫瘤治療的MO2材料具有啟示意義。
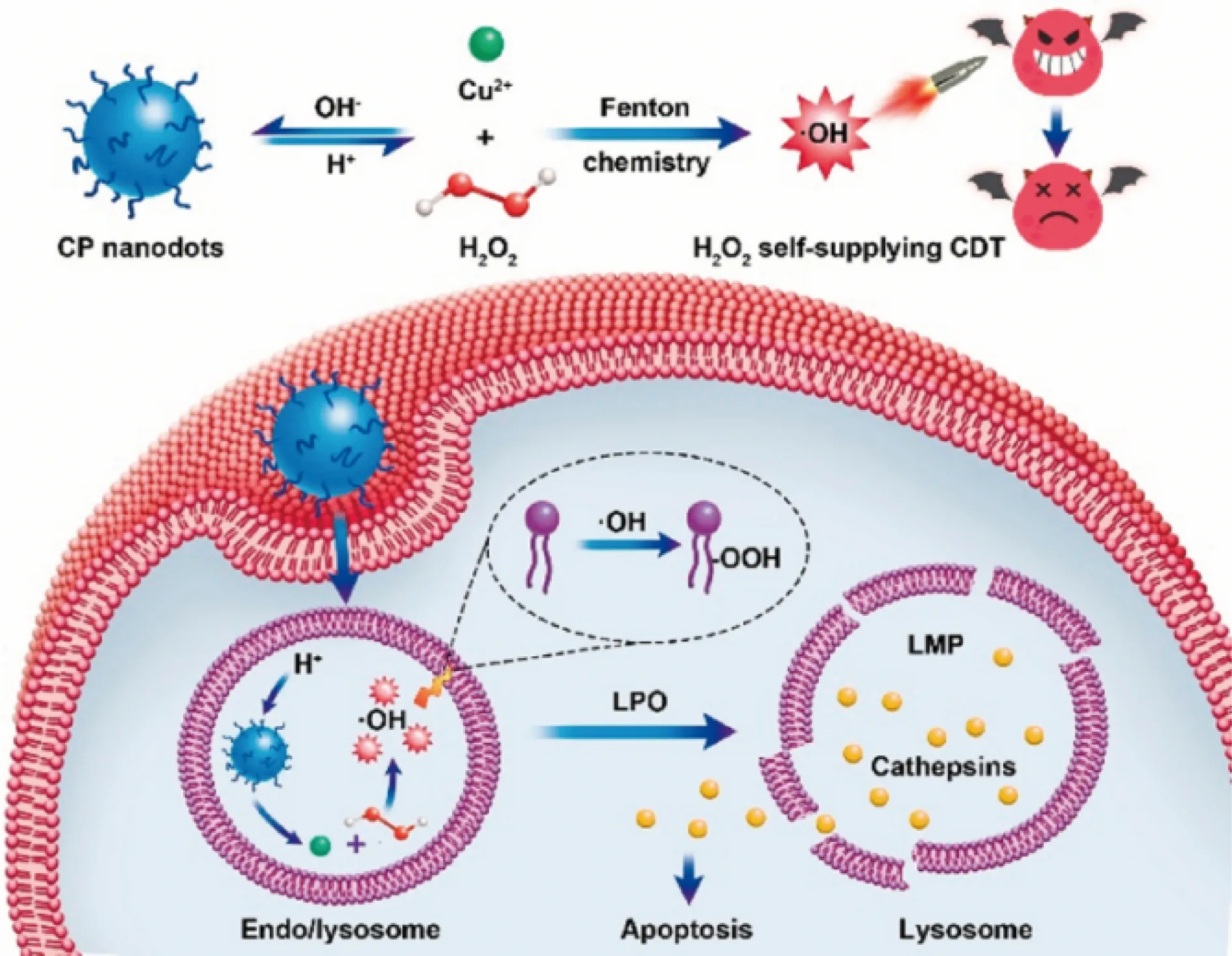
圖2 CuO2納米點的合成和化學動力學療法機理示意圖[35]Fig.2 Schematic illustration for the synthesis and chemodynamic therapy mechanism of CuO2 nanodots[35]
2021年,Hou等[36]將絲膠蛋白作為穩定劑,在堿性條件下采用一步過氧化的方法,合成了裝載有化療藥物阿霉素(Dox)的CuO2納米載體(SS-CuO2@Dox,SCD),該納米載體通過自供H2O2和遞送Dox藥物實現腫瘤CDT/化療協同治療,如圖3所示。在動物體內的實驗發現,經尾靜脈注射后,該SCD可以通過高通透性和滯留效應靶向富集到腫瘤區域,并在腫瘤弱酸性環境下,特異性分解生成H2O2和Cu2+,實現基于類芬頓反應的腫瘤CDT應用。同時,Dox在腫瘤內的成功釋放所產生的化療效果可以與CDT協同作用,顯著增強了CuO2納米載體對腫瘤的治療效率。
3.3 過氧化鎂(MgO2)
鎂是人體必需的一種礦物常量元素,幾乎會參與體內所有新陳代謝過程及生命活動,大部分成年人體內鎂的總含量為20~28 g,其中有60%以上存在于骨頭和牙齒中,約27%分布于軟組織,多以活潑的Mg2+-ATP形式存在。MgO2材料具有弱氧化性,在酸性條件下與H2O反應生成Mg2+和H2O2,對芬頓或類芬頓反應的發生有促進作用[37]。
2019年,Tang等[38]首次將MgO2開發為一種具有TME響應性和生物降解性的腫瘤治療納米藥物,如圖4所示。他們采用轉鐵蛋白對合成的MgO2納米片(transferrin-modified magnesium peroxide nanosheets,TMNSs)進行表面修飾,提出了一種利用腫瘤細胞與正常細胞代謝微環境的差異性(如腫瘤微酸環境、過氧化氫酶含量低等),使用TMNSs納米藥物將ROS特異性遞送給腫瘤細胞,而不會對正常細胞造成損害的分子動力學治療新策略。該納米片具有較高的比表面積,能夠高效負載轉鐵蛋白,并在微酸性和低過氧化氫酶活性的TME中更快地與質子反應,釋放無毒的Mg2+,產生高濃度的H2O2促進腫瘤細胞死亡,并破壞轉鐵蛋白結構釋放Fe3+,進而通過芬頓反應產生劇毒·OH殺傷腫瘤細胞。難能可貴的是,TMNSs在TME和正常組織中都能降解,生成的物種(Mg2+、O2和H2O)均無毒無害,因而具有優異的生物相容性。因此,該研究提供了一種嶄新的利用生物可降解的MgO2納米前藥選擇性地將ROS遞送給腫瘤細胞的治療策略,有望實現更加安全的臨床治療。
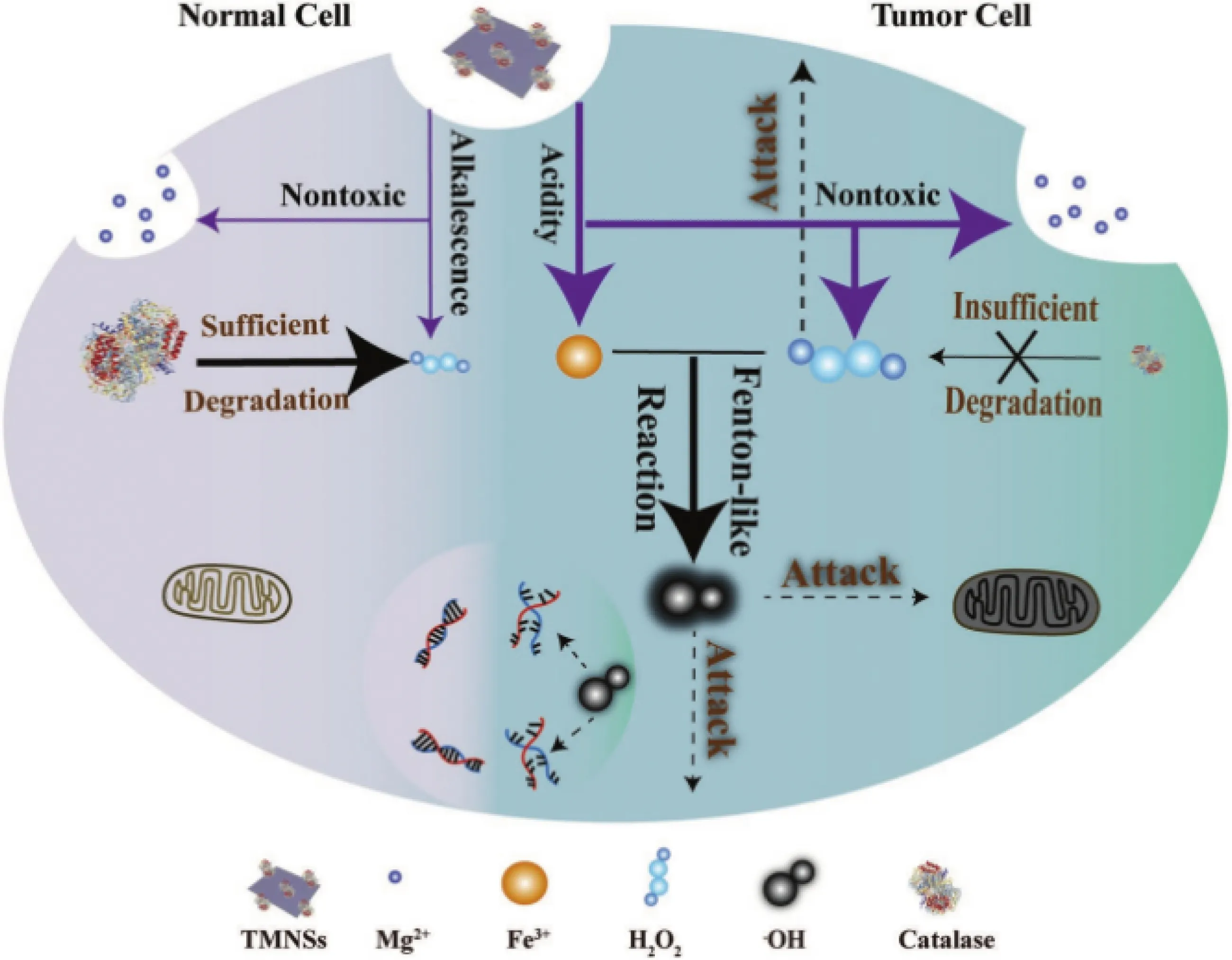
圖4 基于MgO2的納米藥物用于腫瘤治療示意圖[38]Fig.4 Schematic diagram of MgO2-based nanodrug for tumor therapy[38]
3.4 過氧化鋅(ZnO2)
Zn2+是生命必需的一種微量金屬離子,在機體的生長發育、促進細胞免疫功能等方面都有著非常重要的作用。然而,鋅元素在腫瘤細胞內的積累會抑制細胞線粒體末端氧化和呼吸作用,誘導線粒體凋亡,因而表現出抗細胞增殖作用,還可以依靠激活細胞內的特定信號通路起到抑制腫瘤侵襲和遷移的作用。因此,含鋅的一類材料通過這些作用機制可以表現出很強的抗腫瘤能力[39]。
2019年,Lin團隊[26]設計合成了一種摻雜順磁錳(Mn)的基于聚乙烯吡咯烷酮修飾的過氧化鋅納米顆粒(Mn-ZnO2NPs),并將該納米顆粒用于腫瘤組織細胞內的ROS增強劑和生成劑,如圖5所示。Mn-ZnO2NPs被選擇性地內化到腫瘤細胞后,在溶酶體弱酸環境下進行分解,不僅實現了外源性H2O2的可控傳遞,而且釋放的Zn2+也可以通過抑制電子傳遞鏈增加線粒體內·O2-和H2O2的產生,增加了內源性活性氧的產生,從而協同治療腫瘤。此外,微酸性條件刺激釋放的Mn2+擁有T1型磁共振增強性能,使得Mn-ZnO2NPs材料具有可特異性激活的磁共振成像能力,這有助于監測體內材料的解離和后續的治療過程。
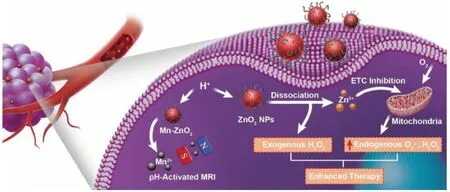
圖5 Mn-ZnO2 NPs用于增強氧化應激腫瘤治療示意圖[26]Fig.5 Schematic illustration of the Mn-ZnO2 NPs for enhanced oxidative stress-based tumor therapy[26]
2021年,Zhang團隊[40]通過液相反應將卟啉類光敏劑(sinoporphyrin sodium,SPS)負載到合成的ZnO2納米粒子上,得到的納米體系SPS@ZnO2NPs可作為一種TME響應的多功能納米藥物,用于熒光成像引導的分子動力學療法和光動力療法協同治療腫瘤,如圖6所示。在弱酸性的TME中,SPS@ZnO2NPs分解為H2O2和內源性Zn2+,同時釋放裝載的SPS光敏分子,在630 nm激光照射之下,產生有毒的1O2引發光動力治療效果。腫瘤細胞內H2O2水平的升高不但急劇增加了細胞氧化應激負擔,也協同消耗了胞內的GSH,從而增強了光動力療法的作用。這種雙模式聯合治療策略可以通過產生大量ROS來破壞溶酶體和線粒體,選擇性地誘導腫瘤細胞凋亡。此外,體內外的毒理實驗證實了這種多功能納米藥物沒有明顯的細胞毒性和體內全身性毒性,表現出優異的生物安全性,具有良好的臨床轉化價值。
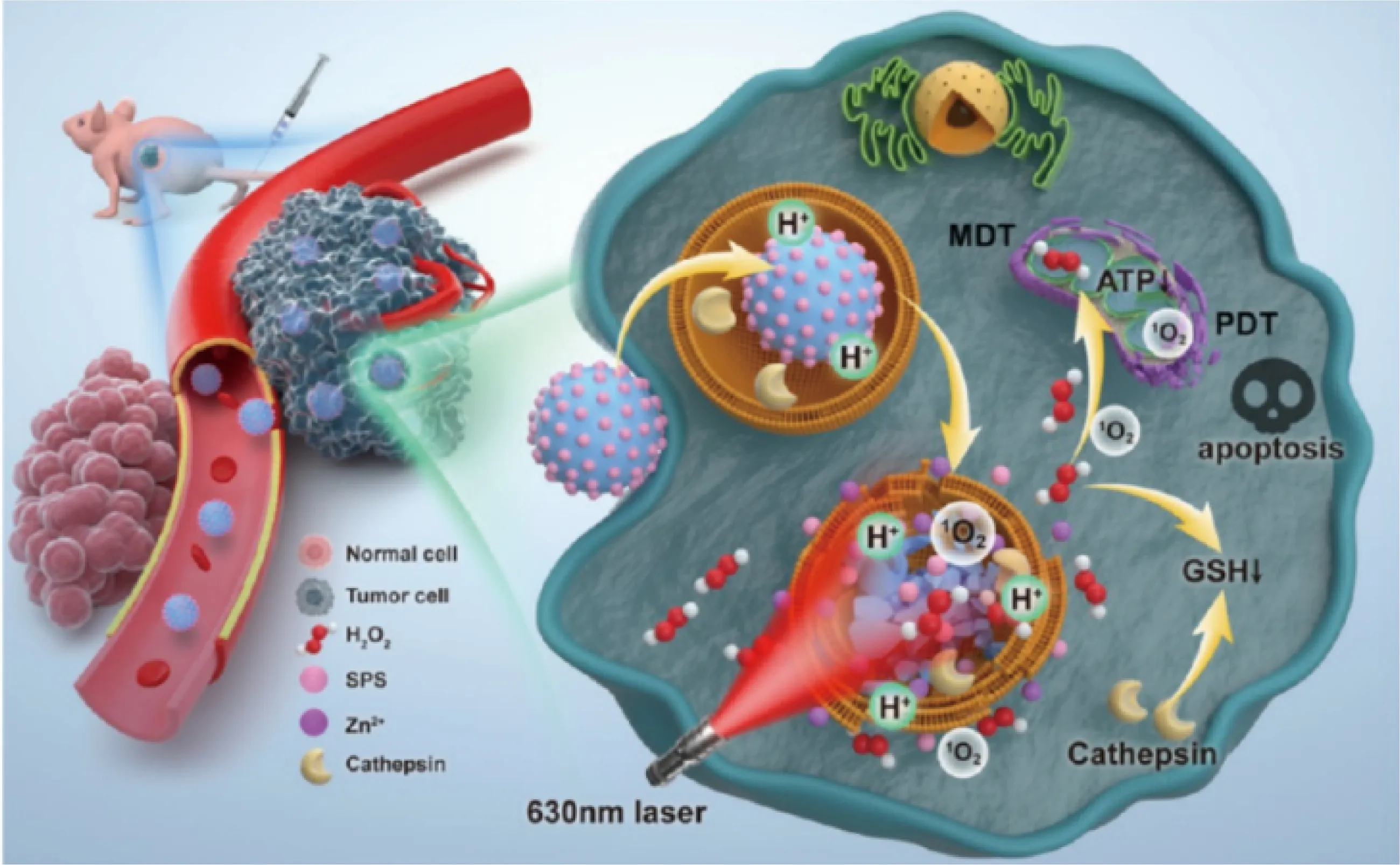
圖6 SPS@ZnO2 NPs用于熒光成像引導的分子動力學療法和光動力療法的應用示意圖[40]Fig.6 Schematic diagram of SPS@ZnO2 NPs for fluorescence imaging-guide molecular dynamic therapy (MDT)and photodynamic therapy (PDT)[40]
4 結 語
金屬過氧化物(metal peroxides,MO2,M為Ca,Cu和Mg等)是非常有應用前景的H2O2自供型腫瘤治療材料,可在弱酸微環境中響應性分解,產生的H2O2不僅可以直接提升細胞內外的氧化應激水平,還可以與過氧化氫酶或納米酶材料反應生成O2,緩解腫瘤乏氧狀態,改善局部微環境。此外,MO2材料可以作為一種新型多功能納米載體,采用特定的化學手段進行修飾,與光敏劑分子、酶或化療藥物相結合,通過聯合光/聲動力療法、光熱療法、化學藥物療法以及免疫治療等多種治療手段,獲得更優異的協同治療效果。然而,目前基于此類材料用于腫瘤治療的研究尚處于初步階段,仍然存在許多關鍵問題和挑戰有待進一步解決:① 大多數合成的MO2材料都不是特別的穩定,這對于其體內應用、大批量生產和長期保存都是不利的,因此需要開發新方法提高MO2材料的穩定性;② 納米材料的表面性質(如形貌、尺寸和電荷情況)會影響它對靶向腫瘤的滲透率,目前報道的MO2材料大多數都是球形,形貌比較固定單一,缺乏其他形貌(比如納米棒、多孔結構等)、尺寸、電荷性質探索和主動靶向性修飾提高腫瘤內富集等方面的報道;③MO2材料具有應用于多種方式聯合治療的潛力,在生物學領域應用仍有待進一步探索,如目前主要應用于聯合化學動力學療法、光動力療法和光熱療法等領域,有關結合磁熱、氣體治療或免疫治療方面的研究不多;④ 對MO2材料在實際應用時的生物安全性和長期體內毒性方面的考察還遠遠不夠,考慮到MO2材料弱酸響應降解的特性,該材料有可能會被正常細胞內吞,溶酶體微酸環境也會使它降解,產生的H2O2和金屬離子對正常細胞也會造成一定毒性,因此對MO2材料體內給藥劑量、代謝途徑及毒理方面的研究很關鍵。盡管仍有許多問題有待研究,MO2納米材料的開發給腫瘤治療帶來了新的策略,為成像技術和多種治療手段的聯合提供了新的、強有力的生物材料平臺。希望MO2納米藥物在生物醫學領域的應用研究能夠得到更加廣泛的關注和快速的發展,早日應用于臨床實踐,最終使廣大患者受益。

