肺部感染中STING炎癥信號通路的免疫作用機制研究
李清權 許華平 劉金環
肺部是最常受金黃色葡萄球菌(Staphylococcus aureus,S.aureus)影響的器官之一[1]。在S.aureus感染期間,肺泡巨噬細胞和樹突狀細胞被募集到感染部位并有助于細菌清除,但也可能加劇肺部炎癥和損傷[2-3]。因此,這些免疫細胞和病原體之間的早期相互作用對于確定S.aureus感染疾病的結果很重要。先天免疫系統檢測病原體相關分子模式通過激活模式識別受體快速響應,包括干擾素基因刺激物(stimulator of interferon genes,STING),這是宿主防御微生物感染的第一道防線[4]。STING作為感染環境中炎癥的重要介質,參與調節促炎和抗炎細胞因子的分泌[5]。然而,S.aureus是否能激活STING信號通路,并通過STING介導促炎和抗炎細胞因子的分泌尚不清楚。因此,本研究分析了C57BL/6J小鼠、STING-/-小鼠在S.aureus感染期間死亡率、炎癥介質產生和器官損傷的差異。
資料與方法
一、細菌菌株和動物
金黃色葡萄球菌USA 300購自美國典型培養物保藏中心(ATCC)。將細菌菌株在Mueller-Hinton Ⅱ陽離子調節肉湯(MH肉湯,美國BD Biosciences公司)中于37 ℃培養16 h,同時不斷搖晃至600 nm處的光密度為2.0。8周齡C57BL/6J WT和STING缺陷型(STING-/-)小鼠由南京大學模式動物研究所提供[6]。將小鼠安置在微型隔離籠中,并隨意接受食物和水。實驗室溫度為(24±1) ℃。在實驗之前,將小鼠安置至少2~3 d以適應環境。本研究動物實驗經本院倫理委員會審批同意(倫審2021-012)。
二、小鼠的實驗性感染和治療
實驗分兩部分。第一部分考察STING在調節S.aureus感染誘導的小鼠死亡率中的作用。使用計算機隨機化表將60只小鼠隨機分為3組:對照組、C57BL/6J WT組和STING-/-組,每組20只。C57BL/6J WT組和STING-/-組小鼠腹腔注射金黃色葡萄球菌 (1×109CFU)。對照組小鼠腹腔注射1 mL PBS。連續觀察60 h內動物存活情況。第二部分考察STING對S.aureus感染期間炎癥介質產生和器官損傷的影響。使用計算機隨機化表將72只小鼠隨機分為3組:對照組、C57BL/6J WT組和STING-/-組,每組24只。C57BL/6J WT組和STING-/-組小鼠腹腔注射金黃色葡萄球菌 (1×109CFU)[7]。對照組小鼠腹腔注射1 mL PBS。分別在注射前和注射后6 h和24 h,各組隨機選取8只小鼠收集血清和肺組織,用于炎癥介質和器官損傷分析。
三、酶聯免疫吸附試驗(ELISA)
將收獲的肺切成小塊并稱重。然后,將組織均質化并用T-PER組織蛋白提取試劑(美國Thermo Scientific公司)進行裂解,然后在4 ℃下以1500 g離心20 min。收集血清后,小鼠血清在37 ℃下孵育1 h,然后在4 ℃下孵育過夜。隨后,將血清以1000 × g離心15 min,收集上清液。使用TNF-α、IL-10(美國Biolegend公司)和RANTES(美國PeproTech公司) 的ELISA試劑盒檢測TNF-α、IL-10和RANTES水平。
四、肺的組織病理學
從左下葉收集的肺組織樣本用10%福爾馬林固定,石蠟包埋,切成4 μm切片。對于組織學檢查,石蠟切片用Mayer蘇木精和1%伊紅染色。通過光學顯微鏡和攝影系統觀察和評估切片。將小鼠的冷凍6 μm肺組織切片在室溫下解凍15 min,然后在冷丙酮中固定10 min。將解凍的切片在含有0.25% Tween的冷PBS中洗滌,并在室溫下在5%牛血清白蛋白中封閉1 h。添加兔抗高遷移率組框蛋白1(high-mobility group box protein 1,HMGB1)單克隆抗體(1 ∶100,英國Abcam公司),切片在4 ℃黑暗中孵育過夜。孵育后,使用含0.25% Tween的PBS洗滌載玻3次,每次15 min,然后在Alexa Fluor 488偶聯山羊抗兔IgG二抗(1 ∶1 000,英國Abcam公司)中室溫避光孵育1 h。采用LSM 800共聚焦顯微鏡(德國Zeiss公司)捕獲圖像(×100 放大倍率)和分析熒光強度。從每個樣品中隨機選擇三個捕獲場之一并用于熒光強度分析。在相同條件下捕獲來自不同樣本的圖像。
五、數據分析
結 果
一、STING在調節S.aureus感染誘導的小鼠死亡率中起關鍵作用
采用STING缺陷型(STING-/-)小鼠研究STING在調節S.aureus感染誘導的小鼠死亡率中的作用(圖1)。C57BL/6J WT小鼠腹膜內注射S.aureus后42 h的存活率為50%。STING-/-小鼠在腹腔注射S.aureus后30 h的存活率為50%(圖2)。肺組織的組織病理學分析顯示,S.aureus感染導致小鼠肺組織出現嚴重的病理變化,如肺泡破壞和肺泡腔擴張。STING-/-小鼠肺損傷程度進一步加重(圖3)。
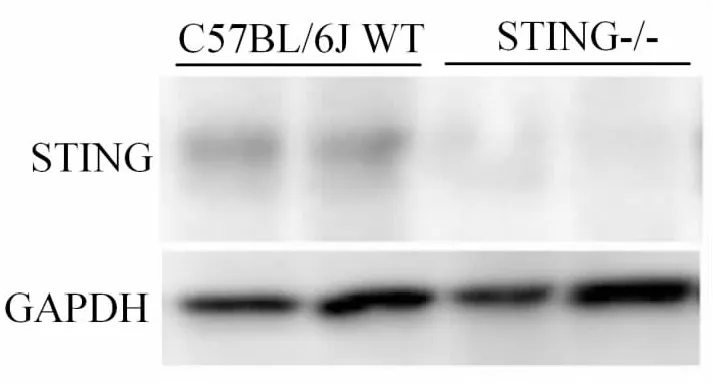
圖1 WB驗證STING-/-小鼠肺組織中STING敲除
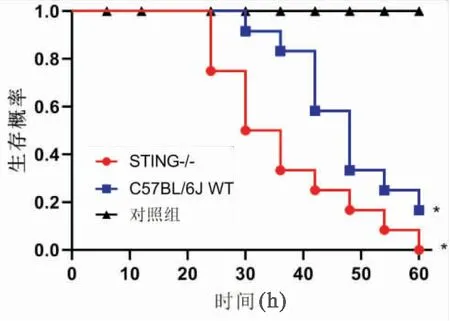
圖2 對數秩檢驗用于比較實驗組之間的生存差異(n=20)。與對照組相比,*P<0.05
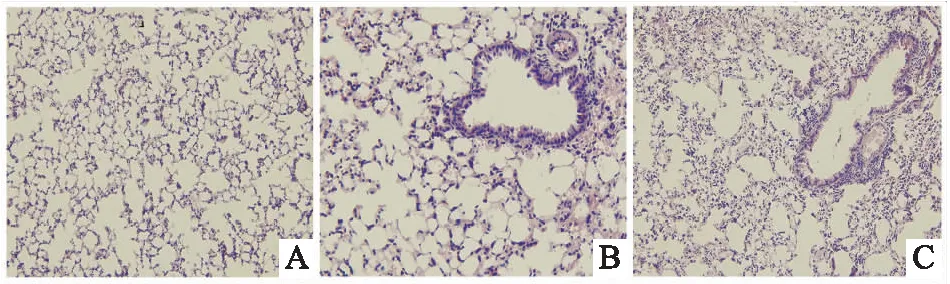
圖3 H&E染色檢測感染后24 h小鼠肺組織病理變化(×100) A:對照組;B:C57BL/6J WT組;C:STING-/-組
二、 STING參與S. aureus感染小鼠的促炎細胞因子、抗炎細胞因子和趨化因子的產生
與C57BL/6J WT組相比,STING-/-組小鼠在S.aureus感染后6 h肺和血清TNF-α、IL-10和RANTES水平均顯著降低(P<0.05),而STING-/-組小鼠在S.aureus感染后24 h肺和血清TNF-α、IL-10和RANTES水平均顯著升高(P<0.05)(表1-3)。

表1 ELISA分析小鼠肺和血清中TNF-α水平(感染前、感染后6 h和24 h)

表2 ELISA分析小鼠肺和血清中IL-10水平(感染前、感染后6 h和24 h)

表3 ELISA分析小鼠肺和血清中RANTES水平(感染前、感染后6 h和24 h)
三、 STING可以減弱S. aureus誘導小鼠HMGB1的表達
在S.aureus感染期間,STING-/-小鼠肺中HMGB1的表達在感染后6 h時顯著低于C57BL/6J WT小鼠(P<0.05),在感染后24 h時顯著高于C57BL/6J WT小鼠(P<0.05)(圖4,表4)。
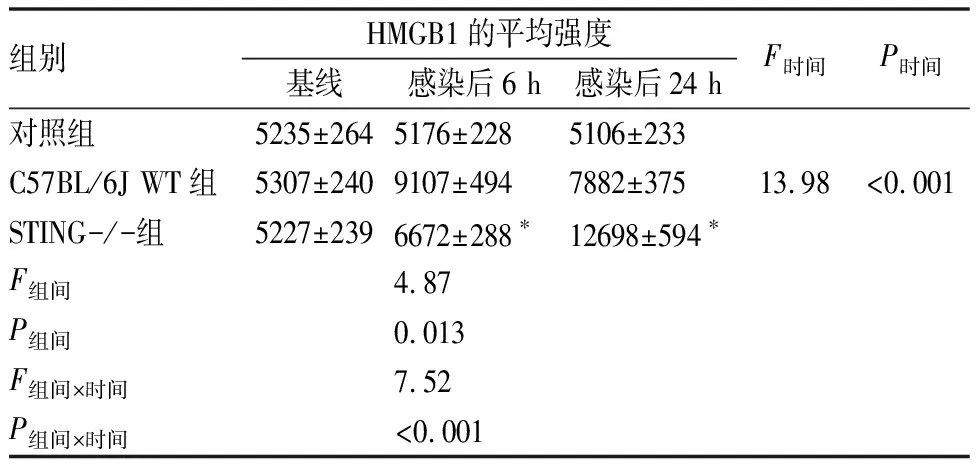
表4 各組感染前、感染后6 h和24 h小鼠肺組織中HMGB1的平均強度
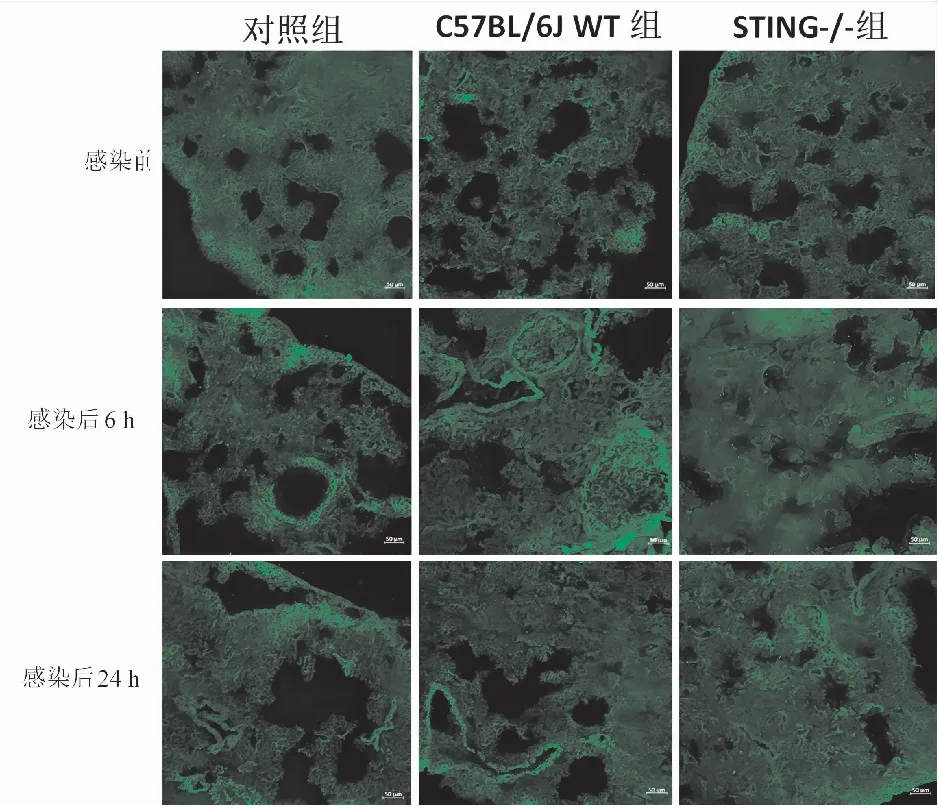
圖4 免疫熒光檢測感染前、感染后6 h和24 h小鼠肺組織中HMGB1的表達(×100)。比例尺=50μm
討 論
S.aureus是一種革蘭氏陽性細菌,通常作為位于前鼻孔表面的共生細菌發現。然而,它具有多種毒力因子,在某些條件下可能會致病[8]。S.aureus引起的全身感染主要表現為菌血癥、肺炎、膿毒癥和中毒性休克綜合征[9]。研究發現,模式識別受體識別來自S.aureus的病原體相關分子模式,然后激活NF-κB和MAPK信號通路,介導促炎細胞因子、趨化因子和抗炎細胞因子的強烈釋放[10]。本研究表明,與C57BL/6J WT小鼠相比,在S.aureus感染期間,STING-/-小鼠的死亡率加快。基于這一觀察,我們推斷STING對于介導炎癥反應和調節S.aureus誘導的小鼠死亡率可能是必不可少的,但是,STING調節這一過程的確切機制仍不清楚。為了解釋觀察到的現象,我們接下來探索了S.aureus感染小鼠中促炎細胞因子、趨化因子和抗炎細胞因子的水平。
先前的研究報道,在S.aureus感染小鼠的急性期,TNF-α和IL-1β水平顯著升高[11]。S.aureus成分脂磷壁酸的乳房內攻擊會增加各種細胞因子的mRNA表達,包括TNF-α、IL-1β和RANTES[12]。IL-10通過限制過度的炎癥反應,在感染和炎癥期間維持組織穩態方面發揮著重要作用[13]。細胞因子和趨化因子的產生被認為是細菌感染過程中宿主炎癥反應強度的重要指標。我們的結果表明,與C57BL/6J WT小鼠在感染后6 h相比,STING-/-小鼠中TNF-α、RANTES和IL-10的產生減弱。以往的研究報道,感染早期的初始炎癥反應對宿主有益,可提高細菌的清除率,是減弱細菌入侵、控制炎癥和減少組織損傷的關鍵因素[14]。通過STING識別的S.aureus的細菌肽聚糖可以誘導IL-10的產生,從而控制組織損傷和對S.aureus感染的疾病耐受性[15]。此外,STING已被證明在S.aureus識別和清除中發揮關鍵作用[16]。基于先前研究的這些發現和本研究結果,我們推斷在STING缺乏的情況下,宿主先天免疫系統無法全面識別來自S.aureus的病原體相關分子模式。因此,感染早期小鼠促炎細胞因子、抗炎細胞因子和趨化因子的產生受損不利于S.aureus的清除。
值得注意的是,我們的結果顯示,與C57BL/6J WT小鼠相比,STING-/-小鼠在感染24 h后TNF-α、RANTES和IL-10的分泌增加。先前的研究報道,S.aureus誘導的全身炎癥激活的免疫細胞會分泌大量的促炎細胞因子和抗炎細胞因子,它們負責調節免疫反應[17]。IL-10的免疫逃避作用在葡萄球菌菌血癥患者中最為明顯,其中IL-10水平升高與死亡率相關[18]。循環中促炎細胞因子和抗炎細胞因子水平升高會進一步增加免疫系統的活性,在極端情況下會導致器官損傷和死亡。膿毒癥期間巨噬細胞內毒素耐受性的發展會重新編程STING信號傳導以抑制促炎細胞因子而不抑制抗炎和抗菌介質,從而保護宿主免受過度炎癥和組織損傷[19]。我們推斷,在STING缺乏的情況下,宿主感染耐受性未完全激活,但免疫驅動的抗性在感染后指定時間點過度激活。這些結果在一定程度上解釋了與C57BL/6J WT小鼠相比,STING-/-小鼠的死亡率在S.aureus感染期間加速。基于先前研究的這些發現和本研究結果,我們初步得出結論,STING可以在指定的時間點調節宿主感染耐受中炎癥介質的產生和免疫驅動的對S.aureus感染的抵抗之間的平衡。
HMGB1被認為是與炎癥反應相關的組織損傷信號[20]。與上述發現一致,本研究中與C57BL/6J WT小鼠在感染后6 h相比,HMGB1在STING-/-小鼠中的表達減弱。然而,隨著S.aureus感染的延長,HMGB1的表達在STING-/-小鼠中增強。以前的研究報道,HMGB1是內毒素致死的晚期介質,并參與許多生物過程,包括膿毒癥和休克[20]。在膿毒癥和內毒素血癥中,中和HMGB1可以阻斷LPS或CLP的致死作用[21]。基于這些發現和本研究結果,我們推斷在S.aureus感染期間,STING在感染耐受和免疫驅動的抵抗中發揮著關鍵作用,其可能通過促進HMGB1表達進而誘導炎癥介質的產生,決定了小鼠器官損傷的嚴重程度。
綜上所述,在S.aureus感染過程中,STING可以調節免疫驅動的抵抗和耐受之間的平衡,從而影響體內炎癥介質的產生,進而改善肺損傷程度和死亡率。此外,在S.aureus感染期間,確保宿主先天免疫系統中STING參與對于維持宿主免疫驅動的抗性和耐受性之間的平衡至關重要。

