血清白介素-10與慢阻肺患者肺功能之間的關系
于易瓊 丁震 徐康 李秀
慢性阻塞性肺疾病(慢阻肺)的本質特征是慢性氣道炎癥性疾病[1],涉及炎癥細胞、炎癥因子以及趨化因子等,多種促炎因子如白介素-6,在慢阻肺的發病機制中取得了一定的研究成果[2-3],但關于抗炎因子的研究甚少。白介素-10(interleukin 10,IL-10)是一種抗炎細胞因子,能有效地抑制促炎細胞因子的活性[4-6],近些年研究發現IL-10亦參與了慢阻肺的發病機制[7-8]。肺功能在慢阻肺的診斷和治療效果上有重要的客觀指導作用[9]。但許多患者由于存在禁忌證,無法完善肺功能檢查[10]。尋求一種簡易的生物標志物來間接反映肺功能嚴重程度,顯得十分必要。目前IL-10與肺功能的關系尚不明確,故本文旨在研究IL-10與慢阻肺患者肺功能之間的關系。
資料與方法
一、一般資料
選取2020年11月—2021年5月于安徽醫科大學第三附屬醫院呼吸與危重癥醫學科門診就診的穩定期慢阻肺患者124例,其中男性86例,女性38例,中位數年齡75.50(68.00,81.00)歲。納入標準:(1)根據2019年慢阻肺全球防治倡議明確診斷為慢阻肺的患者,4周之內未發生過急性加重事件。(2)能夠配合完成問卷調查,完善血清IL-10以及肺功能檢查。(3)年齡≥40歲。排除標準:(1)合并有其他肺部疾病:肺炎、支氣管哮喘、支氣管擴張、肺結核、肺癌、氣胸、間質性肺病、胸腔積液。(2)合并有自身免疫性疾病,如類風濕關節炎、系統性紅斑狼瘡、干燥綜合征、銀屑病等。(3)合并有其他基礎疾病:糖尿病、高血壓、冠心病、腦梗塞。(4)合并有腫瘤性疾病。所有入組患者均簽署書面知情同意書,本研究經醫院倫理委員會批準(2020-016號)。
二、方法
所有患者完善基本臨床資料調查:年齡、性別、體重指數、吸煙指數(每天吸煙支數×吸煙年數)、咳嗽咳痰年限(病齡),并于第二日早晨完善血清IL-10檢測及肺功能檢查。(1)肺功能測定:采用德國耶格(Master Screen型)肺功能儀檢測入組患者肺功能,記錄一秒用力呼氣量/用力肺活量(FEV1/FVC)、一秒用力呼氣量占預計值百分比(FEV1%pred)、用力肺活量占預計值百分比(FVC%pred)、50%肺活量時最大呼氣流速占預計值百分比(FEF50%pred)、75%肺活量時最大呼氣流速占預計值百分比(FEF75%pred)、最大呼氣中期流速占預計值百分比(MMEF%pred)、肺一氧化碳彌散量占預計值百分比(DLCO%pred)。肺功能結果的解釋遵循美國胸科協會和歐洲呼吸學會的建議[11]。根據 《慢性阻塞性肺疾病診治指南》 (GOLD指南)肺功能分級標準, 以 FEV1%pred進行慢阻肺嚴重程度分級:GOLDⅠ級(輕度)≥80%;GOLDⅡ級(中度):≥50%~<80%;GOLD Ⅲ級(重度):≥30%~<50%;GOLD Ⅳ級(極重度)<30%。彌散功能分度標準按DLCO%pred數值進行劃分:正常≥80%,輕度減低≥60%~<80%,中度減低≥40%~60%,重度減低<40%。(2)IL-10測定:使用EDTA-K2管收集患者血液標本,室溫放置1小時后,1000r/min離心30分鐘,吸取上層血清,分裝至-80℃貯存。檢測時將樣本緩慢的恢復至室溫,使用人IL-10 ELISA試劑盒(由武漢賽維爾生物科技有限公司提供),嚴格按照說明書,采用雙抗體夾心酶聯免疫吸附法檢測。
三、統計學處理
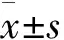
結 果
一、 分析GOLD Ⅰ~Ⅱ級與GOLD Ⅲ~Ⅳ級之間各指標有無差別
入組患者共124例,其中輕度12例,中度40例,重度48例,極重度24例,入組患者一般資料(見表1)。因輕度及極重度患者人數偏少,故將入組患者分為兩組,GOLD Ⅰ~Ⅱ級為一組,共52例。GOLD Ⅲ~Ⅳ級為一組,共72例。其中,性別、年齡、病齡、吸煙指數、體重指數在兩組之間差異無統計學意義(P>0.05)。IL-10在兩組之間差異有顯著統計學意義(P<0.01)(見表2)。制定ROC曲線,評估IL-10診斷GOLD Ⅲ~Ⅳ級的價值,結果顯示曲線下面積為0.224,故認為IL-10對重度及極重度慢阻肺患者診斷效能欠佳。

表1 入組慢阻肺患者的基本情況

表2 GOLD Ⅰ~Ⅱ級與GOLD Ⅲ~Ⅳ級之間各指標的比較
二、 IL-10與肺通氣功能指標之間的相關性分析
將IL-10與FEV1/FVC、FEV1%pred、FVC%pred進行相關性分析,結果顯示IL-10與FEV1/FVC(r=0.490,P<0.001)、FEV1%pred(r=0.601,P<0.001)、FVC%pred(r=0.392,P<0.001)均呈正相關,進行線性回歸分析,提示FEV1%pred與IL-10具有線性關聯(r=0.062,P<0.001)(見表3)。

表3 血清IL-10與各指標之間的相關性
三、IL-10與小氣道功能之間的關系
將IL-10與FEF50%pred,FEF75%pred,MMEF%pred進行相關性分析,結果提示IL-10與FEF50%pred(r=0.337,P<0.001)、FEF75%pred(r=0.439,P<0.001)、MMEF%pred(r=0.384,P<0.001)均呈正相關,進行線性回歸分析,提示FEF75%pred與IL-10具有線性關聯(r=0.081,P=0.011)(見表3)。
四、 IL-10與彌散功能之間的關系
根據DLCO%pred,彌散功能共分為4組,正常組19例,輕度減低組34例,中度減低組34例,重度減低組37例,組間比較IL-10無明顯差別(P>0.05)。
討 論
慢阻肺的發生和發展與炎癥反應的溢出效應相關[2],IL-10作為一種重要的抗炎因子,主要由輔助性T細胞分泌,其主要作用在于阻止炎癥細胞的激活、抑制T細胞的增殖、限制T細胞的反應,從而保護組織的完整性[12-13]。
本研究借鑒了我國學者關于健康體檢者IL-10的相關研究,胡靜菊納入43例健康體檢者,其血清IL-10水平為(29.53±10.06) pg/mL[14],明顯大于本研究慢阻肺患者IL-10的水平,說明慢阻肺存在炎癥紊亂的狀態。且本研究結果發現,與GOLD Ⅰ~Ⅱ級慢阻肺患者相比,GOLD Ⅲ~Ⅳ級患者的血清IL-10濃度較低。一項納入51例慢阻肺患者的研究表明,GOLD Ⅲ級患者與GOLD Ⅰ~Ⅱ級患者相比,IL-10水平較低,重度慢阻肺患者可表現出受損的炎癥狀態[7],我國學者阮國虎[15]也得出了類似的結論,這都與本研究結果一致。但本研究在評估IL-10對GOLD Ⅲ~Ⅳ級慢阻肺患者的診斷效能時,卻發現診斷效能太低,這可能需要在大樣本中進一步去評估。在考慮整個樣本,而不按肺功能嚴重程度進行劃分時,我們的研究發現,IL-10與FEV1/FVC、FEV1%pred、FVC%pred均呈正相關。提示IL-10水平的增高可能作為一種保護因素,延緩慢阻肺的進展。而IL-10水平越低,其抗炎特性越弱,無法很好的限制肺部持續或過度的炎癥反應,從而導致肺功能的惡化。
小氣道功能障礙被認為是慢阻肺的早期病理特征,在尚未出現氣流限制時,許多患者的小氣道功能已然受損[16-17]。對小氣道功能的測定可提前預測是否有患慢阻肺的高危風險,或者早期診斷慢阻肺。一項納入50 479例患者的肺功能檢查報告顯示,46.9%的患者有小氣道功能障礙,且吸煙使小氣道發生損傷的風險增加,在男性患者中,吸煙量與小氣道損傷的程度存在劑量反應關系[18]。本研究也發現了IL-10與吸煙指數呈負相關。即吸煙可能通過增加肺部炎癥反應,降低IL-10含量,從而損傷小氣道。FEF50%pred、FEF75%pred、MMEF%pred被認為是反映小氣道功能的指標[19]。本研究中,血清IL-10與上述三個指標呈正相關,提示IL-10水平升高,小氣道阻塞程度相應降低,進一步說明IL-10在小氣道功能上的保護作用。
肺泡彌散功能是指肺泡內的氣體分子通過肺泡壁—毛細血管膜進行氣體交換的功能,臨床常使用DLCO來表示,絕大多數慢阻肺患者的彌散功能均會出現一定程度的降低[20-21]。在理論上,慢阻肺患者彌散功能的降低也無法離開炎癥因子的作用。但經過文獻檢索,發現關于IL-10與肺彌散功能之間的研究,多圍繞的是間質性肺病。Rolla等發現,在系統性硬化癥性間質性肺病患者中,肺彌散功能與血清IL-10呈負相關[22]。在不同程度的肺彌散功能之間,本研究并未發現IL-10存在差別。可能是因為研究患者較少,并且一些極重度慢阻肺患者,無法很好的配合彌散功能的檢查,這同樣會導致陰性結果。
在治療方面,一項毒理學研究發現,IL-10的靶向治療減少了骨關節炎動物模型的疼痛,且沒有相關的副作用[4]。另有動物實驗研究表明,聚乙二醇化IL-10有抗腫瘤免疫和抑制腫瘤相關炎癥的能力[23]。IL-10可能在慢阻肺患者中也有治療作用,因為它抑制促炎趨化因子和蛋白酶,這些因子可能會破壞肺彈性蛋白,影響預后[7]。那么IL-10未來是否能應用于臨床,治療包括慢阻肺在內的慢性炎癥性疾病及自身免疫性疾病、腫瘤性疾病等,仍值得繼續研究。
本研究的缺陷在于:納入研究患者較少,且未設置急性加重組,應進一步對比血清IL-10在慢阻肺穩定期患者及急性加重組的差別。且此研究僅為橫斷面研究,應對入組患者進行隨訪,評估不同IL-10水平患者的預后。
綜上所述,血清IL-10作為一種抗炎因子,與慢阻肺的嚴重程度相關。且肺通氣功能及小氣道功能與IL-10呈正相關,提示IL-10對氣道具有保護作用。我們認為,未來增加對IL-10的研究,可進一步了解慢阻肺的發病機制、尋求一種新的代表慢阻肺嚴重程度的生物標志物,也可能會對包括慢阻肺在內的慢性炎癥性疾病開發新的治療方案。

