電針風池穴對頸肌慢性損傷大鼠肌衛星細胞及TLR4/MyD88/NF-κB信號通路的影響
黃于婷,陳佳彥,闞 宇,方燕平,王金偉,鄭林遙,景向紅,廖 軍*
1 福建中醫藥大學針灸學院,福建 福州 350122;
2 四川省衛生康復職業學院,四川 自貢 643000;
3 中國中醫科學院針灸研究所,北京 100700
慢性肌肉損傷作為頸椎病發病的首要常見原因,在頸椎病的發病過程中其發病率高達50%~70%,長期低頭伏案工作人群發病率更高,給社會帶來了沉重的醫療和經濟負擔[1]。肌衛星細胞(muscle satellite cells,MSC)作為成體專能干細胞,擁有較強的自我更新以及增殖分化能力,能夠在肌肉損傷時,在生肌決定因子(myogenic determine factor,MyoD)的作用下,從靜息狀態進入細胞周期,進行大規模的細胞分裂和增殖,達到促進骨骼肌的損傷與修復的功能[2-4]。增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)作為細胞增殖的標記蛋白,能反映肌衛星細胞的增殖活性[5]。骨骼肌損傷后,機體立即發生一種自我的保護機制,其首發癥狀即是炎癥反應。炎癥反應可以清除壞死組織,釋放肌肉生長因子以及相關的促炎細胞因子,從而達到促進肌纖維細胞再生的功能。基礎實驗研究發現,有許多炎癥細胞及因子參與頸型頸椎病的損傷與修復過程[6]。Toll 樣受體(toll-like receptors,TLRs)被證實可介導組織免疫炎性反應過程。Toll 樣受體-4(toll-like receptor 4,TLR4)可以啟動髓樣分化因子88(myeloid differentiation primary response gene 88,MyD88)所介導的信號通路。炎性細胞生物因子主要通過MyD88的依賴性途徑介導而起作用,當TLRs的細胞外區段識別到相對應的特異配體之后,引起特異的TIR 結構域出現改變,結合MyD88 的羧基端并互相作用。MyD88活化后可誘使核轉錄因子-κB(nuclear factor-kappa B,NF-κB)激活,NF-κB 信號通路中的關鍵節點NF-κBp65 與相關炎癥因子的表達密切相關,可促進炎性信號及趨化因子釋放,并招募炎性反應細胞到病灶局部,介導局部免疫炎性反應[7-8]。因此推測,TLR4/MyD88/NF-κB 可能參與骨骼肌細胞損傷修復的發生、發展過程。
本實驗擬通過電針干預頸肌慢性損傷大鼠模型,探討電針對肌細胞損傷修復中肌衛星細胞的影響,并對其與TLR4/MyD88/NF-κB信號通路的相關性進行研究,探討肌衛星細胞的增殖分化與炎癥因子的相關性,闡釋電針修復頸肌慢性損傷的可能機制。
1 實驗材料
1.1 實驗動物
1月齡SPF級雄性Wistar大鼠45只,體質量80~120 g,由福建中醫藥大學動物實驗中心提供[實驗動物生產許可證號:SYXK(閩)2018-001]。飼養于福建中醫藥大學動物實驗中心,溫度22~25 ℃,濕度45%~65%,12 h/12 h明暗周期,自由飲水。本實驗操作嚴格遵守中華人民共和國科學技術部2006年頒布的《關于善待實驗動物的指導性意見》相關規定,并通過福建中醫藥大學動物倫理委員會審批(審批號:2021040)。
1.2 主要試劑
多聚甲醛(Sigma-alorich),枸椽酸緩沖液、DAB(美國Boster 公司);Bax、Bcl-2、Caspase-3、Caspase-9 免疫組織化學SP 試劑盒(美國Bio-Rad 公司);免疫組織化學一抗、細胞凋亡檢測試劑盒(美國Boster公司);免疫印跡一抗(美國Bio-Rad公司)。
1.3 主要儀器
HANS-100 韓式穴位神經刺激儀(石家莊福賽醫巧器械有限公司);YB-6LF 石蠟包埋機(亞光醫用有限公司);RM2235 切片機(德國徠卡儀器有限公司);YS2-H光學顯微鏡(上海普赫光電科技有限公司);15 mm×0.3 mm 針刺針(蘇州醫療器械廠);JEM-1230電子顯微鏡(日本電子株式會社);M-Turbo便攜式彩色超聲診斷儀(美國索諾聲公司);RM6240型多道生理信號采集處理系統(成都儀器廠)。
2 實驗方法
2.1 實驗分組及模型制備
將45 只實驗大鼠適應性喂養1 周后,按照隨機數字表法選取10 只作為空白組,其余35 只大鼠按照劉志華等[9]制備頸肌慢性損傷模型方法改良后進行造模,具體方法為:根據人類頸型頸椎病常見的發病方式,復制大鼠頸肌慢性損傷動物模型。向大鼠頸部C3~C5間注射3%高滲鹽水1 mL;次日再次注射1 mL;第2天采用頸部低頭法,采用自制固定器,將大鼠放入并固定頸椎后,使大鼠保持低頭位30°,確定不影響其他部位的活動,并使呼吸道保持通暢。每次使用固定架固定大鼠保持頸前屈5 h,每天1 次,反復3 個月。同時每隔5 d 在頸部C3~C5注射1 次3%高滲鹽水。3 個月后,用超聲診斷儀對大鼠頸后肌組織行超聲診斷檢測,觀察大鼠頸后肌的形態學變化,以驗證模型是否成功。模型大鼠可見頸后肌組織斷續,排列紊亂,肌組織邊界模糊,回聲欠均勻。之后將復制成功的模型大鼠按照隨機數字表法分為模型組、電針組、美洛昔康組,每組10 只(其中5 只大鼠經超聲診斷儀檢測提示模型復制不成功,故剔除)。
2.2 實驗動物干預方法
造模成功后電針組大鼠選用雙側風池穴進行電針干預治療。先用自制固定器固定好大鼠,再根據李忠仁主編的《實驗針灸學(新世紀第2版)》結合比較解剖學方法選取風池穴(雙側),風池穴的針刺深度為3 mm,抵骨面,之后連接韓氏穴位神經刺激儀,刺激參數采用疏密波,電流為1 mA,頻率為2/100 Hz[10]。治療時間:每次25 min,每天1 次,連續干預10 d 為1 個療程,每個療程間隔2 d,共干預2個療程。模型組造模后僅抓握固定而不予針刺。美洛昔康組按照大鼠體質量選取定量的美洛昔康溶液灌胃。每周1次測量體質量調整灌胃劑量,灌胃劑量根據體表面積比率計算為0.787 8 mg/kg。模型組和美洛昔康組的治療療程、次數、時間與間隔時間,均與電針組相同。
2.3 觀察指標及檢測方法
2.3.1 超聲診斷儀檢測 造模3 個月后,對模型大鼠進行超聲診斷檢測,目的是判斷造模是否成功。以大鼠頸后肌為檢查體位,選擇造模部位、肌肉結節處,利用高頻超聲探頭進行多方位、多位置掃描檢查,并與空白組大鼠相同部位比較。觀察頸后肌肌肉情況,并明確造模損傷范圍與位置,觀察其內部回聲信號分布情況。
2.3.2 肌電生理檢測 經超聲檢測后,對模型組大鼠頸后肌行肌電生理檢測。大鼠麻醉后固定姿勢,充分暴露頸后肌,在頸后肌結節處放置正、負電極,兩針相距1~2 cm,在大鼠尾部放置地極,使用5 mA電流刺激大鼠,產生誘發電位,最后在電生理記錄儀上連續5 s 記錄大鼠誘發電位M 波的肌電電位和振幅的衰減變化程度。
2.3.3 取材 電生理檢測結束后,準備取材。使用20%的烏拉坦行腹腔麻醉,確認大鼠完全麻醉后,保持大鼠的背部朝上并完全暴露頭部和頸部。采用鈍性分離的方式找到右側頸后肌,用手術剪將其剪下,操作時注意保證肌肉組織的完整性。用PBS液體清洗頸后肌,剔除筋膜及其他雜質,僅保留完整的肌肉組織。將組織置于4%多聚甲醛中放置24 h,備用。
2.3.4 透射電鏡 肌肉組織纖維塊在2.5%戊二醛溶液固定24 h 后,取出組織塊,使用四氧化鋨固定1.5 h,逐級乙醇脫水,放置在醋酸異戊酯中儲存直至過夜,置于純丙酮與包埋液的比例為2∶1 的溶液中3 h后取出,改成放置于純丙酮以及包埋液的比例為1∶2 的溶液中過夜;環氧樹脂包埋液中定向包埋,半薄切片,用2%乙酸雙氧鈾以及2%檸檬酸鉛染色切片定位后,使用透射電鏡技術拍攝組織圖片,仔細觀察并分析樣本的頸后肌的超微結構變化。
2.3.5 免疫組織化學檢測 對存放于4%多聚甲醛中的肌肉組織依次進行脫水、浸蠟、包埋、切片、烘片、烤片、脫蠟至水等步驟;枸櫞酸修復液中微波修復;用0.01 mol/L PBS 漂洗,在切片上滴加適量3%H2O2,使用微波震蕩10 min后,血清封閉液封閉0.5 h;滴加一抗稀釋液稀釋抗體,放置在4 ℃冰箱中孵育過夜;PBS 漂洗,滴入二抗,孵育60 min;滴加HRP,37 ℃孵育2 h;DAB顯色8 min;顯微鏡下進行觀察染色程度;使用蘇木素復染,逐級濃度酒精依次脫水后使用二甲苯二次透明;隨后進行封片和鏡檢;每組切片中隨機選擇5個不同的視野,拍照后,經圖像分析最后處理數據,統計大鼠頸后肌中PCNA、MyoD、TLR4、MyD88、NF-κBp65的蛋白表達量。
2.4 統計學方法
使用SPSS 25.0 軟件進行統計分析。符合正態分布的計量資料以(±s)表示,組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。以P<0.05為差異有統計學意義。
3 結 果
3.1 大鼠頸后肌超聲診斷檢測
造模3 個月后,空白組大鼠頸后肌組織形態規則,邊界清楚,回聲均勻;模型組大鼠頸后肌組織斷續,排列紊亂,且邊界較模糊,回聲欠均勻,與空白組相比,模型組頸后肌厚度明顯變薄,表明大鼠頸肌慢性損傷模型復制成功,見圖1。其中40 只造模成功,5只造模未成功。
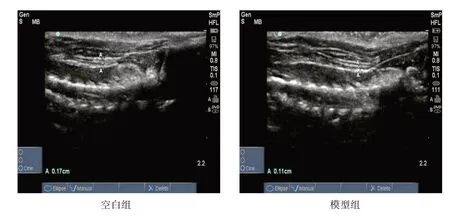
圖1 大鼠頸后肌超聲檢測結果Figure 1 Results of ultrasonic examination on posterior cervical muscle of rats
3.2 肌電生理檢測
與空白組比較,模型組肌電波幅及頻率明顯發生衰減,可見誘發波M 波、無潛伏期及H 波,說明慢性頸肌損傷大鼠肌肉損傷導致肌肉電傳導功能降低。見圖2。

圖2 大鼠頸后肌肌電檢測結果Figure 2 Results of EMG test on posterior cervical muscle of rats
3.3 4組大鼠頸后肌電鏡檢測結果比較
空白組肌絲的橫截面以點狀分布為主,肌節和肌漿膜無破裂,肌原纖維結構排列緊密,核膜光滑,線粒體結構無異常且分布均勻,嵴無斷裂。模型組可見單個的肌原纖維結構的排列不連續,細胞中線粒體出現腫脹現象,并且肌原纖維整體排列紊亂,肌纖維和肌節之間斷裂,并有空泡現象,但其肌間隙基本接近正常。電針組肌原纖維可見清晰的紋理,且肌絲的橫斷面呈點狀分布,肌節和肌漿膜完整,個別線粒體腫脹,少量與肌原纖維的斷裂處有空泡。美洛昔康組肌原纖維的結構偶見不規則且細胞排列混亂,出現少量的線粒體腫脹,其中在肌原纖維的斷裂處有空泡存在。見圖3。

圖3 4組頸后肌電鏡檢測結果比較(×50 000)Figure 3 Comparison of electron microscopy results in posterior cervical muscle of four groups (×50 000)
3.4 免疫組織化學檢測結果分析
3.4.1 4組大鼠頸后肌PCNA、MyoD 表達比較 4組大鼠頸后肌組織中均出現肌纖維細胞中PCNA、MyoD蛋白的陽性表達。空白組中PCNA、MyoD的表達量較少,呈散在分布,數量較少。模型組中PCNA、MyoD 的表達呈現弱陽性,分布集中、數量多、排列密集、染色較深。在電針組和美洛昔康組大鼠中的PCNA、MyoD 呈陽性表達,細胞排列較緊密、數量多、核染色深。與空白組相比,模型組PCNA、MyoD的陽性細胞數增多,差異具有統計學意義(P<0.05);與模型組相比,電針組和美洛昔康組肌肉組織中PCNA、MyoD 的陽性表達細胞明顯增多,差異具有統計學意義(P<0.05)。見圖4和圖5。

圖4 4組大鼠頸后肌PCNA表達比較(×200)Figure 4 Comparison of PCNA expression in posterior cervical muscle of four groups (×200)
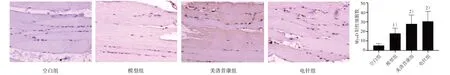
圖5 4組大鼠頸后肌MyoD表達比較(×200)Figure 5 Comparison of MyoD expression in the posterior cervical muscle of four groups (×200)
3.4.2 大鼠頸后肌中TLR4、MyD88、NF-κBp65陽性表達分析 4 組大鼠頸后肌組織中均檢測到TLR4、MyD88、NF-κBp65陽性表達。模型組中TLR4、MyD88、NF-κBp65 的表達呈現陽性,細胞分布集中、排列密集、數量較多、核染色較深;電針組及美洛昔康組中TLR4、MyD88、NF-κBp65 蛋白的表達呈現出弱陽性,染色細胞數量較少,排列較稀疏、染色淺。與空白組相比,模型組中TLR4、MyD88、NF-κBp65蛋白表達陽性細胞數均顯著增加,差異具有統計學意義(P<0.05);與模型組比較,電針組和美洛昔康組中的TLR4、MyD88、NF-κBp65 陽性細胞數明顯降低,差異具有統計學意義(P<0.05)。見圖6~8。
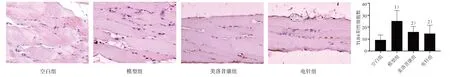
圖6 4組大鼠頸后肌TLR4表達比較(×200)Figure 6 Comparison of TLR4 expression in posterior cervical muscle of four groups (×200)
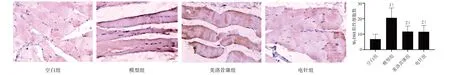
圖7 4組大鼠頸后肌MyD88 表達比較(×200)Figure 7 Comparison of MyD88 expression in posterior cervical muscle of four groups (×200)
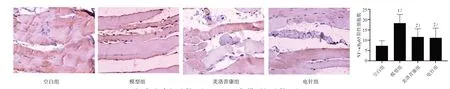
圖8 4組大鼠頸后肌NF-κBp65表達比較(×200)Figure 8 Comparison of NF-κBp65 expression in posterior cervical muscle of four groups (×200)
4 討 論
頸部肌肉慢性損傷屬于中醫學“經筋病”范疇。由于生活習慣及工作壓力的影響,頸肌慢性損傷在臨床上發病率較高。針刺在治療頸肌慢性損傷中具有十分獨特的優勢。本課題采用大鼠長期低頭位制作頸肌慢性損傷模型,符合臨床頸肌慢性損傷的發病特征。本課題選用風池穴為足少陽膽經的腧穴,位于顳額處后發際線的凹陷,是十二經脈中足少陽膽經、手少陽三焦經以及奇經八脈中陽維脈和陽蹺脈循行的交會穴。“膽可主筋所生之病”“三焦可主司氣所生之病”“陽維可主人體一身的腠理”“陽蹺可主人體一身的運動功能”,因此風池穴能夠平熄少陽上擾清竅,又能夠疏通頸部肌肉關節的氣血。本實驗中促進頸部肌肉慢性損傷的修復進程可能是通過電針“風池穴”達到舒筋通絡、調理氣血的作用。
從現代醫學角度來看,骨骼肌損傷后機體會啟動自我再生修復機制,增殖的成纖維細胞所形成的瘢痕組織能夠阻礙周圍神經對肌纖維的支配作用,造成骨骼肌電生理傳導功能障礙。因此,本課題使用超聲診斷儀檢測慢性頸肌損傷模型中頸后肌的肌肉形態、結節,用于判斷是否有瘢痕形成或肌肉形態改變;同時,使用肌電生理檢測判斷慢性頸肌損傷肌纖維的電生理傳導功能,以此來判斷慢性頸肌損傷的模型是否成功。在實驗中模型組大鼠頸后肌超聲檢測可見肌組織排列紊亂等病理性改變,肌電生理可見肌電振幅衰減,表明造模成功。本實驗研究結果表明:慢性頸部肌肉損傷模型大鼠的超聲檢測可見其肌纖維形態明顯變化,出現肌纖維結構紊亂、厚度變薄、病理性結節產生等現象。在肌電圖結果中也可以看到,模型組大鼠右側頸后肌肌電振幅明顯下降,表明慢性頸部肌肉損傷會影響骨骼肌對電生理的傳導作用。從電鏡結果中可見,模型組大鼠頸后肌肌原纖維排列較紊亂,線粒體腫脹,且有空泡現象存在,而電針能夠有效改善肌纖維情況。在電針組的肌纖維橫切面中肌原纖維可見清晰紋理,且肌絲的橫斷面呈點狀分布,肌節和肌漿膜完整,個別線粒體腫脹,其中少量與肌原纖維的斷裂處有空泡,表明電針能夠有效促進骨骼肌損傷的肌纖維修復。
骨骼肌的損傷后修復是一個完整的病理、生理過程[11],骨骼肌的再生與修復是在肌纖維損傷后各種因素的刺激及誘導下導致肌細胞產生自我修復的過程。肌衛星細胞的增殖分化是骨骼肌損傷后修復的關鍵因素。在肌衛星細胞形成肌纖維細胞的特異性基因轉錄調控過程中,MyoD 作為反映肌細胞損傷后再生的指標[12-13],屬于閥門通道,具備總開關的調節作用,可以與各種相關的基因啟動子相結合而調控肌細胞的生成,同時促進基因啟動子的轉錄與激活。PCNA 又被稱為周期蛋白,是細胞中DNA 在合成時所需要的特殊核蛋白,可以當作細胞分裂增殖過程的一種標記蛋白。檢測PCNA 在肌細胞中的蛋白表達可作為判斷肌細胞增殖的指標,反映肌衛星細胞的分裂增殖進程[5]。鄒媛等[14]通過實驗證實在股四頭肌損傷小鼠中MyoD 的表達量增加,斜刺阿是穴能夠促進MyoD 的表達,促進股四頭肌損傷的良性恢復。趙丹丹等[15]認為電針干預能夠上調大鼠腓腸肌中PCNA和配對盒基因7(paired box gene 7,Pax7)的表達,提高肌衛星細胞的增殖水平。本實驗的研究中,使用免疫組織化學法檢測頸后肌中PCNA 和MyoD 的指標,結果顯示與模型組相比,電針能夠明顯提高MyoD 和PCNA 的表達,電針組大鼠頸后肌中MyoD 和PCNA 均顯著性增加,與上述結果一致,說明電針有激活并促進肌衛星細胞分裂增殖的能力,這有可能是電針促進骨骼肌損傷修復的機制。
炎癥反應是骨骼肌損傷后的首發癥狀[16-17],炎癥反應是機體的一種自我保護機制,其目的是清除壞死組織,促進肌纖維的再生。有研究認為炎癥反應能夠誘導并激活骨骼肌衛星細胞受損后的分裂、增殖與分化過程[18]。當骨骼肌損傷后,接收到壞死肌纖維及局部血管、神經損傷的信號刺激,使炎癥細胞釋放,局部出現炎癥反應,浸潤損傷部位,吞噬并代謝壞死肌纖維,同時釋放相關的細胞生長因子激活肌衛星細胞。而肌細胞損傷的修復與TLR4/MyD88/NF-κB 信號轉導途徑的異常激活密切相關。馬芳菲等[19]在探究糖尿病患者的骨骼肌受到炎癥損傷及用藥后損傷的修復過程時,使用免疫印跡法檢測TLR4、MyD88、NF-κB的蛋白表達,實驗結果表明TLR4/MyD88/NF-κB 信號通路在骨骼肌的炎癥損傷修復中扮演著重要的作用。何堅團隊在兔頸型頸椎病模型中,使用HE 染色及免疫印跡法檢測兔頸椎病模型中頸后肌的NF-κBp65 和MyD88的蛋白含量,發現在頸型頸椎病模型中MyD88 和NF-κBp65 均呈顯著性的增加,說明在頸椎病肌肉損傷過程中存在MyD88 和NF-κBp65 的影響[6]。本實驗結果顯示,肌肉損傷后大鼠頸后肌中TLR4、MyD88 和NF-κBp65 信號因子的表達明顯增加,表明在頸肌慢性損傷中TLR4、MyD88 及NF-κBp65 信號因子處于活化狀態,給予電針刺激后,大鼠頸后肌組織中TLR4、MyD88 及NF-κBp65 蛋白在電針組的表達均有所下降,說明電針能夠抑制大鼠頸肌慢性損傷模型中TLR4/MyD88/NF-κB 信號轉導通路的活性。
電針風池穴可以改善頸肌慢性損傷模型中頸后肌的形態變化,促進頸肌慢性損傷修復,其作用機制可能是通過抑制TLR4/MyD88/NF-κB 信號轉導通路的炎癥反應,促進肌衛星細胞的增殖,進而影響損傷后骨骼肌的再生與修復。