醋酸鉛暴露對PC12細胞凋亡與自噬的影響及可能機制
張 誼,王立暉,陳月芳,李永金,柳浦青
(1.南通大學附屬丹陽醫院,江蘇省丹陽市人民醫院,江蘇 丹陽 212300;2.江蘇大學醫學院藥理學教研室,江蘇 鎮江 212013;3.浙江中醫藥大學附屬第二醫院,浙江 杭州 310005)
鉛是一種普遍存在于環境中的重金屬。長期接觸鉛可使神經系統發生不可逆損傷,導致學習和記憶功能減退[1]。在模擬阿爾茨海默病研究中,抑制神經細胞凋亡可改善大鼠行為和認知功能[2];而抑制自噬對小鼠神經元具有保護作用[3],表明神經系統損傷過程中存在細胞凋亡與自噬。
沉默信息調節因子1(sirtuin1,Sirt1)是一種脫乙酰酶,可通過激活下游底物——叉頭框蛋白轉錄因子3a(forkhead box O3a,FoxO3a)介導神經細胞的生成、凋亡與自噬[4-5]。重金屬錳暴露可導致神經細胞中Sirt1 蛋白降解,促使FoxO3a 蛋白表達上調及乙酰化水平增加,誘導細胞損傷[6]。在H2O2誘導的神經毒性反應中,阻斷Sirt1/FoxO3a 信號途徑可抑制細胞促凋亡蛋白和自噬蛋白的表達,減輕神經細胞損傷[7],表明Sirt1/FoxO3a 信號通路參與了細胞凋亡和自噬。本實驗室前期研究發現,神經細胞的損傷伴隨氧化應激與細胞凋亡[8],但目前仍不清楚鉛暴露是否可誘導神經細胞自噬。
本研究選用大鼠腎上腺嗜鉻細胞瘤PC12 細胞作為實驗對象,建立醋酸鉛〔Pb(Ac)2〕暴露細胞模型,探討鉛暴露對PC12 細胞凋亡與自噬的作用及其與Sirt1/FoxO3a信號通路之間的關系,為研究及預防鉛神經毒性相關性疾病提供實驗支持與理論依據。
1 材料與方法
1.1 細胞、試劑和儀器
大鼠腎上腺嗜鉻細胞瘤PC12 細胞株,中國科學院上海細胞庫。DMEM 培養基、胰蛋白酶、單丹磺酰尸胺(monodansylcadaverine,MDC)試劑盒,美國Gibco公司;新生牛血清,杭州四季青生物工程材料有限公司;Pb(Ac)2,美國Sigma 公司;MTT,美國Amresco 公司;乳酸脫氫酶(lactate dehydrogenase,LDH)試劑盒,碧云天生物技術研究所;吖啶橙/溴化乙錠(acridine orange/ethidium bromide,AO/EB)試劑盒,北京Solarbio 公司;Annexin V/PI凋亡檢測試劑盒,美國Molecular Probes 公司。兔抗人Sirt1、FoxO3a、叉頭蛋白M1(forkhead box protein M1,FoxM1)和P62 蛋白多克隆抗體,美國ImmunoWay 公司;兔抗大鼠Bcl-2 相互作用蛋白1(Bcl-2 interacting coiled-coil protein 1,Beclin1)多克隆抗體,武漢ABclonal 公司;兔抗小鼠微管相關蛋白1 輕鏈3(microtubule-associated protein 1 light chain 3,LC3)多克隆抗體,美國Proteintech公司;小鼠抗人GAPDH 單克隆抗體、山羊抗兔IgG二抗、山羊抗鼠IgG 二抗,美國GeneTex 公司;顯影劑,美國Millipore 公司。其余試劑均為市售國產分析純。
SW-CJ-2G 型超凈臺,蘇州凈化設備總廠;CO2細胞培養箱,上海Heal Force 公司;CKX53 型倒置顯微鏡,日本Olympus 公司;UPK-I-10T 型超純水機,成都超純科技有限公司;CP124S型電子分析天平,德國賽多利斯公司;680型酶標儀和1658001 型電泳儀,美國Bio-Rad公司;凝膠成像系統,南京麥高德生物科技公司;X1R 型冷凍離心機,美國Thermo Fisher 公司;Axio Scope A1 型熒光顯微鏡,德國Carl Zeiss公司;2400F超聲波粉碎機,新芝生物科技公司;FACS CantoⅡ型流式細胞儀,美國BD公司。
1.2 細胞培養和分組處理
PC12 細胞置高糖DMEM 培養基中,置于含5%的CO2和95%空氣的37 ℃培養箱中孵育,取對數生長期細胞進行實驗。細胞分為細胞對照組(空白培養基)和Pb(Ac)2100,200 和400 μmol·L-1組,給予Pb(Ac)2暴露24 h后,收集細胞進行實驗。
1.3 MTT 法和比色法檢測細胞存活率和細胞外液LDH含量
取對數生長期的PC12 細胞接種于96 孔板中,按1.2 分組處理后,棄去上清,每孔加入10 μL MTT 0.5 g·L-1,于37 ℃繼續培養4 h 后棄去培養液,加入100 μL DMSO,振勻后于490 nm 處測定各孔吸光度(A490nm)值。細胞存活率(%)=(1-處理組A490nm/細胞對照組A490nm)×100%。
按照試劑盒說明書進行操作,收集1.2 分組細胞上清液,在波長450 nm 處檢測各孔吸光度(A450nm)值,計算各組LDH含量。
1.4 AO/EB染色觀察細胞凋亡
取對數生長期PC12 細胞接種于6 孔板中,按1.2 分組處理后,棄培養液并用PBS 洗滌2 次,在各孔加入2 mL 按比例配制好的AO/EB 混合染液,4 ℃避光反應10 min,將6 孔板置于熒光顯微鏡下,每組隨機挑選10 個視野,觀察各組細胞染色情況,核染色質呈橙紅色熒光的為凋亡細胞。
1.5 流式細胞儀檢測細胞凋亡率
取1.2 分組處理的細胞,用預冷的PBS 洗2 遍后加入400 μL 緩沖液,輕輕混勻細胞,再加入5 μL Annexin V-FITC 和5 μL PI 溶液,避光孵育15 min,用流式細胞儀檢測細胞凋亡率。
1.6 MDC染色法觀察細胞自噬
取對數生長期PC12 細胞接種于裝有玻璃片的6 孔板中,按1.2 分組處理后,棄去培養基,用PBS洗滌,加入MDC 染料室溫避光染色30 min。吸去染料后,加入4%多聚甲醛固定10 min,待玻璃片晾干后置于熒光顯微鏡下觀察。自噬細胞出現綠色自噬空泡,以綠色熒光強度表示細胞自噬程度。
1.7 免疫熒光法檢測細胞內Beclin1的表達
取1.2收集的細胞,用0.3% Triton X-100透化,羊血清封閉后,滴加抗Beclin-1 抗體(1∶300),4 ℃搖床反應過夜;用PBS 洗滌后加入山羊抗兔IgG二抗(1∶600),37 ℃避光反應1 h,甘油封片后置熒光顯微鏡下觀察。當細胞自噬時,Beclin1蛋白呈點狀聚集,以熒光強度反映Beclin1的表達水平。
1.8 Western 印跡法檢測細胞Sirt1,FoxO3a,FoxM1,Beclin1,LC3和P62蛋白表達水平
取1.2 收集的細胞,加入裂解液裂解提取總蛋白,并用試劑盒測定蛋白濃度。總蛋白經電泳分離并轉印至PVDF膜上,用脫脂奶粉封閉,繼而與一抗(Sirt1,FoxO3a,FoxM1,Beclin1,LC3 和P62 均1∶1000;GAPDH,1∶7000)于4 ℃搖床反應過夜。洗滌數次后,將膜和相應山羊抗兔、山羊抗鼠IgG二抗(1∶5000)在室溫下反應1 h,加入顯影劑,在凝膠成像系統上進行掃描并拍照,Image J 軟件分析各條帶積分吸光度值。以目標蛋白與GAPDH 的積分吸光度值比值表示目標蛋白的相對表達量,LC3-Ⅱ與LC3-Ⅰ蛋白表達比值表示細胞自噬水平。
1.9 統計學分析
2 結果
2.1 Pb(Ac)2對PC12 細胞存活率和細胞外液LDH含量的影響
MTT 法檢測結果如圖1A所示,與細胞對照組相比,處理24 h 后,Pb(Ac)2100,200 和400 μmol·L-1組PC12 細胞存活率均顯著降低(P<0.05,P<0.01)。如圖1B所示,Pb(Ac)2可引起PC12細胞外液LDH 含量增加。與細胞對照組相比,Pb(Ac)2100,200 和400 μmol·L-1組細胞外液LDH 含量均顯著增加(P<0.05,P<0.01),表明Pb(Ac)2誘導PC12細胞損傷。
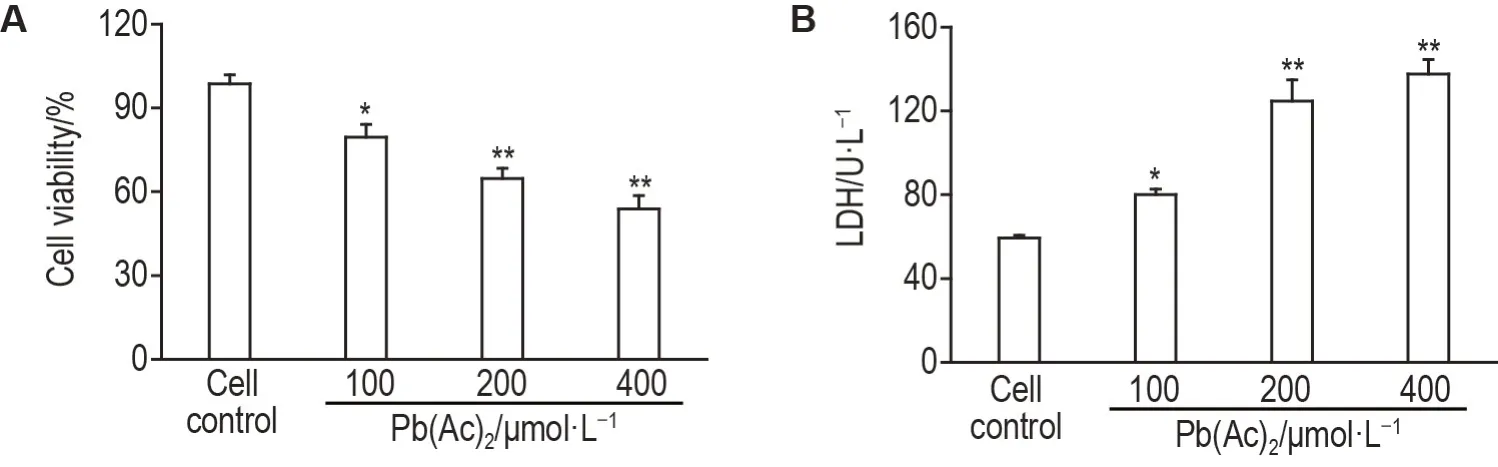
Fig.1 Effect of lead acetate(Pb(Ac)2)on cell viability(A)and lactate dehydrogenase(LDH)content(B)in extracellular fluid of PC12 cells by MTT and colorimetry. After exposure to Pb(Ac)2 0(cell control),100,200 and 400 μmol·L-1 at 37 ℃for 24 h,cell viability and LDH content in extracellular fluid were determined. Cell viability(%)=(1-A490 nm of treatment group/A490 nm of cell control group)×100%.±s,n=5.*P<0.05,**P<0.01,compared with cell control group.
2.2 Pb(Ac)2對PC12細胞凋亡的影響
PC12 細胞經Pb(Ac)2處理24 h 后經AO/EB雙染色,凋亡的細胞表現出AO/EB 染色雙陽性,熒光疊加后呈現出均勻一致的橙紅色圓形;而對照組細胞AO 染色均勻,且幾乎無EB 染色陽性,表明無明顯凋亡(圖2)。
流式檢測結果如圖3 所示,與細胞對照組相比,Pb(Ac)2100,200 和400 μmol·L-1組細胞凋亡率均顯著升高(P<0.01),表明Pb(Ac)2可誘導PC12細胞凋亡。
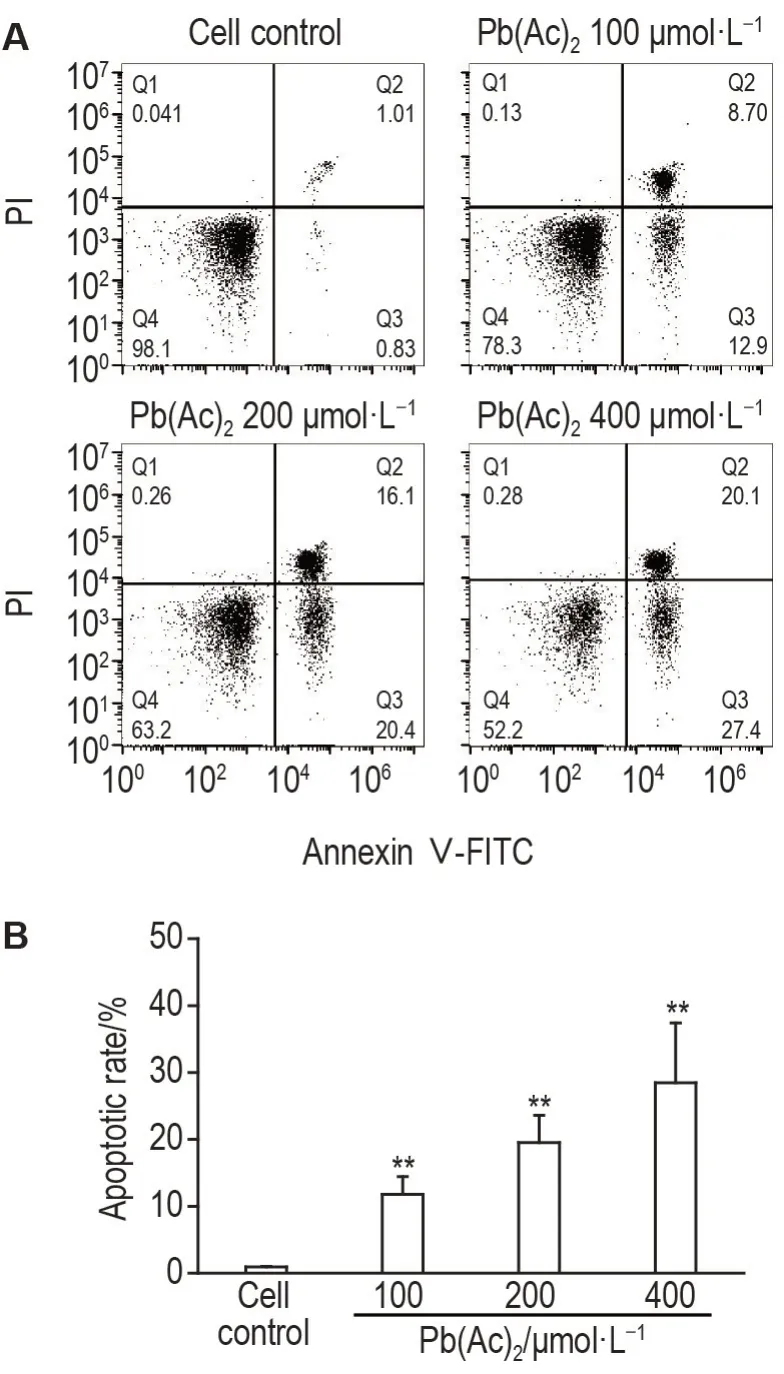
Fig.3 Effect of Pb(Ac)2 on apoptotic rate of PC12 cells detected by flow cytometry. See Fig.1 for the cell treatment. B was the quantitative result of A. ±s,n=3.**P<0.01,compared with cell control group.
2.3 Pb(Ac)2對PC12細胞自噬的影響
如圖4A 所示,細胞對照組細胞幾乎未見熒光和自噬泡,Pb(Ac)2100 μmol·L-1組細胞內熒光雖弱但自噬泡已開始出現,Pb(Ac)2200 μmol·L-1組MDC點狀熒光信號顯著增強,Pb(Ac)2400 μmol·L-1組細胞周圍呈強烈綠色熒光,提示細胞內出現大量自噬空泡。定量結果(圖4B)表明,與細胞對照組相比,Pb(Ac)2各濃度組熒光強度顯著增強(P<0.01),表明Pb(Ac)2染毒后PC12細胞自噬增強。
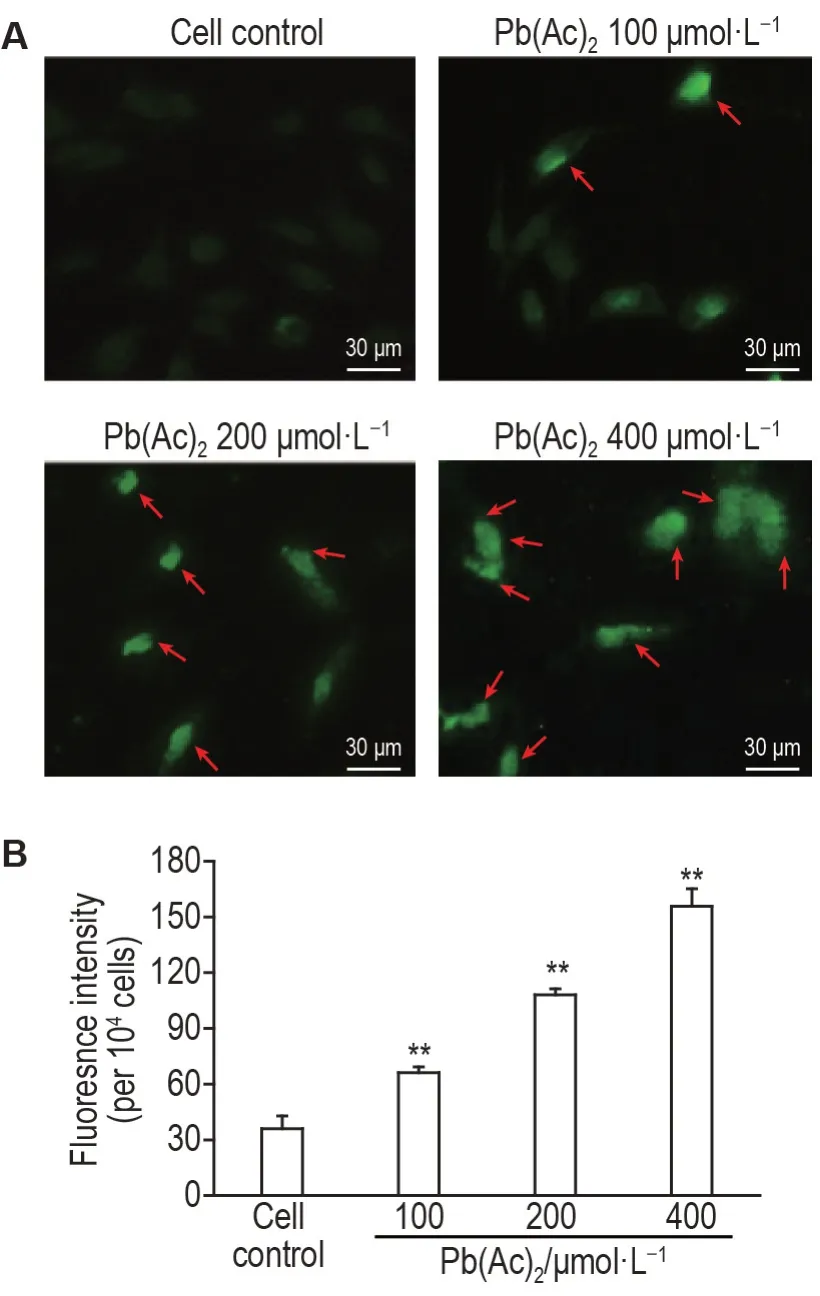
Fig.4 Effect of Pb(Ac)2 on autophagy of PC12 cells determined by monodansylcadaverine staining. See Fig.1 for the cell treatment. B was the quantitative result of A. ±s,n=3. **P<0.01,compared with cell control group. The arrows indicate autophagic bubbles.
2.4 Pb(Ac)2對PC12細胞Beclin1定位的影響
圖5所示,細胞對照組Beclin1在細胞質微弱表達,Pb(Ac)2200 μmol·L-1組細胞細胞質中Beclin1表達明顯增強,Pb(Ac)2400 μmol·L-1組細胞質內Beclin1 呈現大量點狀聚集且熒光強度加強。表明細胞發生了明顯自噬,細胞內自噬體數量增多。
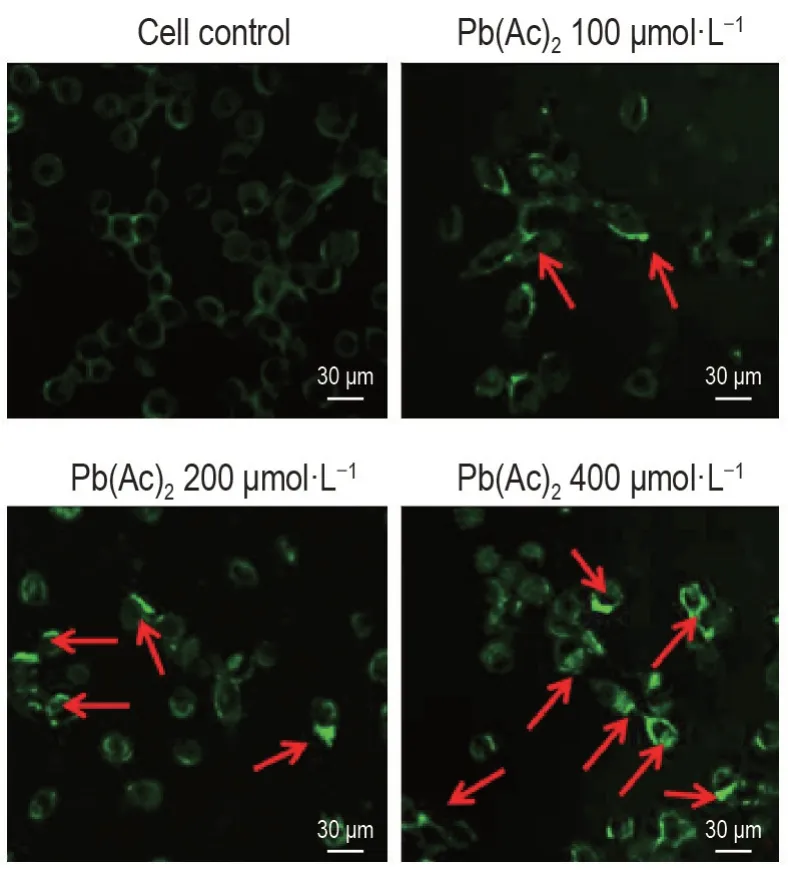
Fig.5 Effect of Pb(Ac)2 on nucleic accumulation of Bcl-2 interacting coiled-coil protein(Beclin1)in the PC12 cells by immunofluorescence. See Fig.1 for the cell treatment. Arrows show the representative Beclin1 accumulation.
2.5 Pb(Ac)2對細胞自噬相關蛋白Sirt1,FoxO3a,FoxM1,Beclin1,LC3和P62表達的影響
Western 印跡法結果(圖6)顯示,與細胞對照組相比,Pb(Ac)2100,200 和400 μmol·L-1組細胞內Sirt1(P<0.01)和FoxO3a蛋白(P<0.05,P<0.01)表達明顯上調,同時自噬相關蛋白Beclin1 蛋白表達(P<0.05,P<0.01)和LC3-Ⅱ/LC3-Ⅰ比值(P<0.01)也明顯增加,P62 蛋白表達降低(P<0.05,P<0.01);Pb(Ac)2200 和400 μmol·L-1組細胞FoxM1蛋白表達顯著降低(P<0.05,P<0.01)。
3 討論
本研究采用Pb(Ac)2暴露誘導PC12 細胞損傷模型,發現Pb(Ac)2可顯著誘導細胞凋亡,且細胞內自噬程度明顯增加,自噬相關蛋白表達顯著增多,提示細胞自噬參與了Pb(Ac)2誘導的細胞凋亡過程。
自噬是一種細胞程序性死亡的機制,常由多種應激反應引起。大量研究表明,抑制細胞自噬可減少神經細胞的死亡,反之可促進細胞死亡[9-11]。本研究中,隨著Pb(Ac)2濃度的增加,PC12 細胞內自噬泡增多,且Beclin1在PC12 細胞中的熒光強度明顯增強,表明Pb(Ac)2促進PC12 細胞發生自噬。Beclin1,LC3 和P62 都是細胞自噬的重要標志物。其中,Beclin1 水平和LC3-Ⅱ/LC3-Ⅰ比值與自噬呈正相關,P62 蛋白表達水平與細胞自噬呈負相關[12-14]。本研究通過Western印記法檢測Beclin1,LC3 和P62 蛋白的表達,發現Pb(Ac)2暴露誘導PC12 細胞自噬相關蛋白Beclin1 表達和LC3-Ⅱ/LC3-Ⅰ比值升高,P62蛋白表達降低,進一步證實細胞發生了自噬。
細胞自噬與凋亡之間存在交聯,但兩者的互作關系尚不明確[15]。有研究發現,抑制新生大鼠神經元自噬后,腦神經元凋亡增加[16];另有研究發現,抑制大鼠海馬體中神經元自噬后,大鼠腦損傷及神經元凋亡率明顯降低[17],表明細胞自噬與凋亡參與了細胞的死亡過程。本實驗室前期研究也發現,用熒光染料Hoechst33342 對Pb(Ac)2處理的PC12 細胞染色后,顯微鏡下可觀察到細胞核明顯皺縮且藍色熒光增強[18],提示細胞出現了凋亡。本研究中,用AO/EB 染色后,隨Pb(Ac)2濃度增加,細胞橙色熒光增強,綠色熒光逐漸減弱,表明細胞損傷中發生自噬的同時伴有細胞凋亡,同時,流式細胞檢測結果表明,Pb(Ac)2可誘導細胞發生明顯凋亡,與之前實驗結果相一致。
Sirt1 在調節血管穩態、細胞自噬和凋亡中發揮重要作用[4]。FoxO3a是Sirt1 的下游靶基因,Sirt1可通過去乙酰化調節FoxO3a 的表達,參與調控細胞氧化應激、凋亡和增殖等過程[19]。而FoxM1 是FoxO3a 的下游基因,也是FoxO3a 的直接轉錄靶點,但關于FoxO3a 和FoxM1 的表達相關性報道不一[20-21]。本研究中,不同濃度Pb(Ac)2作用細胞后,可使細胞內Sirt1 和FoxO3a 蛋白表達明顯上調,而FoxM1 表達下調,表明在PC12 細胞損傷的過程中可能有Sirt1/FoxO3a相關信號通路的參與,并存在FoxO3a負向調節下游效應基因FoxM1的可能。
綜上所述,本研究發現Pb(Ac)2可顯著誘導PC12細胞損傷,且細胞自噬及Sirt1/FoxO3a信號通路可能參與該損傷過程。在后續研究中,將使用自噬抑制劑加以干預,進一步證實細胞凋亡和自噬及Sirt1/FoxO3a信號通路在鉛誘導PC12細胞損傷中確切機制。

