基于CiteSpace的國內缺血性腦卒中程序性細胞死亡研究的可視化分析
陳 蕾,李子瀅,秦莉花
缺血性腦卒中是由于血液供應不足導致腦組織功能短暫性或永久性喪失,并引發一連串事件,如電功能喪失、鈣內流導致膜功能紊亂、致使鈣依賴性興奮性毒性、活性氧物質的產生,最終導致細胞膜破壞和細胞裂解[1]。缺血性腦卒中約占我國腦卒中的69.6%,病人死亡、殘疾率高達33.3%[2]。缺血性腦卒中是國家實施“健康中國”行動中防控的四大重大慢性病之一,國務院實施健康中國行動意見中指出,要防控重大疾病,降低心腦血管疾病死亡率。缺血性腦卒中后損傷涉及多種機制,如炎癥反應、氧化應激、線粒體損傷、蛋白質錯誤折疊等,這些機制依賴損傷和修復途徑之間的平衡,若損傷大于修復,引發程序性細胞死亡機制[3]。程序性細胞死亡(programmed cell death,PCD)又稱調節性細胞死亡(RCD),包括結構緊密的信號級聯和分子效應機制,是細胞自殺的保守進化過程[4],包括細胞凋亡、鐵死亡、細胞自噬、壞死性凋亡、細胞焦亡等11種類型[5]。程序性細胞死亡與缺血性腦卒中的發病機制及腦卒中后缺血再灌注損傷的發生密切相關[6],但目前關于缺血性腦卒中程序性細胞死亡的作用機制尚未完全明確。為探究程序性細胞死亡與缺血性腦卒中相關研究熱點和發展趨勢,本研究運用CiteSpace軟件對該領域的文獻進行可視化和文獻計量學分析,以期為科研人員提供新思路。
1 資料與方法
1.1 數據來源
以中國知網、萬方、維普、中國生物醫學文獻數據庫為數據來源,檢索時限為2012年1月—2022年8月10日。檢索方式為主題詞檢索,檢索主題詞為“缺血性腦卒中”“程序性細胞死亡”,語種為中文,文獻來源為北京大學中文核心期刊、中文社會科學引文索引(CSSCI)、中國科學引文數據庫(CSCD)來源期刊和中國科技論文統計源期刊。
1.2 納入與排除標準
納入文獻類型為article。排除重復文獻、報紙、征稿通知、新聞稿、會議摘要等。
1.3 統一分析方法
從各個數據庫中導出文獻為RefWorks格式,將數據導入CiteSpace 6.1.R3轉化數據格式。設置時間跨度為2012年1月—2022年8月10日;時間切片為1年;關鍵詞和機構分析閾值選擇為“Top N Per Slice”(n=50),作者分析閾值選擇為“g-index k=25”;網絡簡化路徑選擇“Pathfinder”;網格修剪方式為“Pruning the merged network”;分析節點選擇“author”“institution”“keywords”。
2 結 果
2.1 年度發文量分析
共檢索到相關文獻6 938篇,根據納入與排除標準進行篩選,最終納入文獻1 604篇,其中西醫類文獻977篇,中醫類文獻627篇。對納入的1 604篇文獻進行年度發文量分析,詳見圖1。發文量呈曲折上升趨勢,2021年達到最高峰(219篇)。
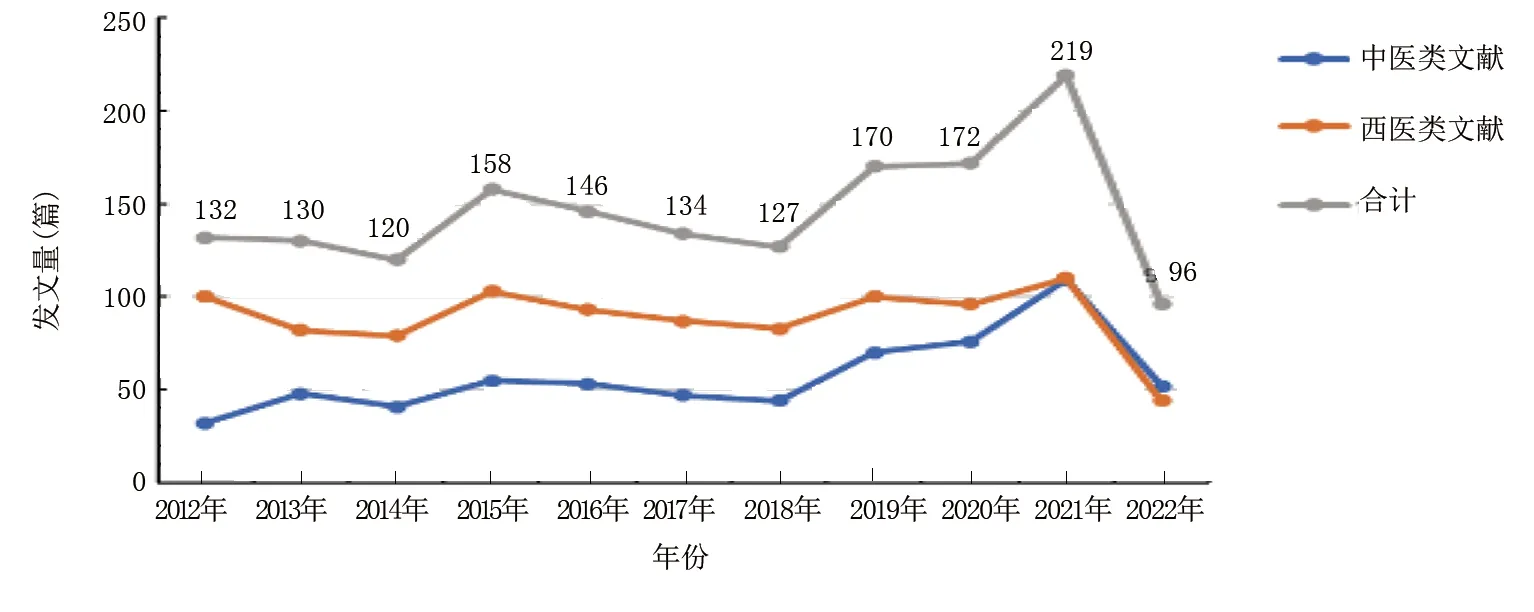
圖1 2012—2022年缺血性腦卒中程序性細胞死亡年度發文量趨勢
根據不同的程序性細胞死亡類型進行分析,2021年研究細胞凋亡核心期刊發文量達到最高峰為68篇,其次,2015年發文量為66篇,2015—2020年呈下降趨勢;研究自噬的發文量呈逐年上升趨勢。自2015年起逐漸出現壞死性凋亡、細胞焦亡及鐵死亡,詳見圖2。
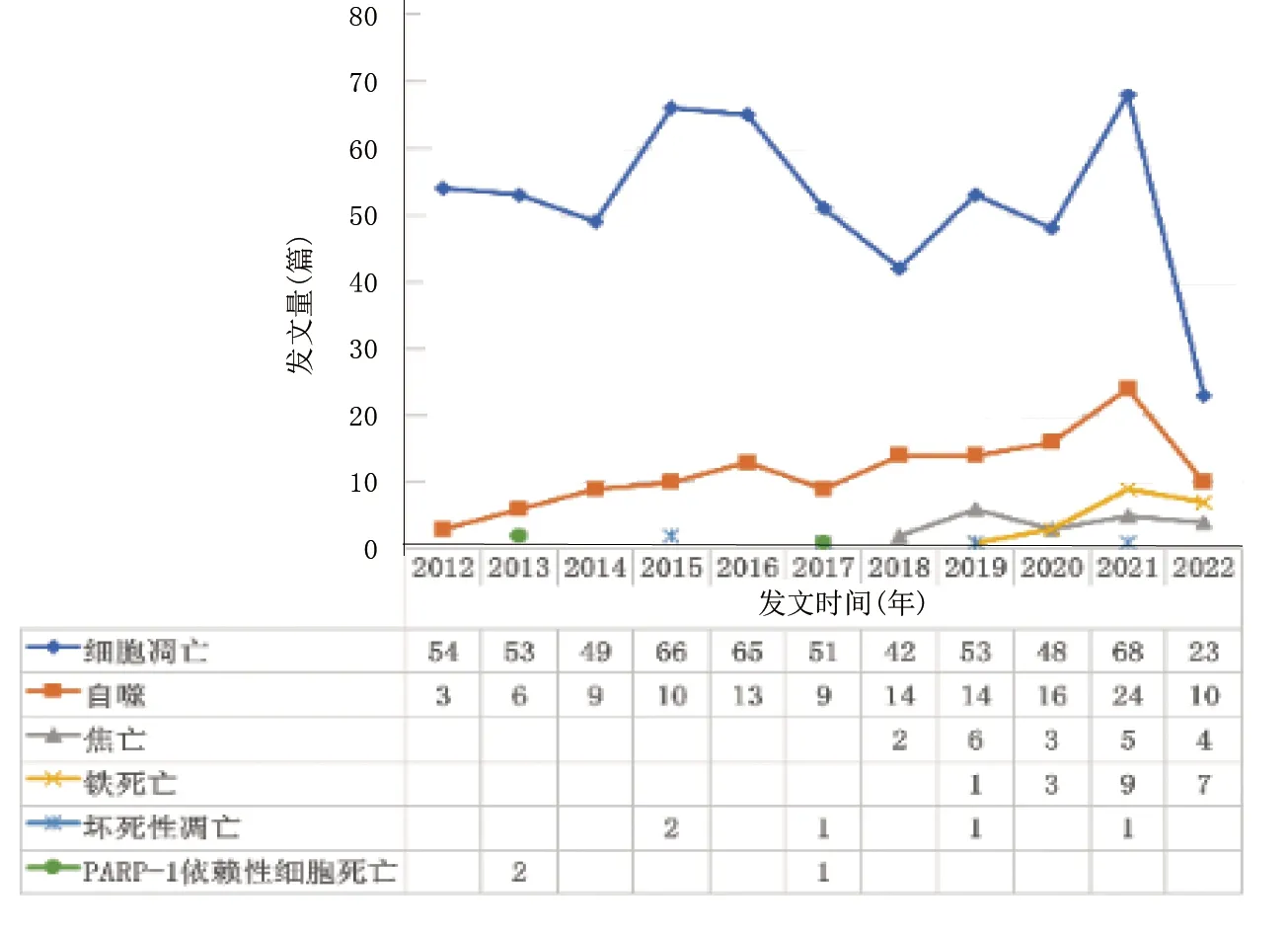
圖2 2012—2022年缺血性腦卒中不同程序性細胞死亡途徑相關文獻發文量
2.2 作者合作網絡分析
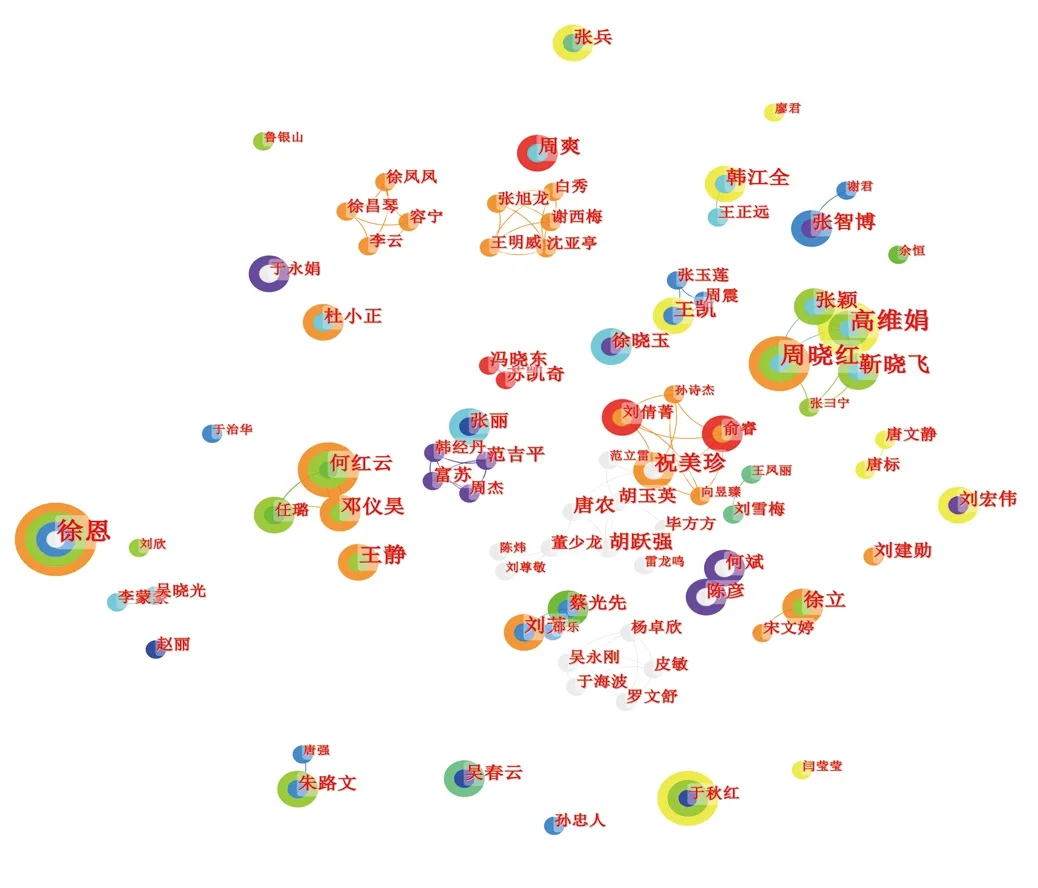
圖3 作者合作網絡共現圖譜
對研究該領域的文獻作者進行共現分析,結果顯示有465名作者,作者之間的合作共512次,合作多為分散。其中祝美珍、于海波、張少蕓、劉永鋒、緱燕華、陳鵬典、彭君華等點度中心性排名最高(9),說明團隊合作緊密。其他研究者之間合作較少,研究相對獨立。
2.3 機構合作網絡分析
從研究機構發文量分析,發文量排名居前10位的機構分別為湖南中醫藥大學(37篇)、北京中醫藥大學(26篇)、天津中醫藥大學(19篇)、北京中醫藥大學東直門醫院(15篇)、浙江中醫藥大學(13篇)、哈爾濱醫科大學第二附屬醫院(12篇)、黑龍江中醫藥大學(11篇)、吉林大學第一醫院(11篇)、中國中醫科學院(10篇)、安徽中醫藥大學(10篇)。研究機構平均發文量為2.8篇。
合并二級機構后進行機構共現網絡分析,結果顯示:研究機構數量共253個,機構之間的合作共49次,合作網絡松散,詳見圖4。其中,北京中醫藥大學東直門醫院、北京中醫藥大學、中國中醫科學院的點度中心性>5,說明與其他機構合作相對密切。北京中醫藥大學東直門醫院點度中心性最高(9),位于合作網絡的中心,說明其在科研合作中有較高的影響力。
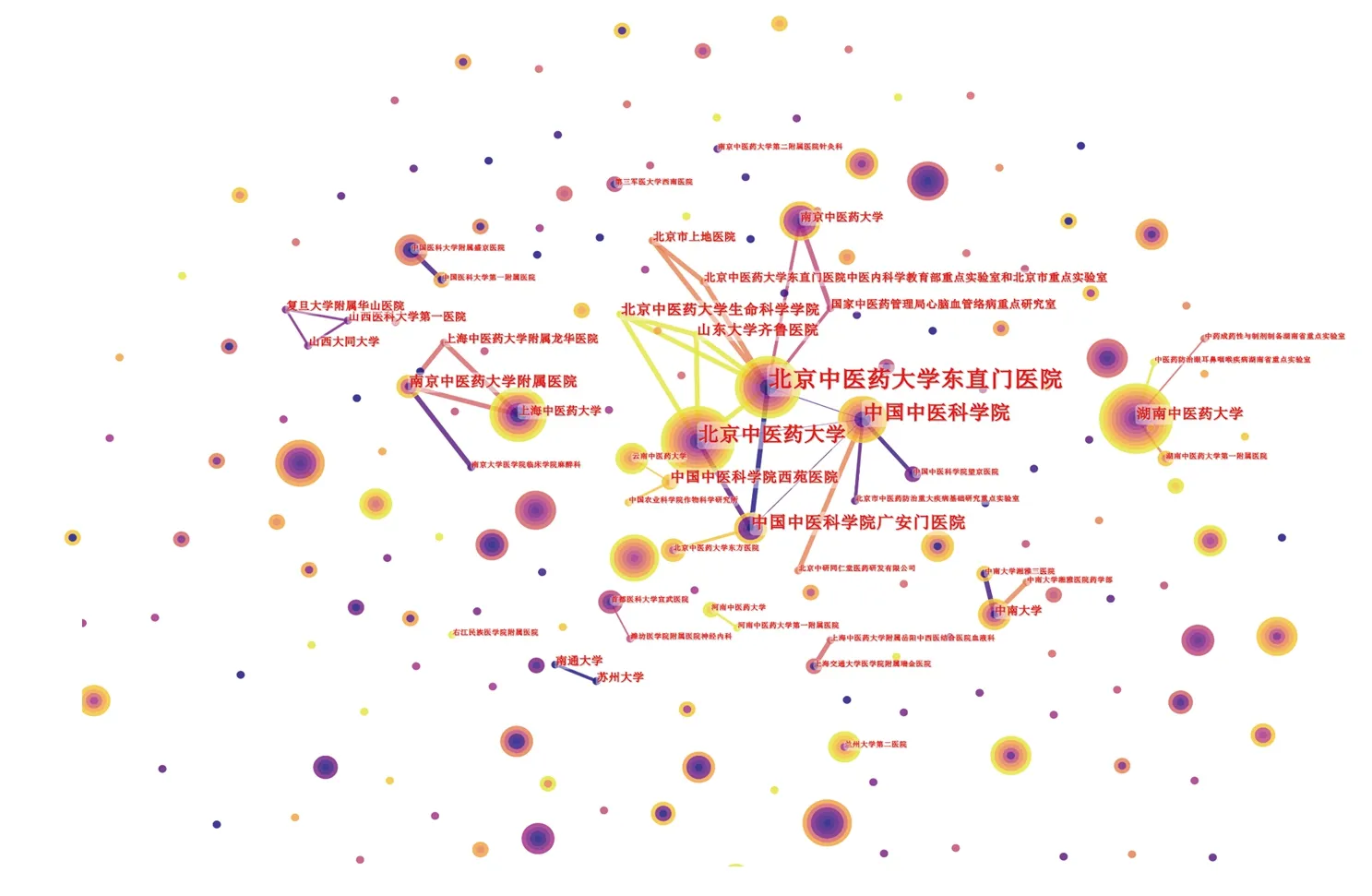
圖4 機構合作網絡共現圖譜
2.4 關鍵詞分析
頻次最高的5個關鍵詞分別為“細胞凋亡”“腦缺血”“腦梗死”“大鼠”“腦卒中”,中介中心性最高的關鍵詞為“腦缺血”。“炎癥反應”的西格瑪值最高,說明創新性最強。頻次排名居前10位的關鍵詞見表1。
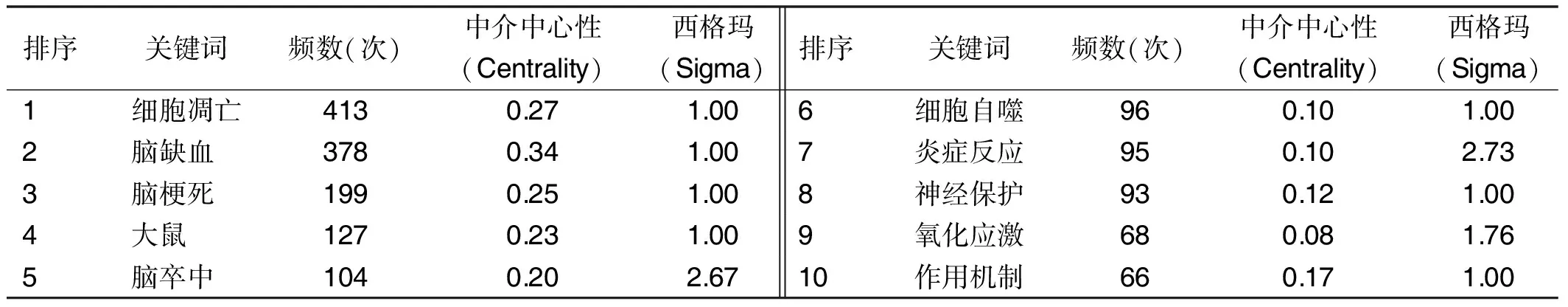
表1 程序性細胞死亡與缺血性腦卒中相關研究領域頻次排名居前10位的關鍵詞
對關鍵詞進行聚類圖譜(clusters)分析,聚類模塊值(Q值)為0.610 7,聚類平均輪廓值(S值)為0.843 3,詳見圖5。結果表明共798個關鍵詞,累計出現頻次3 574次。關鍵詞時間線聚類(timeline)分析中,X軸為年份,Y軸為聚類類別,時間線聚類圖譜可清晰顯示該研究領域的發展趨勢。詳見圖6。
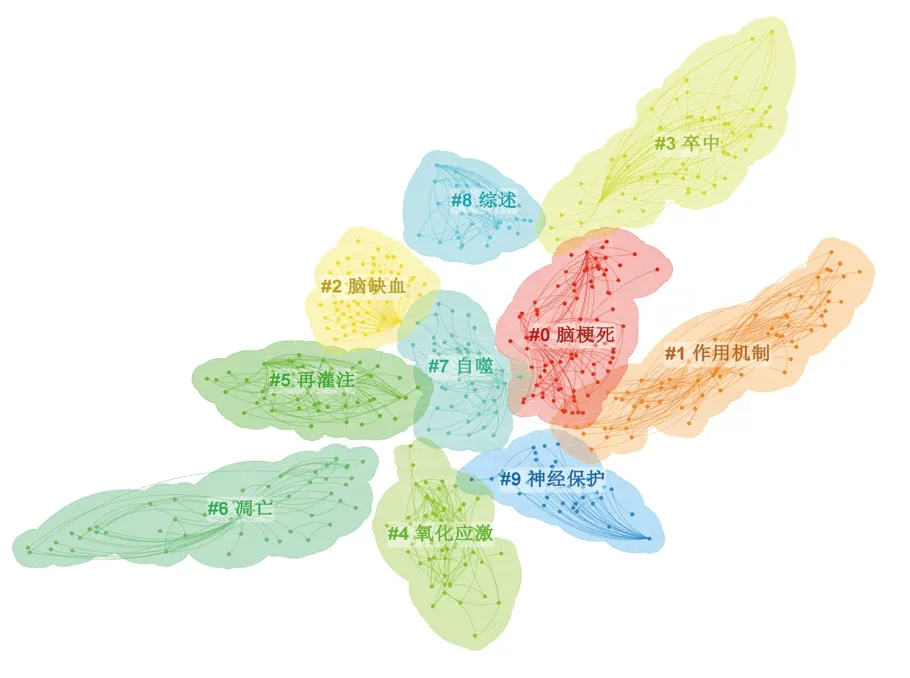
圖5 關鍵詞聚類圖譜
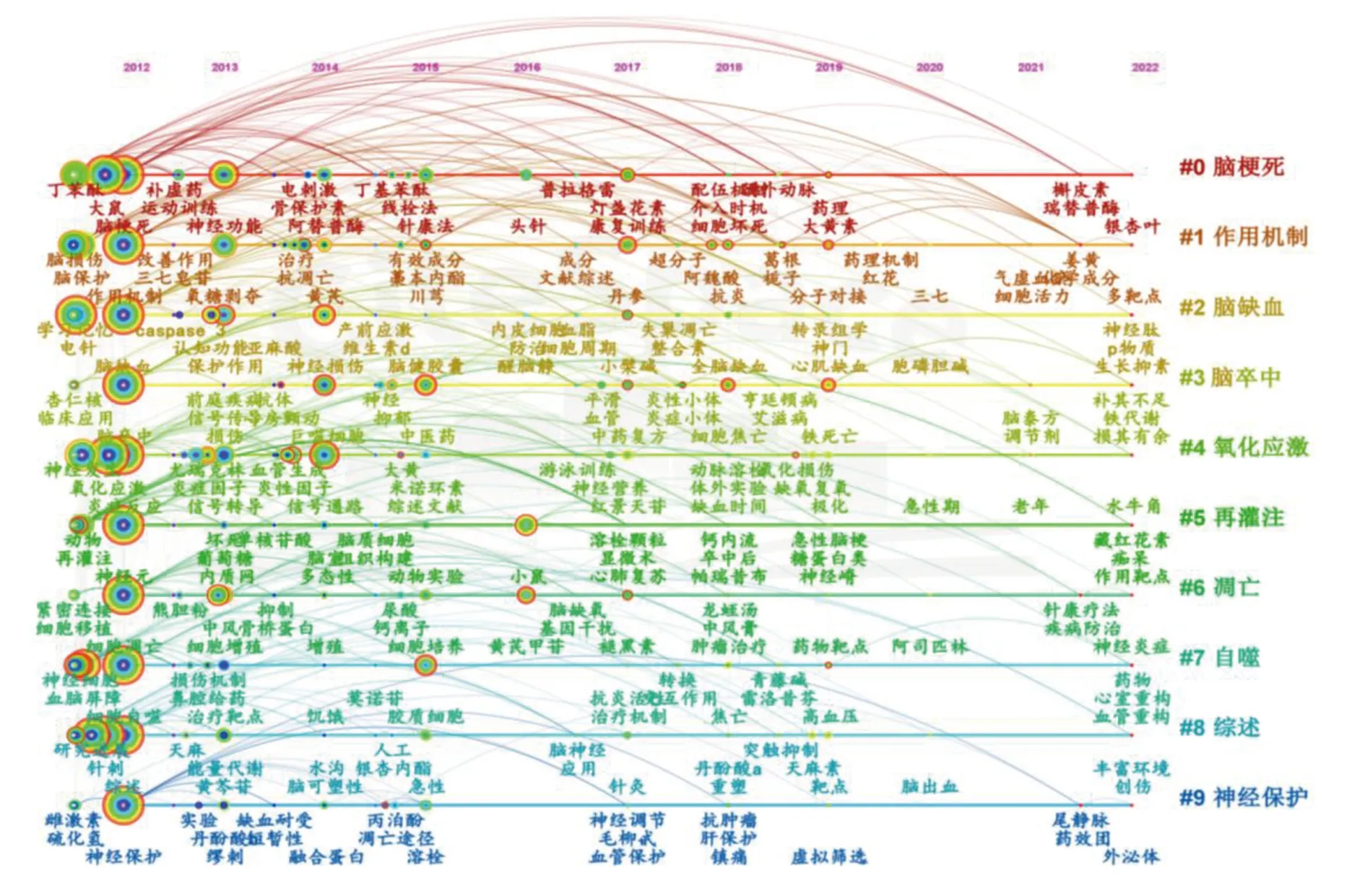
圖6 時間線關鍵詞聚類圖譜
關鍵詞突現(burstness)是指關鍵詞在一段時間內頻次激增,可代表該領域的研究前沿。持續到2022年,突現強度排名居前3位的關鍵詞為炎癥反應、鐵死亡、氧化應激。關鍵詞突現排名居前15位的關鍵詞見圖7。
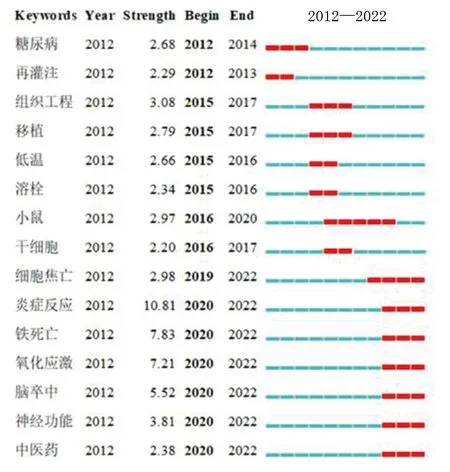
圖7 關鍵詞突現圖譜
3 討 論
3.1 研究概況
從年發文量分析,發文量呈緩慢上升趨勢,且中醫類文獻逐漸增多,研究人員在中醫方面的研究熱度逐漸增加。分析與國家大力推行中醫藥的發展有關,國家政策的支持調動了科研積極性,推動了缺血性腦卒中程序性細胞死亡在中醫領域的科研發展。程序性細胞死亡在缺血性腦卒中的研究進程主要分為兩個階段,2015年之前主要集中在細胞凋亡,2015—2022年研究方向逐漸發展到壞死性凋亡、自噬、焦亡、鐵死亡及多種程序性細胞死亡途徑的聯合研究。
從發文作者分析,徐恩、高維娟、周曉紅、祝美珍、王靜、靳曉飛等在核心期刊發文較多,徐恩是缺血性腦卒中與程序性細胞死亡相關領域內核心期刊發文量最多的核心作者,可顯示其致力于腦梗死的相關研究。
從研究機構分析,分布于科研合作網絡中心的機構及多數科研合作主要集中在北京及省會城市,其他機構間合作較少,主要分布在同省域的高校及其附屬機構之間,可能是由于地理位置較遠,知識傳遞有阻礙導致的[7]。發文量較多的機構主要分布在一線城市或省會城市。一線城市及省會城市的科研資源較多,其高校及附屬機構的科研產出能力較強,與學術方面的馬太效應一致[8]。科研人員可加強跨團隊和跨省域的學科交流,科研機構通過提高學科專業性,加強與其他機構間的合作,進一步提升科研機構的科研產出能力。
3.2 研究熱點分析
缺血性腦卒中與程序性細胞死亡相關的研究熱點作用機制集中在以下兩方面:1)與程序性細胞死亡有關的缺血再灌注損傷機制,包括炎癥反應、氧化應激;2)缺血性腦卒中的程序性細胞死亡途徑,包括細胞凋亡、細胞焦亡、細胞自噬、鐵死亡等。炎癥反應的研究熱點為腦梗死發生后不同階段炎癥反應損傷機制、炎癥小體NOD樣受體熱蛋白結構域相關蛋白3(NLRP3)及小膠質細胞、T淋巴細胞[9-11]。氧化應激伴隨炎癥反應發生,氧化應激的研究熱點為氧化應激與炎癥反應、血腦屏障、細胞凋亡、自噬之間的相互作用[12-14]。焦亡機制與炎癥反應密切相關,焦亡分為經典途徑和非經典途徑[15-17],研究熱點主要包括gasdermin和Caspase(-1/-4/-5/-11)蛋白家族及炎癥小體NLRP3[18],但目前非經典途徑與缺血性腦卒中的關系尚未明確。自噬對腦缺血的作用機制存在爭議,主要由哺乳動物雷帕霉素靶蛋白(mTOR)和單磷酸腺苷激活的蛋白激酶(AMPK)途徑驅動[19],早期細胞自噬發揮著保護腦組織和神經的作用[20-22],但過度的自噬反應可引起細胞死亡[23-25]。有研究表明,鐵死亡是由于缺血性腦卒中后鐵代謝失衡,導致鐵在細胞內大量堆積,促使大量的活性氧自由基產生,引起脂質過氧化和細胞死亡[26];同時細胞內鐵離子增多加劇細胞自噬,不利于腦損傷恢復[27]。較少研究證實鐵死亡與缺血性腦卒中直接相關。目前細胞焦亡、自噬及鐵死亡的研究主要集中在細胞和動物實驗方面,關于臨床的研究證據仍有待補充。
缺血性腦卒中程序性細胞死亡的研究熱點干預措施多為中醫治療,包括中藥治療、電針等。中醫學將腦缺血歸屬于“中風”范疇,認為“氣虛血瘀”為中風的關鍵致病原因,因此益氣活血是治療中風的重要原則。益氣活血方藥及其有效成分主要包括黃芪甲苷、人參皂苷、川芎嗪、腦泰方、補陽還五湯等[28],通過調節Notch、磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)、Janus激酶-信號傳導子和轉錄激活子(JAK-STAT)、絲裂原活化蛋白激酶(MAPK)、Fas/FasL、Caspase信號通路抑制細胞凋亡[29]。黃芪甲苷通過下調核轉錄因子(NF)-κB蛋白表達抑制細胞凋亡,從而抑制氧化應激和炎癥反應[30],并激活自噬機制減輕腦缺血再灌注損傷[31]。人參皂苷Rg1能通過抑制NADPH氧化酶異構體2-NOD樣受體熱蛋白結構域相關蛋白1(NOX2-NLRP1)通路、激活缺氧誘導因子-1α(HIF-1α)/血管內皮生長因子(VEGF)通路、調節跨膜受體卷曲蛋白1(FZD1)、piwi樣RNA介導的基因沉默1(PIWIL1)、叉頭盒蛋白M1(FOXM1)相關基因及蛋白的表達促進腦損傷恢復,改善神經功能[32-34]。川芎嗪通過抑制氧化應激和炎癥反應改善細胞凋亡[35]。腦泰方通過調節SIRT1信號通路減少細胞凋亡[36],通過調控沉默休克因子1/熱休克因子結合蛋白1(HSF1/HSPB1)通路抑制鐵死亡,保護腦組織[37]。補陽還五湯通過AMPK/mTOR/UNC-51樣激酶1(ULK1)信號通路抑制自噬,降低神經細胞凋亡率,保護大鼠神經功能[19]。電針“百會”穴可調節腦組織細胞焦亡底物蛋白消皮素D(GSDMD)表達,改善大鼠腦缺血神經損傷,通過JAK2/STAT3、MAPK信號通路下調靶蛋白減少細胞凋亡,從而減小腦梗死體積[38-40]。
綜上所述,國內關于缺血性腦卒中與程序性細胞死亡領域的研究于2015年之前主要集中在細胞凋亡,因此關于壞死性凋亡、自噬、細胞焦亡、鐵死亡等其他程序性細胞死亡途徑對缺血性腦卒中的作用機制仍需深入探討和完善;多數程序性細胞死亡研究僅停留在細胞和動物實驗層面,臨床研究存在不足。本研究僅納入了中文文獻,未納入國外文獻,缺失國外期刊發表的文獻數據,因此,研究分析的準確性存在一定的偏倚。

