鹿頭黃酒釀造用高溫大曲細菌類群及其感官特性解析
柯悅,鄧子文,姜在明,向凡舒,侯強川,郭壯*
1(湖北文理學院,湖北省食品配料工程技術研究中心,湖北 襄陽,441053) 2(襄陽市釀酒生物技術與應用企校聯合創新中心,湖北 襄陽,441053) 3(棗陽市靈鹿酒業有限公司,湖北 棗陽,441203)
黃酒采用“雙邊發酵”工藝釀造而成,因酒體柔和、口感醇厚且營養豐富而受到眾多消費者喜愛[1]。經過幾千年的歷史傳承,我國形成了眾多具有地域特色的黃酒品類。如使用麥曲發酵的浙江紹興黃酒,具有澄黃清亮和醇厚鮮甜的特點[2];使用紅曲與小曲共同發酵的福建紅曲黃酒,具有色澤鮮紅和醇厚香濃的特點[3];使用小曲發酵的湖北房縣黃酒,具有甘冽爽凈和米香濃郁的特點[4]。由此可見,除了地域環境和工藝的不同,這些黃酒的不同風格特征還源于用曲差異。通過提供所必須的菌系和酶系,酒曲直接影響了黃酒酒體風格的形成,這也就是所謂的“曲定酒型”[5]。
湖北地區雖以房縣黃酒最為出名,但產自襄陽市的鹿頭黃酒亦受到較多消費者的喜愛,其釀造用曲和工藝均與房縣黃酒有較大區別。鹿頭黃酒采用的是小曲和高溫大曲共同發酵,講究“兩次下曲,三次發酵,地封貯存”,酒體芳香馥郁、綿柔甜美而回味帶苦。由此可見,鹿頭黃酒獨特風格特征的形成與其釀造所使用的高溫大曲有一定關聯。鹿頭黃酒釀造用高溫大曲在培菌階段并無“翻曲”工藝,因而其受到空間異質性的影響較大[6],不同位置的大曲所發生的褐變程度并不完全一致,位于大曲堆上部和下部的大曲通常呈黃色,而位于大曲堆中部的大曲通常呈黑色。不同顏色的高溫大曲所釀造的黃酒酒體風格往往也存在差異,黑色高溫大曲釀造出的黃酒酒體顏色偏紅褐色,香氣濃郁,但苦味較之黃色高溫大曲釀造出的黃酒更加突出,這或許和不同顏色高溫大曲所富集的微生物類群不同有關[7]。在鹿頭黃酒的實際生產過程中兩類高溫大曲往往會混合使用,二者的投入比例通常根據釀酒師的經驗而定。然而,目前有關鹿頭黃酒釀造用高溫大曲的微生物類群及其感官特性等相關研究還鮮見報道。以Illumina MiSeq為代表的第二代高通量測序技術是目前食品微生物學研究中相對成熟和廣泛應用的技術手段,其不僅可以研究發酵食品中微生物類群的組成、結構和動態,還可用于探索復雜微生物群落與樣本質量的關系[8]。相較于復雜的色譜分析,電子鼻和電子舌具有簡單快速、無損和無污染的特點,被認為是耗時且昂貴的經典分析技術的替代方案,已被廣泛應用于制藥和食品行業[9]。
本研究首先采用MiSeq高通量測序技術對黑色和黃色高溫大曲的細菌類群結構及其基因功能進行解析,再結合電子鼻和電子舌對其感官特性進行分析,并探究兩類酒曲的差異性,最后將細菌類群與感官特性展開關聯性分析,以期揭示鹿頭黃酒釀造用高溫大曲的微生物群系及感官特征,為后續鹿頭黃酒的工藝改良和品質提升提供一定的理論參考依據。
1 材料與方法
1.1 材料與試劑
1.1.1 材料
高溫大曲:于2021年8月在湖北省襄陽市棗陽市某黃酒生產企業采集黑色高溫大曲(簡稱黑曲)和黃色高溫大曲(簡稱黃曲)樣品各10份,黑曲編號為B1~B10,黃曲編號為Y1~Y10,共計20份。所有高溫大曲樣品均為該黃酒生產企業自制,以整粒小麥主要原料,同時輔有益母草(Leonurusjaponicus)、青蒿(ArtemisiaapiaceaHance)、紅花(CarthamustinctoriusL.)、茜草(RubiacordifolinLinn.)、當歸(AngelicasinensisDiels)、陳皮(PericarpiumcitriReticulatae)和辣蓼草(PolygonumhydropiperL.)等中藥材,采集的樣品被裝入無菌采樣袋中常溫下運回實驗室,回到實驗室后使用打粉機將樣品打成粉狀并裝入自封袋中置于-40 ℃備用。
1.1.2 試劑
DNeasy mericon Food Kit DNA基因組提取試劑盒,德國QIAGEN公司;Axygen清潔試劑盒,康寧生命科學吳江有限公司;Buffer、dNTP緩沖液、rTaq聚合酶和正/反向引物338F/806R(338F:5′-ACTCCTACGGGAGGCAGCA-3′;806R:5′-GGACTACHVGGGTWTCTAAT-3′),上海桑尼生物科技有限公司;Illumina MiSeq測序試劑盒v3,美國Illumina公司;陰離子溶液、陽離子溶液、內溶液和參比溶液,日本INSENT公司。
1.2 儀器與設備
164-5050基礎電泳儀,美國Bio-Rad公司;Vetiri梯度基因擴增儀,美國AB公司;MiSeq PE300高通量測序平臺,美國Illumina公司;R930機架式服務器,美國DELL公司;PEN3電子鼻(配備10個傳感器),德國Airsense公司;SA402B電子舌(配備5個傳感器和2個參比電極),日本INSENT公司。
1.3 實驗方法
1.3.1 宏基因組DNA提取、PCR擴增和高通量測序
每份樣品均稱取2.0 g進行宏基因組DNA提取,提取方法參照試劑盒說明。使用瓊脂糖凝膠電泳對提取到的宏基因組DNA質量進行檢測,質量檢測合格的DNA用含有barcode(核苷酸標簽)的引物338F/806R對細菌16S rRNA V3~V4區域進行PCR擴增,擴增成功的PCR產物被送至上海美吉生物醫藥科技有限公司完成測序。
1.3.2 序列質控和生物信息學分析
本研究采用QIIME平臺(v1.9.0)進行生物信息學分析。首先參照郭壯的方法對下機數據進行質控[10],刪除接頭序列和barcode序列后根據雙端關系將序列進行拼接和歸并;剔除錯配率≥0.2、引物堿基錯配數≥2 bp或barcode堿基有錯配的低質量序列;采用UCLUST兩步法對有效序列按照100%和97%相似度構建分類操作單元(operational taxonomic units,OTU)[11],并對其進行嵌合體檢查[12],選取代表性序列在數據庫[13-15]中進行同源性比對并確立分類學地位;計算細菌類群的α多樣性指數,基于OTU加權UniFrac距離解析鹿頭黃酒釀造用黑色和黃色高溫大曲細菌群落結構的β多樣性;采用PICRUSt(phylogenetic investigation of communities by reconstruction of unobserved states)軟件對高溫大曲的細菌基因功能進行預測[16]。
1.3.3 基于電子鼻技術高溫大曲的氣味特征解析
稱取7.0 g高溫大曲樣品置于電子鼻檢測頂空瓶中,樣品體積約占到頂空瓶體積的1/3左右,每份樣品設置3組平行。將已裝樣的頂空瓶于25 ℃室溫靜置1 h達到平衡后進行頂空進樣,進樣條件:樣品測試時間60 s,采樣間隔1 s,清洗時間90 s,歸零時間10 s,樣品流速300 mL/min,內部流速300 mL/min[17]。后續選取第49、50、51 s時傳感器響應值的平均值作為分析數據。
1.3.4 基于電子舌技術高溫大曲的滋味特征解析
稱取30.0 g高溫大曲樣品于250 mL燒杯中并加入120 mL純水,攪拌均勻后轉移至200 mL離心杯,10 000 r/min離心10 min,取上清液進行抽濾,收集到的濾液參照王玉榮的方法使用電子舌檢測酸、苦、澀、咸、鮮、后味A(苦的回味)、后味B(澀的回味)和豐度(鮮的回味)8項滋味指標[18]。
1.3.5 數據處理
使用R(v4.1.0)軟件繪制小提琴圖、普氏分析圖和相關性熱圖;采用Origin 2021軟件繪制主坐標、柱形圖和多因子箱型圖;采用STAMP軟件繪制不同類型高溫大曲細菌蛋白質直系同源簇(clusters of orthologous groups of proteins,COG)功能差異圖;使用Past3軟件中的Mann-Whitney檢驗法進行差異性分析。
2 結果與分析
2.1 鹿頭黃酒釀造用黑色和黃色高溫大曲細菌類群α和β多樣性分析
本研究首先計算了鹿頭黃酒釀造用黑色和黃色高溫大曲細菌類群的超1指數和香農指數,并進行了基于加權UniFrac距離的主坐標分析,同時計算了95%置信區間,如圖1所示。
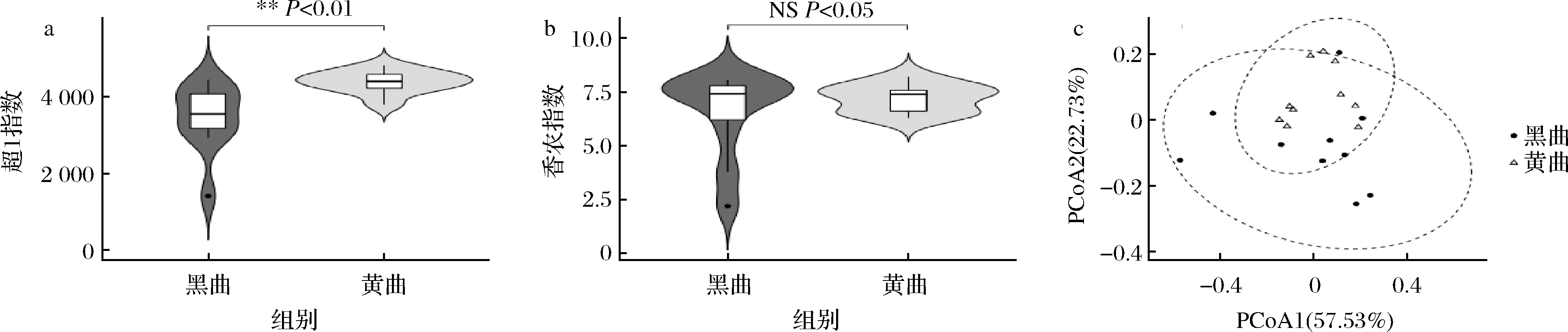
a-超1指數;b-香農指數;c-基于加權UniFrac距離的主坐標分析圖1 鹿頭黃酒釀造用黑色和黃色高溫大曲細菌α多樣性和β多樣性分析Fig.1 Analysis of α-diversity and β-diversity of the bacterial taxa in black and yellow high-temperature Daqu for Lutou yellow rice wine brewing注:超1指數和香農指數均在測序深度為34 010條序列時進行計算;**代表P<0.01,差異非常顯著;NS代表P>0.05,差異不顯著(下同)。
由圖1-a和圖1-b可知,黑色和黃色高溫大曲細菌類群的平均超1指數分別為3 460和4 390,平均香農指數分別為6.56和7.20,其中黑色高溫大曲的超1指數顯著偏低(P<0.01),而香農指數兩者差異不顯著(P>0.05),這表明黑色高溫大曲細菌的豐度要顯著低于黃色高溫大曲,但二者的多樣性差異并不顯著。由圖1-c可知,黑色高溫大曲的置信區間要明顯大于黃色高溫大曲,且大面積覆蓋了黃色高溫大曲的置信區間,但兩者在空間排布中仍有明顯的分離趨勢。由此可見,鹿頭黃酒釀造用黑色和黃色高溫大曲的細菌群落結構存在明顯差異,且黑色高溫大曲細菌類群的組間差異偏大。值得關注的是,黑色高溫大曲的細菌豐度顯著偏低這一現象或許和導致它們形成不同顏色的機制有關,究其原因在于前期升溫較快導致水分不足[19],從而抑制了部分菌群的生長繁殖。
2.2 鹿頭黃酒釀造用黑色和黃色高溫大曲細菌類群結構及其功能解析
20個鹿頭黃酒釀造用高溫大曲樣品經過MiSeq高通量測序共得到942 742條序列,經過質量控制刪除18 248條低質量序列,余下924 494條有效序列,按照97%序列相似度被劃分為13 027個OTU。經序列同源性比對,20個高溫大曲共鑒定到了30個門和632個屬,優勢細菌門(平均相對含量>1.0%)組成及其在樣品中的分布情況見圖2。
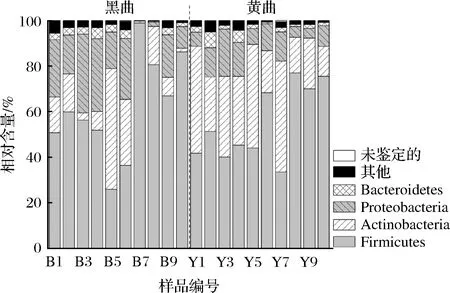
圖2 鹿頭黃酒釀造用黑色和黃色高溫大曲優勢細菌門及其相對含量Fig.2 The dominant bacterial phylum and their relative content in black and yellow high-temperature Daqu for Lutou yellow rice wine brewing
由圖2可知,所有鹿頭黃酒釀造用高溫大曲細菌共隸屬于4個優勢門,分別為硬壁菌門(Firmicutes,58.04%)、放線菌門(Actinobacteria,22.63%)、變形菌門(Proteobacteria,14.33%)和擬桿菌門(Bacteroidetes,2.54%)。通過Mann-Whitnay檢驗發現,黑色高溫大曲中Actinobacteria的相對含量要顯著偏低(P<0.05),平均相對含量為15.29%,而在黃色高溫大曲中為29.98%。優勢細菌屬(平均相對含量>1.0%)的組成及其在各個樣品中的分布情況見圖3。
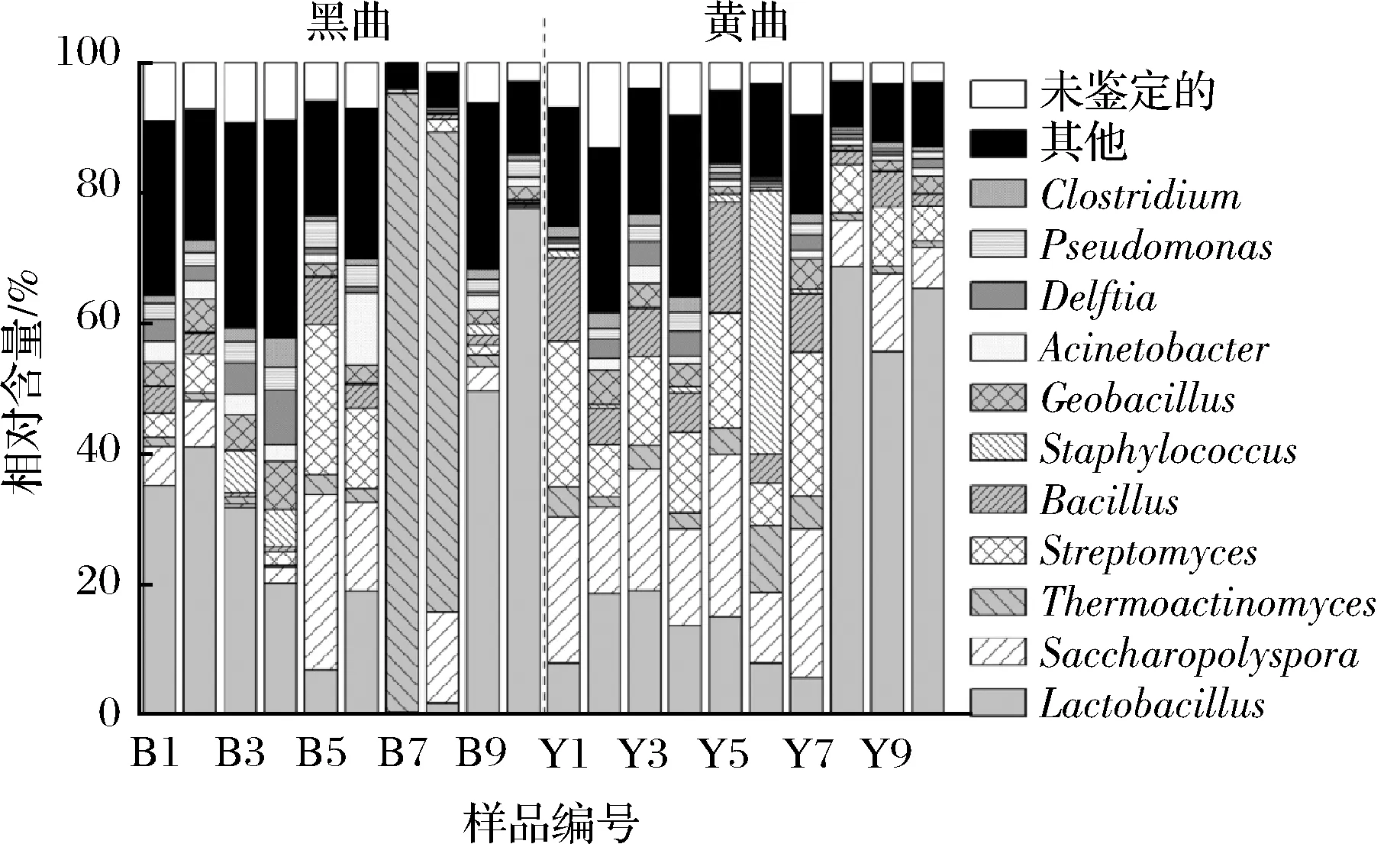
圖3 鹿頭黃酒釀造用黑色和黃色高溫大曲優勢細菌屬及其相對含量Fig.3 The dominant bacterial genera and their relative content in black and yellow high-temperature Daqu for Lutou yellow rice wine brewing
由圖3可知,優勢細菌屬共有11個,分別為隸屬于Firmicutes的乳酸桿菌屬(Lactobacillus,28.04%)、高溫放線菌屬(Thermoactinomyces,10.73%)、芽孢桿菌屬(Bacillus,4.67%)、葡萄球菌屬(Staphylococcus,3.02%)、地芽孢桿菌屬(Geobacillus,2.74%)和梭菌屬(Clostridium,1.38%);隸屬于Actinobacteria的糖多孢菌屬(Saccharopolyspora,11.38%)和鏈霉菌屬(Streptomyces,8.81%);隸屬于Proteobacteria的不動桿菌屬(Acinetobacter,2.01%)、代爾夫特菌屬(Delftia,1.97%)和假單胞菌屬(Pseudomonas,1.79%)。經Mann-Whitnay檢驗發現,黑色高溫大曲中的Saccharopolyspora、Streptomyces和Bacillus相對含量均顯著偏低(P<0.05),相對含量分別為7.50%、5.15%和2.20%,而在黃色高溫大曲中分別為15.26%、12.46%和7.13%。
在解析鹿頭黃酒釀造用高溫大曲細菌群落結構差異的基礎上,本研究進一步對其細菌基因功能進行了比較分析。所有序列通過注釋被預測到4 792個COG,分別被歸類到23個功能大類。除了一般功能和未知功能以外,黑色和黃色高溫大曲中的細菌在氨基酸運輸與代謝、碳水化合物運輸與代謝以及轉錄功能上的表達量均較高,均超過8%,而黑曲和黃曲細菌在多數功能的表達量上表現出了一定的顯著差異(P<0.05),見圖4。
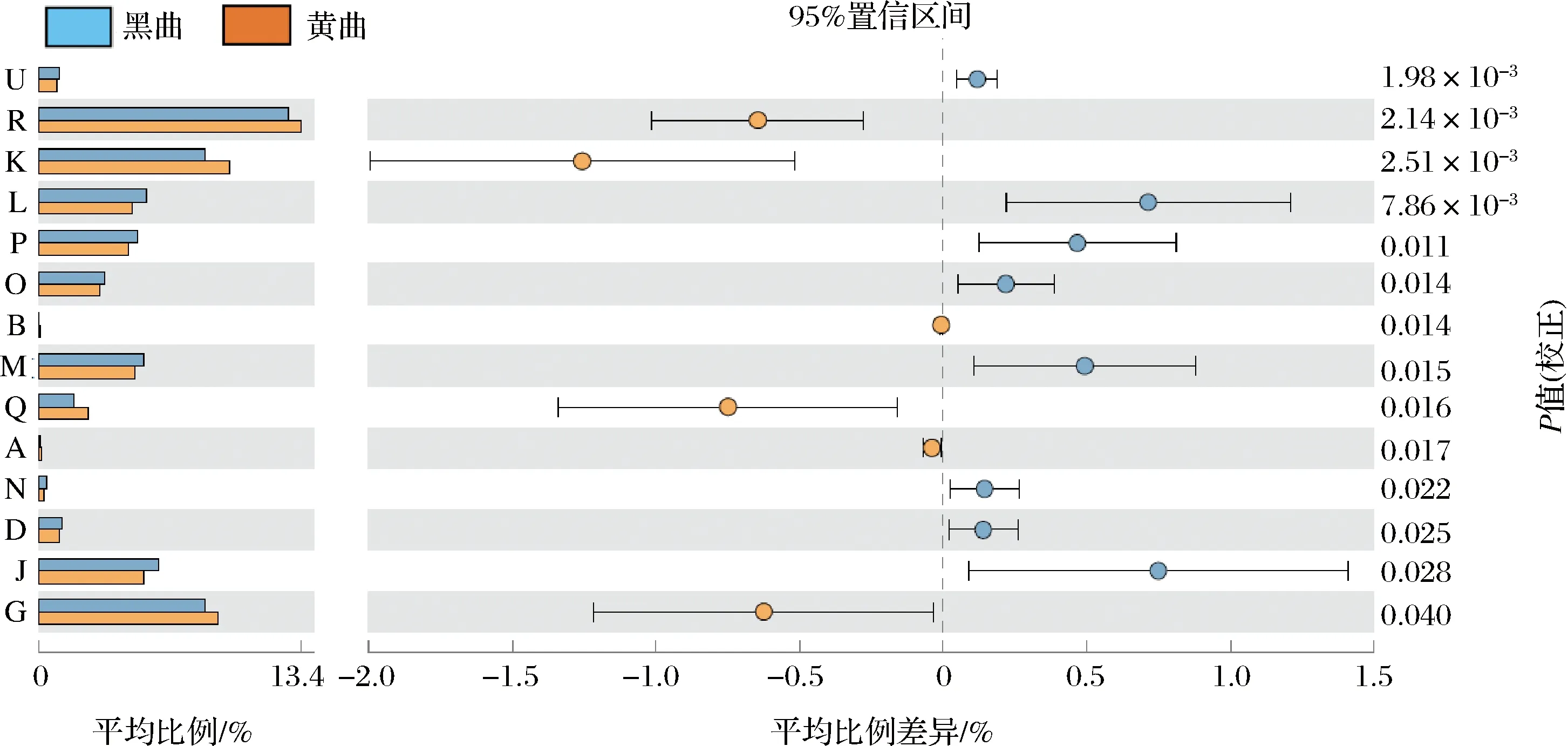
圖4 鹿頭黃酒釀造用黑色和黃色高溫大曲細菌COG功能差異分析Fig.4 Analysis of the functional differences between black and yellow high-temperature Daqu for Lutou yellow rice wine brewing注:U-細胞內運輸,分泌和囊泡運輸;R-一般功能預測;K-轉錄;L-復制、重組和修復;P-無機離子運輸與代謝;O-翻譯后修飾,蛋白質周轉,伴侶;B-染色質結構與動力學;M-細胞壁/膜/包膜生物發生;Q-次生代謝產物的合成、轉運和分解代謝;A-RNA的加工與修飾;N-細胞運動;D-細胞周期控制、細胞分裂、染色體分割;J-翻譯、核糖體結構與生物發生;G-碳水化合物運輸和代謝。
由圖4可知,經過Mann-Whitnay檢驗發現,黑色和黃色高溫大曲中細菌類群在14個功能上存在顯著差異,其中黑色高溫大曲中細菌在U(細胞內運輸,分泌和囊泡運輸)、L(復制、重組和修復)、P(無機離子運輸與代謝)、O(翻譯后修飾,蛋白質周轉,伴侶)、M(細胞壁/膜/包膜生物發生)、N(細胞運動)、D(細胞周期控制、細胞分裂、染色體分割)和J(翻譯、核糖體結構與生物發生)功能上的表達量顯著偏高(P<0.05),而在R(一般功能)、K(轉錄)、B(復制、重組和修復)、Q(次生代謝產物的合成)、A(RNA的加工與修飾)和G(碳水化合物運輸和代謝)功能上的表達量要顯著偏低(P<0.05)。由此可見,鹿頭黃酒釀造用黑色和黃色高溫大曲不僅細菌群落結構存在差異,其細菌類群的基因功能表達亦存在顯著差異,而這種差異可能會對鹿頭黃酒酒體品質的形成產生一定影響。
2.3 基于電子鼻和電子舌技術鹿頭黃酒釀造用黑色和黃色高溫大曲感官品質解析
高溫發酵賦予了高溫大曲特殊的風味,使曲中含有豐富的揮發性香氣成分和呈味物質,奠定了酒體風味的基礎[20],對其感官特性進行解析為后續了解鹿頭黃酒風味的形成具有重要意義。因而,本研究采用電子鼻和電子舌分別對其氣味和滋味特征進行了解析,其氣味特征見圖5。
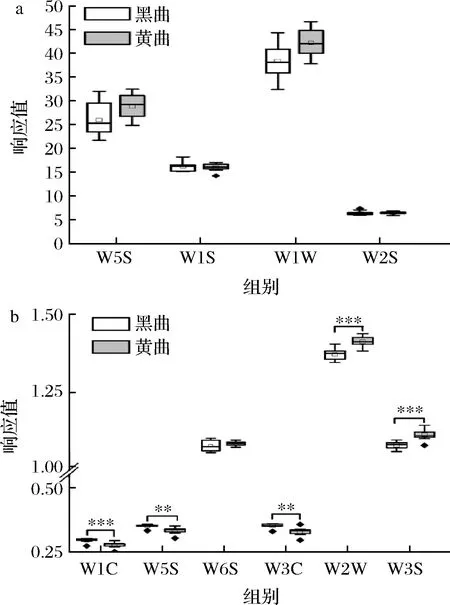
圖5 鹿頭黃酒釀造用黑色和黃色高溫大曲氣味特征比較分析Fig.5 Comparative analysis of odor characteristics of black and yellow high-temperature Daqu for Lutou yellow rice wine brewing注:空心點代表平均值,實心點代表異常值; ***代表P<0.001,差異極顯著;沒有標注則代表差異不顯著(P>0.05)(下同)。
由圖5-a可知,雖然傳感器W5S(對氫氧化物靈敏)、W1S(對甲烷類靈敏)、W1W(對有機硫化物、萜類物質靈敏)和W2S(對乙醇靈敏)對高溫大曲的響應值比較高,但其在兩類高溫大曲間差異并不顯著(P>0.05)。由圖5-b亦可知,感器W1C(對芳香類物質靈敏)、W3C(對芳香類物質靈敏)和W5C(對芳香類物質靈敏)、W2W(對有機硫化物靈敏)和W3S(對烷烴類物質靈敏)響應值雖然比較低,但在兩類高溫大曲間差異顯著(P<0.05),除W3S傳感器外,其他4組傳感器對黑色高溫大曲的響應值均顯著偏高(P<0.05)。由此可見,鹿頭黃酒釀造用黑色和黃色高溫大曲的氣味差異主要體現在豐度較低的芳香類化合物上,且其含量在黑色高溫大曲中明顯偏高。
因傳感器W2W對有機硫化物靈敏,這說明鹿頭黃酒釀造用高溫大曲中存在一定的揮發性硫化物,該物質是食品中常見的風味物質,在葡萄酒、白酒和啤酒中亦廣泛存在[21]。有研究表明,美拉德反應是導致食品中產生硫化物的主要原因[22]。鹿頭黃酒釀造用高溫大曲在拌料階段需添加40%左右的水,培菌時溫度需達到60~70 ℃[23],適宜的水分和溫度恰好為美拉德反應的發生提供了良好條件,從而使曲中產生了豐富的揮發性硫化物。基于電子舌技術鹿頭黃酒釀造用高溫大曲的滋味特征見圖6。
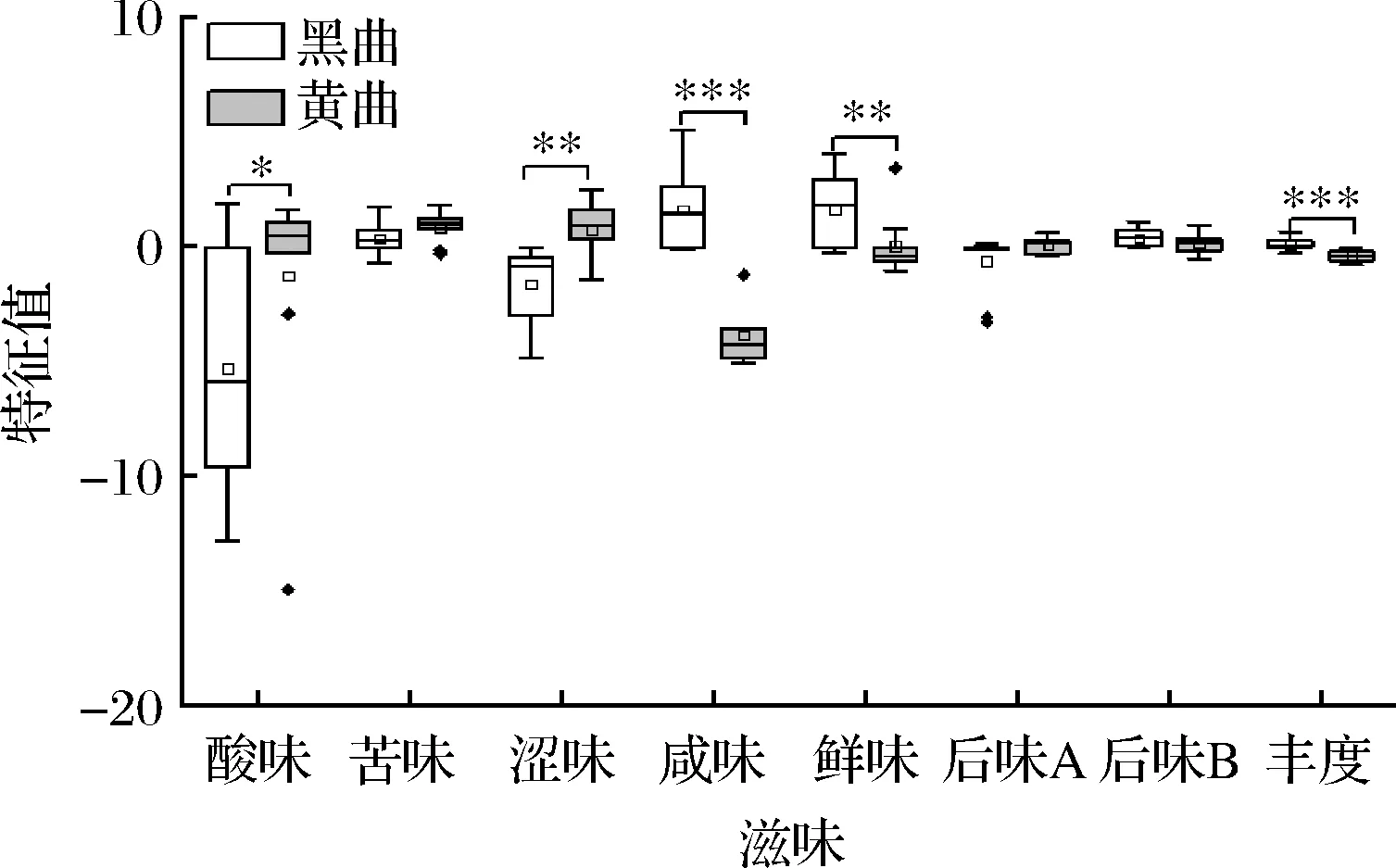
圖6 鹿頭黃酒釀造用黑色和黃色高溫大曲滋味特征比較分析Fig.6 Comparative analysis of taste characteristics of black and yellow high-temperature Daqu for Lutou yellow rice wine brewing注:*代表P<0.05,差異顯著(下同)。
由圖6可知,黑色高溫大曲的酸味和澀味顯著偏低(P<0.05),而咸味、鮮味和豐度(鮮的回味)顯著偏高(P<0.05)。由此可見,鹿頭黃酒釀造用黑色和黃色高溫大曲的風味和滋味均存在較大差異。發酵食品中的香氣成分和呈味物質大多由微生物降解原料產生,例如酯類、醇類、有機酸、氨基酸和苦味肽等[24-26],因而可以推斷高溫大曲優勢菌群與感官特性是存在一定關聯性的。
2.4 鹿頭黃酒釀造用高溫大曲優勢菌群與感官特性的關聯性分析
本研究進一步對微生物類群結構和感官特征之間的關聯性進行了探討,高溫大曲優勢細菌類群與感官特性間的普氏分析及兩者相關性如圖7所示。
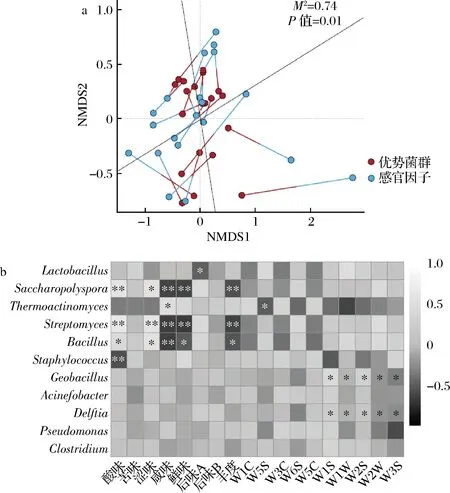
a-普氏分析;b-相關性熱圖圖7 優勢細菌類群與感官特性間的普氏分析和相關性熱圖Fig.7 Procrustes analysis and correlation analysis between dominant bacterial taxa and sensory indicators
由圖7-a可知,通過對原始數據進行降維,樣品疊加分布在了一個低維空間中,本研究在此基礎上對微生物類群結構和感官特性展開了普氏分析,分別計算了點坐標之間的M2值(偏差平方和)和顯著性P值,結果表明高溫大曲的細菌類群結構與其感官特性之間具有非常顯著的關聯性(P<0.01)。在賦予發酵體系酶系和菌系的同時,高溫大曲在制曲過程中產生的代謝產物亦可對黃酒酒體的風味和滋味產生影響。鹿頭黃酒酒體微苦且酸味較弱,因而本研究更為關注酒曲的酸味、苦味及后味A(苦的回味)。由圖7-b可知,Lactobacillus與酒曲的后味A(苦的回味)呈顯著負相關(P<0.05);Saccharopolyspora、Streptomyces和Bacillus均與酸味呈顯著正相關(P<0.05),而Staphylococcus呈現出相反的趨勢(P<0.01)。此外,鹿頭黃酒酒體芳香馥郁,而傳感器W1C、W3C和W5C主要對芳香成分比較敏感,但本研究并未發現上述傳感器的響應值與某一細菌類群相對含量具有相關性(P>0.05)。
由圖7-b亦可知,鹿頭黃酒釀造用高溫大曲細菌類群與滋味指標之間的關聯性要明顯高于其與氣味指標之間的關聯性,究其原因可能在于以下兩點,一方面,制曲溫度對酒曲中微生物的類群及其代謝產物具有重要影響,例如低溫階段時,霉菌、酵母和部分細菌大量富集并產生較多的酶和氨基酸等代謝產物,而這部分代謝產物可能對酒曲的滋味產生重要影響;另一方面,酒曲在低溫階段產生的代謝物在高溫階段會相互發生美拉德反應[27],從而產生有助于形成獨特焦香風味的化合物[7],例如WANG等[28]在高溫大曲中就發現了許多與美拉德反應產物相同的代謝產物,因而酒曲的氣味一方面來源于微生物自身的代謝,但更多的可能是受到高溫條件下的美拉德反應影響。
3 結論
鹿頭黃酒釀造用黑色和黃色高溫大曲的細菌類群存在明顯差異。相較于黃色高溫大曲來看,黑色高溫大曲細菌類群的豐度、Saccharopolyspora、Streptomyces和Bacillus的相對含量、氨基酸運輸與代謝功能、酸味和澀味明顯偏低,而揮發性芳香類化合物含量、咸味、鮮味和豐度(鮮的回味)相對強度顯著偏高。釀造用高溫大曲優勢菌群與其感官特性存在一定關聯性,其中Lactobacillus與酒曲的后味A(苦的回味)呈顯著負相關,Saccharopolyspora、Streptomyces和Bacillus均與酸味呈顯著正相關,且細菌類群與滋味指標之間的關聯性要明顯高于其與氣味指標之間的關聯性。

