嵌合信號肽提高α-淀粉酶在枯草芽孢桿菌中的分泌
張春曉,冉從國,徐志斌,王麗麗
(河北科技大學食品與生物學院,河北石家莊 050018)
重組蛋白對工業、醫療保健和可持續的生物經濟發展具有重要意義,因此,建立高質、高量蛋白質高效生產平臺很有必要[1]。枯草芽孢桿菌(Bacillussubtilis,或B.subtilis)被認為是一種生物安全菌株,并且具有遺傳穩定性高和蛋白分泌能力強等優點,常被用于細胞工廠生產工業、農業、醫藥等領域重組蛋白,如蛋白酶、淀粉酶和木聚糖酶等[2]。
枯草芽孢桿菌胞外蛋白分泌系統主要有一般分泌途徑(Sec)、雙精氨酸分泌途徑(Tat)、ABC轉運系統和非經典途徑等[3],其中大部分蛋白質以Sec途徑進行分泌。生命領域中絕大多數分泌蛋白在其N端攜帶短肽,一般含25~30個氨基酸殘基,稱為信號肽,就像全球定位系統一樣,導向靶蛋白到達最終目的地[4-6]。信號肽包含N區、H區和C區3部分[1,3-4],帶正電荷的N區,含有賴氨酸或精氨酸殘基;疏水性H區,由一連串疏水殘基組成,可能采用α-螺旋構象,在這個疏水核心區的中間,經常會出現螺旋斷裂的甘氨酸或脯氨酸殘基,從而形成一個可以插入膜的發夾狀結構;親水性C區,具有Ⅰ型信號肽酶識別位點,含Ala-x-Ala共識基序[1,3]。信號肽除了被相應的蛋白轉位酶靶向和膜易位所需要外,還對相應的靶蛋白的生物合成、折疊動力學和穩定性有額外的影響[7],信號肽的凈電荷、疏水性或長度的改變都會改變靶蛋白的分泌效率[8],且同一信號肽指導不同蛋白質的分泌效率存在很大差異[9],目前尚未建立預測靶蛋白最適信號肽的相關軟件,因此,通過信號肽庫的構建和篩選仍是提高目的蛋白分泌量的一種有效措施[9-10]。
在分析了N區正電荷數量、氨基酸組成及密碼子偏好性等方面的研究后,筆者得出,N區不像信號肽的H區和C區保守、被研究得透徹,在信號肽優化中沒有發揮主要作用[4]。信號肽C末端由形成β-螺旋的氨基酸組成,在切除位點上游具有保守的(-3,-1)規則或AXA基序,提供信號肽酶結合位點,涉及信號肽的切除[4]。盡管信號肽長度、電荷及疏水性不同,但其切除位點比較保守[4]。H區是信號肽研究的里程碑,其疏水性決定了:1)信號肽的構象及面向細胞膜的方向;2)信號肽的切除,影響蛋白質轉位速率和效率;3)信號肽的蛋白質的分泌途徑;4)蛋白質加工,如N連接的糖基化[4]。H區疏水氨基酸殘基的類型、順序和數量在不同生物中偏好性不同[4]。盡管很多研究在提高異源蛋白表達方面均對天然信號肽庫進行篩選,并獲得了較好的適合目的蛋白的信號肽[11-12],但不一定是最佳信號肽。因此,本研究以α-淀粉酶為例,將篩選得到的4種天然信號肽(SPyvcE,SPyoqM,SPBglS和SPyobB)的H區,替換SPsacB信號肽的H區,構建4種嵌合信號肽RSP1—RSP4,以期篩選出優于天然信號肽的嵌合信號肽,實現α-淀粉酶的更高效分泌。本研究有望為其他蛋白質的高效分泌提供參考。
1 材料與方法
1.1 主要材料
本研究所用質粒包括pWB-manBl(I91N/L211I)[13],構建的pWB-amyL(SPsacB信號肽指導的α-淀粉酶表達載體)、pWB-SPn-amyL(天然信號肽指導的α-淀粉酶表達載體,n代表不同天然信號肽)和pWB-RSPx-amyL(嵌合信號肽指導的α-淀粉酶表達載體,x代表1,2,3,4)。所用菌株包括實驗室保藏的解淀粉芽孢桿菌(B.amyloliquefaciens),B.subtilisDB104[14]及新構建的α-淀粉酶表達菌株B.subtilis(pWB-amyL),B.subtilis(pWB-SPn-amyL)和B.subtilis(pWB-RSPx-amyL)。引物見表1。

表1 引物種類Tab.1 Primers
1.2 試劑與儀器
Fastpfu,dNTP,DNA Marker、蛋白Marker,分析純,北京全式金生物技術有限公司提供;寡核苷酸引物,分析純,英濰捷基(上海)貿易有限公司提供;玉米淀粉(生物試劑),沈陽雷仕淀粉有限公司提供;3,5-二硝基水楊酸(DNS,生物試劑)、D-葡萄糖(生物試劑)、剛果紅染料(生物試劑)、瓊脂粉(生物試劑),北京索萊寶科技有限公司提供;酵母粉、蛋白胨和胰蛋白胨、分析純,OXOID公司提供。
ZWY-2102C振蕩搖床,上海智城分析儀器制造有限公司提供;Biometra Tone梯度PCR儀,德國耶拿公司提供;Quantity One凝膠成像系統,美國BioRad公司提供;BIFUGE STRATOS高速冷凍離心機,美國GE公司提供;SpectraMaxm i3x 多功能酶標儀,美國 Molecular Devices 公司提供;恒溫金屬浴,杭州博日科技有限公司提供。
1.3 淀粉酶基因amyL擴增及其表達載體構建
以B.amyloliquefaciens基因組為模板,BFamy-5和BFamy-2為引物,擴增amyL基因,95 ℃ 2 min;95 ℃ 20 s,61 ℃ 20 s,72 ℃ 25 s;72 ℃ 5 min,32個循環。以Vlinker-1和VBFamy-2為引物,質粒pWB-manBl (I91N/L211I)為模板擴增載體片段,95 ℃ 2 min;95 ℃ 20 s,62 ℃ 20 s,72 ℃ 1 min,32個循環;72 ℃ 5 min;再將2個PCR片段采用POE-PCR方法進行擴增,95 ℃ 2 min;98 ℃ 15 s,60 ℃ 20 s,68 ℃ 6 min;68 ℃ 10 min,35個循環。將POE-PCR產物轉化至B.subtilisDB104感受態細胞,獲得淀粉酶表達菌株B.subtilis(pWB-amyL)。
1.4 天然信號肽庫的構建及篩選
1.4.1 天然信號肽基因克隆
依據文獻報道的嗜熱脂肪芽胞桿菌(B.stearothermophilus)淀粉酶AmyS分泌效果較好的15種信號肽(SPyvcE,SPyoqM,yuaB,pelA,pelB,yoaW,yqxI,lipA,estB,yoqH,ybfO,SPsacB,SPBglS,yddT,SPyobB ybxI)[10],本研究又增加了8種常用蛋白酶信號肽(aprE,nprB,bpr,mpr,epr,nprE,vpr,wprA)以及ybxI和amyE信號肽共25種天然信號肽進行克隆。以B.subtilisDB104基因組為模板,所用引物見表1。
1.4.2 載體擴增
以pWB-amyL質粒為模板,Vsip-1和Vsip-2為引物,擴增5.2 kb載體骨架片段用于擴增α-淀粉酶載體骨架,95 ℃ 2 min;95 ℃ 20 s,55 ℃ 20 s,72 ℃ 1 min 30 s,5個循環;95 ℃ 20 s,61 ℃ 20 s,72 ℃ 1 min 30 s;72 ℃ 5 min。
1.4.3 天然信號肽與載體片段融合
天然信號肽和載體片段純化后,將天然信號肽按分子量大小分為6組,通過POE-PCR方法克隆信號肽-載體骨架多聚體[15],95 ℃ 2 min;95 ℃ 20 s,56 ℃ 20 s,68 ℃ 6 min;35個循環,68 ℃ 10 min。將POE-PCR產物轉入至B.subtilisDB104感受態細胞,獲得淀粉酶天然信號肽庫B.subtilis(pWB-SPn-amyL)。
1.4.4 天然信號肽庫的篩選
將天然信號肽庫轉化產物平鋪在剛果紅篩選培養基上,于37 ℃恒溫培養14 h進行初篩;從每組中挑取水解圈較大的10個克隆再次進行剛果紅平板復篩,水解圈較大的進行24孔板培養并測定酶活力,并從每組中選取3個酶活力較高的克隆進行測序,鑒定信號肽種類。
云小辮:鑒于該同學簽名太有個性了,編編始終沒弄明白姓甚名誰,但是能夠掌握四門語言的意絲編編還是頭一次見到。增加笑話的建議編編也會慎重考慮,畢竟編編也是很了解你們的,打開意少率先看搞笑圖片和笑話的意絲應該不在少數吧,哈哈!
1.5 嵌合信號肽庫的構建
4種嵌合信號肽RSP1—RSP4序列由北京六合華大基因科技有限公司提供,PCR擴增程序同天然信號肽。嵌合信號肽克隆所用引物為P25和P26,采用1.4.2方法構建B.subtilis(pWB-RSPx-amyL)。
1.6 重組菌株發酵
挑取每種枯草芽孢桿菌工程菌株3個單克隆于種子培養基,37 ℃ 180 r/min培養12 h;按10%比例轉接至發酵培養基,相同培養條件下繼續培養5 d,每隔1 d進行取樣測定酶活力。
1.7 α-淀粉酶活力測定
采用DNS法測定α-淀粉酶活力[16]。不同工程菌粗酶液制備:取發酵液樣品,調至相同OD600,12 000 r/min離心10 min,取上清液作為粗酶液。將玉米淀粉溶于pH 7.0的磷酸緩沖液,配制20 g/L的底物,在1.5 mL離心管中加入底物270 μL,再加入30 μL適當稀釋的粗酶液,混合均勻后放入60 ℃恒溫水浴鍋,反應10 min,取出后迅速加入600 μL的DNS試劑,混合均勻后放入100 ℃沸水浴5 min,迅速取出進行冷水浴,測定樣品540 nm吸光值。配制不同濃度的葡萄糖,與DNS試劑混勻,沸水浴5 min,測定OD540值并制備標準曲線。
1.8 信號肽結構預測
通過SigP 6.0進行信號肽N,H和C區的分析[17]。
1.9 數據處理
實驗重復3次,采用SPSS軟件進行顯著性分析,p<0.05%差異性顯著,p<0.01%差異性極顯著。應用Origin 2021軟件繪圖。
2 結果與討論
2.1 α-淀粉酶基因分析
α-淀粉酶基因擴增結果如圖1所示,泳道1所示目的條帶位置與期望的1 545 bp α-淀粉酶基因大小一致,通過POE-PCR構建載體pWB-amyL后,進行測序,結果表明與B.amyloliquefaciensα-淀粉酶基因(CP054415.1)一致性100%。該基因編碼514個氨基酸。經SigP 6.0軟件預測,前31個氨基酸為信號肽序列。
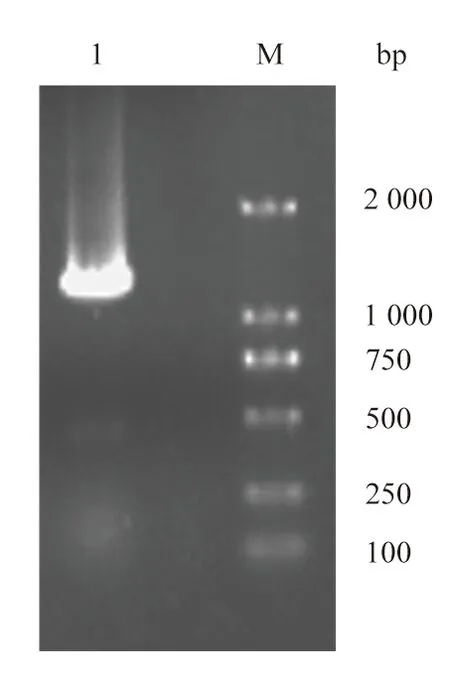
圖1 α-淀粉酶基因的PCR擴增結果Fig. 1 PCR results of α-amylase
2.2 α-淀粉酶天然信號肽庫的篩選
從每組轉化平板中挑取透明圈較大的10個單克隆進行復篩,結果如圖2所示,每個克隆所產透明圈有明顯差異,每組挑取水解圈直徑(D)與菌落直徑(d)比值較大的3個菌落,進行液體培養,測定α-淀粉酶活力,共挑取10個酶活力較高的菌株進行測序,測序結果表明,篩選得到的對α-淀粉酶分泌效率較高的天然信號肽是SPyoqM,SPyobB,SPBglS,SPsacB,nprB和SPyvcE等6種信號肽。

圖2 α-淀粉酶天然信號肽庫復篩結果Fig. 2 2nd round screening for natural signal peptide library of α-amylase

注:與SPsacB信號肽相比,*表示差異性顯著(p<0.05%);**表示差異性極顯著(p<0.01%)。圖3 不同信號肽指導的α-淀粉酶相對酶活力Fig. 3 Relative enzyme activity of α-amylase enzyme by different signal peptides
2.3 嵌合信號肽對α-淀粉酶分泌的影響
由于SPsacB是B.subtilis常用的信號肽,SigP 6.0預測結果表明其N區、H區和C區分別由MNIKKFAKQ,ATVLTFTTALL和AGGATQAFA短肽組成。本文以該信號肽為基礎,將α-淀粉酶篩選得到的胞外酶活力較高的4種天然信號肽SPyvcE,SPyoqM,SPBglS和SPyobB的H區分別替換SPsacB的H區,構建嵌合信號肽RSP1,RSP2,RSP3和RSP4(如表2所示),以期通過α-淀粉酶信號肽N區、H區和C區的強強組合,實現α-淀粉酶更加高效分泌。

表2 嵌合信號肽H區組成Tab.2 Hydrophobic region of chimeric signal peptides
結果表明,篩選得到的適合α-淀粉酶的嵌合信號肽為RSP1,其指導的胞外α-淀粉酶活力達968.5 U/mL(見圖3),較篩選的α-淀粉酶最適天然信號肽SPyoqM分泌效率提高27%;而其他嵌合信號肽RSP2,RSP3和RSP4指導的α-淀粉酶胞外酶活力約為SPsacB信號肽的10%左右。RSP1與SPsacB的N區和C區相同,僅H區不同,但RSP1指導α-淀粉酶的分泌效率是SPsacB的3.07倍;此外,盡管RSP1與SPyvcE信號肽H區相同,但RSP1指導α-淀粉酶的分泌效率為SPyvcE信號肽的4.6倍;SPyoqM與 RSP2相比,信號肽的H區相同但N區和C區不同,SPyoqM對α-淀粉酶的分泌效率是RSP2的21.9倍。SPsacB與4種嵌合信號肽對α-淀粉酶的分泌效率都達到極顯著水平(p<0.01%)。圖4 b)為發酵4 d的粗酶液電泳結果,只有嵌合信號肽RSP1指導的α-淀粉酶有明顯的55.4 kDa的目的條帶(圖中黑色箭頭所示),其他嵌合信號肽無明顯的α-淀粉酶目的條帶,與酶活力測定結果一致。應用嵌合信號肽指導外源蛋白的高效分泌報道較少,僅見對修飾的信號肽SPdsbA和SPpelB特定區域進行交換,在大腸桿菌(Escherichiacoli)中提高金黃色葡萄球菌(Staphylococcusaureus) Alpha toxinH35L的分泌[18],未見應用嵌合信號肽指導α-淀粉酶分泌的報道。
2.4 信號肽組成對蛋白分泌效率的影響
重組蛋白的產量,不僅與表達水平相關,也與轉位效率相關,而分泌機器和信號肽,決定了蛋白的分泌效率[4]。同源或異源信號肽篩選、信號肽突變等策略,是提高靶蛋白產量的有效措施[10,19-20]。YANG等[21]應用信號肽工程包括信號肽優化、對信號肽SPywbN′刪除29—45位肽段、在第4和第5位插入精氨酸R、降低H區疏水性等多項措施,并結合啟動子工程及高密度發酵,使堿性α-淀粉酶產量提高250.6倍。信號肽的變化改變了易位效率、裂解位點,甚至裂解后過程[4]。
4種嵌合信號肽RSP1—RSP4的N區和C區均來自SPsacB,僅H區不同,其氨基酸組成見表2。首先,從疏水性氨基酸殘基數目來看,RSP1和RSP3疏水性殘基均為9,而RSP2,RSP4和SPsacB的疏水性殘基個數為7,但RSP1指導α-淀粉酶的分泌效率遠高于其他信號肽,說明疏水性氨基酸殘基數目較多,分泌效率較高,這與H區疏水性降低、蛋白質的加工和轉運將變慢或完全停止結論一致[4,22]。但不是疏水性殘基越高越好,如果疏水性增加過多,大量具有非天然構象的未成熟蛋白會堵塞在轉座酶后面,不僅會減少蛋白質的分泌,還會威脅細胞的生存能力[4]。其次,從疏水性氨基酸殘基的分布來看,疏水性殘基之間插入螺旋阻斷(helix-breaker)殘基,使疏水殘基分布較均勻,優于集中分布。RSP1和RSP3的疏水性殘基數目相同,但RSP1疏水性殘基被螺旋阻斷氨基酸G或S分割為4個區域,分布較均勻,而RSP3的疏水性殘基集中分布在H區的兩端,中間僅被1個G阻斷,說明信號肽分泌效率不僅與疏水性殘基數目多少有關,還與疏水性殘基的分布相關。HAN等[18]認為高效信號肽在H區中間或C區附近具有疏水殘基,如果疏水殘基在N區附近則會降低分泌效率。DALBEY等[23]則指出,H區螺旋阻斷殘基G,P和S在H區中間的插入使信號肽形成發夾狀結構,使信號肽更容易插入膜中并被SPase切割。再次,盡管H區在蛋白分泌過程中起著舉足輕重的作用,但僅H區不能決定蛋白分泌效率。RSP1與SPyvcE的H區完全相同,但N區和C區不同,RSP1指導α-淀粉酶的分泌效率是SPyvcE的4.6倍;α-淀粉酶的最適天然信號肽SPyoqM與 RSP2相比,信號肽的H區相同但N區和C區不同,使得SPyoqM是RSP2的21.9倍。HAN等[18]也認為H區疏水殘基與另外2個區域之間存在相互作用。總之,信號肽N,H和C區甚至目的蛋白之間與分泌機器共同作用,最終決定了靶蛋白的分泌效率。
3 結 語
本文提出將不同來源的天然信號肽N,H和C區進行組合構建嵌合信號肽的理念,且嵌合信號肽RSP1指導的α-淀粉酶分泌效率較最適天然信號肽SPyoqM提高了27%,表明嵌合信號肽是有效提高α-淀粉酶產量的一種方法。本研究對其他蛋白的高效分泌具有指導意義。枯草芽孢桿菌中蛋白分泌過程涉及多個環節和多種蛋白質,其中信號肽對目的蛋白分泌有著重要影響,但是,目前尚沒有一種確定的信號肽能夠指導任意靶蛋白的高效分泌,因此,需要對更多信號肽與靶蛋白分泌效率的數據進行分析,建立信號肽結構/序列與靶蛋白結構/序列之間的關聯,開發靶蛋白分泌效率的信號肽預測軟件,提高分泌效率和蛋白產量。

