基于網絡藥理學結合分子動力學模擬探究七氣消聚散治療肝硬化的作用機制
陳依虹,鄒山揚,譚靖怡,楊亞軍,3,陳 妹,吳郴鳳,吳民華(.廣東醫科大學第一臨床醫學院,廣東湛江 5403;.廣東醫科大學藥學院,廣東湛江 5403;3.廣東天然藥物研究與開發重點實驗室,廣東湛江 5403;4.廣東醫科大學基礎醫學院,廣東湛江 5403)
肝硬化(cirrhosis)是常見的消化系統疾病,肝臟在各種病因的刺激下發生炎癥,纖維組織持續增生,形成假小葉及再生結節,造成肝臟結構改變[1]。正常肝臟具有很強的再生能力,其再生潛力因炎癥和纖維化積累而降低。持續的炎癥和缺氧主要通過刺激病理性血管生成和血管重構促進肝臟纖維化進而發展為肝硬化[2-3]。肝硬化早期可通過干預獲得一定程度的緩解,晚期只能通過肝移植來治愈[4]。抗纖維化以及抗炎等治療有助于控制肝硬化的發展[2-3]。目前尚無高效且無明顯不良反應的藥物用于治療肝硬化。中醫治療主要通過中藥復方、中成藥、單味藥來發揮作用,在肝硬化治療中表現出了明顯優勢[5]。中醫辨證治療多靶點、不良反應小的優點使其成為近年研究的熱點[6]。
七氣消聚散源于《雜病廣要》,由香附、枳殼、三棱、青皮、莪術、木香、陳皮、厚樸、砂仁、甘草10 味藥組成,主治因積聚相攻,或疼或脹初起者。積聚,中醫指腹內積塊,或脹或痛的一種病癥,相當于西方醫學中的肝脾腫大等,故七氣消聚散可用于硬化治療。中醫治療肝纖維化或肝硬化,采用的方法主要為清熱祛濕、活血祛瘀、軟堅散結、疏肝理脾、滋補肝腎[6]。香附主治胸腹脅肋脹痛、氣郁不舒、氣滯不通,青皮有疏肝破氣、散結消痰的功效。七氣消聚散中三棱有消積作用,能利水利濕、通經絡,枳殼能消積、祛風濕、行氣。
運用網絡藥理學、分子對接技術探究疾病與中醫藥間的聯系是目前的研究熱點[7]。本文以網絡藥理學結合分子對接和分子動力學模擬為基礎,挖掘七氣消聚散抗肝硬化的有效成分、作用靶點及潛在通路,為其后續研究和臨床使用提供參考。
1 資料和方法
1.1 七氣消聚散活性成分及靶點的收集
通過限制口服生物利用度(OB)≥30%和類藥性(DL)≥0.18 的條件,在TCMSP(https://old.tcmsp-e.com/tcmsp.php)中收集了七氣消聚散中所有中藥的活性成分及其對應的靶點蛋白。我們使用UniProt 數據庫(https://www.uniprot.org/)將這些靶點蛋白轉換為標準基因名。
1.2 肝硬化靶點整理
搜索關鍵詞為“Cirrhosis”疾病靶點,在GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、TTD(http://db.idrblab.net/ttd/)、DrugBank(https://www.ncbi.nlm.nih.gov/gene)和DisGeNet(https://www.disgenet.org/search)數據庫中進行。
1.3 交集靶點的篩選
使用R 軟件將肝硬化和七氣消聚散作用靶點取交集,輸出Venn圖,收集七氣消聚散與肝硬化的共同靶點。
1.4 中藥活性成分-靶點網絡的構建
使用55 個共同靶點,推導出對應的活性成分和中藥,并在Cytoscape_3.9.1 軟件中建立活性成分-靶點網絡。
1.5 蛋白互作網絡(PPI)構建及核心靶點篩選
使用 STRING 數據庫(https://string-db.org/),篩選物種為 Homo sapiens,篩選靶點置信度為 0.70 或以上的藥物與疾病的共同靶點,建立 PPI 網絡。在Cytoscape_3.9.1 中使用 CytoNCA 插件進行可視化分析。
1.6 基因本體(GO)和京都基因與基因組百科全書(KEGG)富集分析
使用R 語言和Bioconductor 數據庫中的“org.Hs.eg.db”“clusterProfiler”“DOSE”“enrichplot”和“stringi”,對肝硬化和七氣消聚散的相交靶點進行GO 和KEGG 功能富集分析,設定P值和Q 值均為0.05。
1.7 GEO 數據集靶點驗證
以“liver Cirrhosis”“LC”為關鍵詞在GEO(生物技術信息基因表達綜合數據庫https://www.ncbi.nlm.nih.gov/geo)進行搜索,限定物種為“Homo sapiens”。將數據集編號為GSE77627 的數據下載,GSE77627共有 36 例樣本,包括肝硬化患者樣本22 例、對照組樣本14 例。下載GSE77627 數據集的原始數據文件,含平臺文件和序列探針矩陣文件。以平臺注釋文件為基礎對探針進行注釋,把探針矩陣轉化為基因矩陣。利用R4.2.1 版本和相關軟件包對數據來源進行標記,取PPI網絡核心基因的基因矩陣,利用limma包計算基因表達差異的P值,得到核心基因的箱線圖。
1.8 分子對接及分子動力學模擬
從 PubChem(https://pubchem.ncbi.nlm.nih.gov/)數據庫得到活性成分的 2D 結構文件,然后使用 Chem3D 軟件將其轉換為最小自由能的 3D 空間構象的 .mol2 格式。前往 UniPort 數據庫(https://www.uniprot.org/),將 Popular organisms 設定為 Human,找到與核心靶點對應蛋白的 PDB Entry,并在 PDB 數據庫(http://www.rcsb.org/)中下載對應的 3D 晶體結構。使用 PyMol 軟件和 AutoDockTools-1.5.7 軟件對活性成分的 3D 空間構象和核心靶點對應蛋白的 3D 晶體結構做預處理,并使用 AutoDockTools-1.5.7 對核心靶點與七氣消聚散主要活性成分槲皮素、異鼠李素、木犀草素、柚皮素等進行分子對接操作。最后,使用PyMOL 軟件展示對接結果。
對接后,發現木犀草素與CCND1 結合最為穩定,使用分子動力學模擬CCND1 和木犀草素的復合物,測量其穩定性及靈活性。利用GROMACS2020.6 軟 件包、charmm36 力場和TIP3P 水模型來做分子動力學模擬。為使該系統總電荷中性,加入對應數目的鈉離子取代水分子得到合適大小的溶劑盒。進一步將周期邊界條件(PBC)用在系統的3 個方向。利用 charmm 36 力場,從Sobtop[Tian Lu,Sobtop,Version 1.0(dev3),http://sobereva.com/soft/Sobtop]得到木犀草素的力場參數。最開始,整個系統50 000 步的能量在310 k時被最小化(EM)。通過位置約束的MD模擬,以及通過NVT(粒子的數目、體積和溫度恒定)和NPT(粒子的數目、壓力和溫度恒定),得到受體、配體和溶劑的平衡。通過對體系的均方根偏差(RMSD)和原子位置的均方根波動(RMSF)做分析,均方根偏差可以反映體系里的分散程度來表現復合物的穩定性,均方根波動可以反映某一個原子相對于參考構象的結構變化來表明原子的靈活性。
2 結果
2.1 七氣消聚散活性化學成分和靶點篩選
在TCMSP數據庫以OB≥30%、DL≥0.18 為條件篩選后得到青皮靶點110 個、三棱靶點140 個、香附靶點496 個、枳殼靶點123 個,經UniProt數據庫進行ID轉換后共得到靶點303 個。
2.2 肝硬化相關靶點及交集靶點的篩選
從 GeneCards 數據庫(score=1)、OMIM、TTD、DrugBank 和 DisGeNet 數據庫中收集肝硬化靶點基因,共得到 2 500 個基因(圖1)。利用 venn 圖與七氣消聚散取交集,篩選得到 55 個共同靶點基因(圖2)。
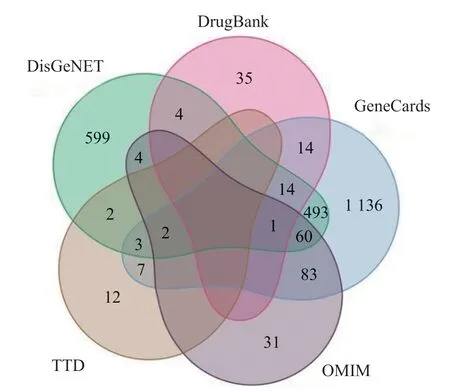
圖1 5 個疾病數據庫的肝硬化基因
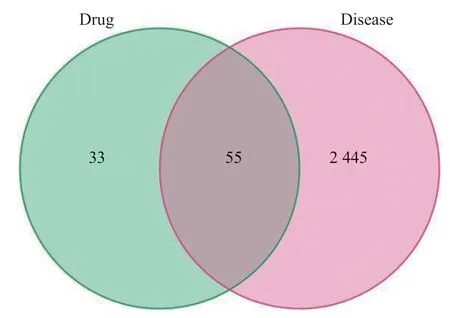
圖2 七氣消聚散-肝硬化靶點基因匹配情況
2.3 藥物-活性成分-疾病靶點網絡構建和關鍵活性成分分析
在Cytoscape_3.9.1 軟件中,利用55 個共同的靶點構建了活性成分和疾病靶點網絡(圖3)。
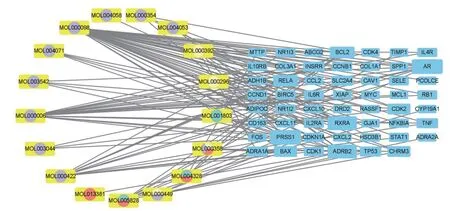
圖3 七氣消聚散關鍵活性成分-肝硬化靶點網絡圖
左側圓形節點表示活性成分,圓形節點的不同顏色代表不同活性成分,三棱為黃色、青皮為青色、香附為香芋紫、枳殼為紅色;右側藍色方形節點表示潛在作用靶點。
2.4 PPI 網絡的構建及核心靶點的篩選
運用 STRING 數據庫,選擇“high confidence:0.70”模式下對 55 個藥物-疾病交集靶點構建蛋白互作網絡(圖4),得到55 個節點,145 條邊,平均節點度值 5.27。通過 Cytoscape_3.9.1 軟件分析中心性(DC)、介度中心性(BC)、特征向量中心性(EC)、緊密中心性(CC)、網絡中心性(NC)和基于局部平均連通性的方法(LAC)拓撲參數,以大于中位值的基因為篩選條件,第一次篩選得到45 個基因,第二次篩選得到15 個基因,其中核心基因為4 個,分別為MYC、CCND1、RELA和TP53(圖5)。
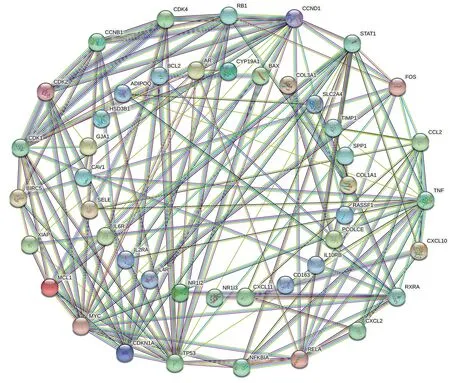
圖4 交集基因的蛋白互作網絡
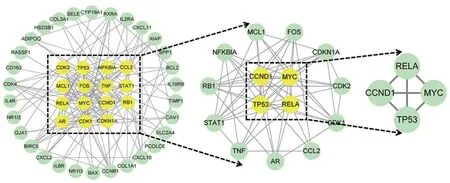
圖5 七氣消聚散-肝硬化的核心靶點
2.5 GO功能富集分析
GO 分析結果(圖6)顯示七氣消聚散方治療肝硬化主要涉及肽應答和細胞因子介導的信號通路等生物過程(biological process,BP),涉及的細胞組成(cellular component,CC)包括轉錄調節復合物、質膜外側面,影響的分子功能(molecular function,MF)主要集中在DNA 結合轉錄因子結合、RNA 聚合酶 II 特異性 DNA結合轉錄因子結合等方面。
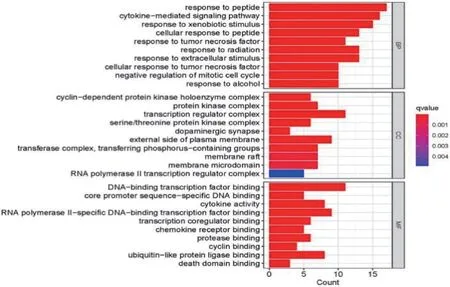
圖6 七氣消聚散作用靶點 GO 生物學過程富集分析
2.6 KEGG富集分析
KEGG 富集分析顯示前30 條通路(P<0.05,圖7),主要涉及乙型/丙型肝炎及P53、PI3K/AKT信號通路。上述途徑可能與七氣消聚散干預肝硬化的發生發展有關。
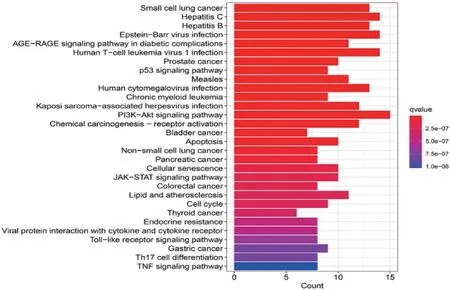
圖7 七氣消聚散作用靶點 KEGG富集分析
2.7 利用基因芯片進行核心基因的表達分析
下載GSE77627 數據集,經過篩選得到正常肝組織和肝硬化組織的差異表達基因,差異基因與核心基因取交集,圖8 顯示七氣消聚散的4 個核心靶點在癌和癌旁間的表達具有差異,其中CCND1 及RELA的表達差異最為顯著(P值均<0.001),CCND1 和RELA可能為七氣消聚散治療肝硬化的潛在關鍵靶基因。
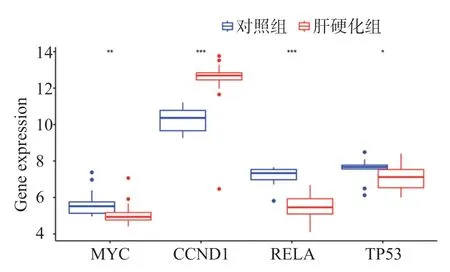
圖8 GEO芯片核心靶基因箱線圖
2.8 分子對接驗證及分子動力學分析
將肝硬化核心靶點蛋白(MYC、RELA、CCND1、TP53)與七氣消聚散主要活性成分槲皮素、異鼠李素、山奈酚、木犀草素、柚皮素、川陳皮素進行分子對接。
結果顯示最低結合自由能皆低于0 kCal/mol。其中,木犀草素與靶點蛋白CCND1(圖9A)、槲皮素與靶點蛋白CCND1(圖9B)、柚皮素與靶點蛋白RELA(圖9C)的結合穩定,分別為-7.38、-7.10、-6.81 kCal/mol,最低結合自由能皆低于-5 kCal/mol。分子對接結果用pymol 可視化后見圖9。進一步使用分子動力學技術模擬木犀草素與 CCND1 復合物的穩定性和靈活性,獲得CCND1 和木犀草素在蛋白質上RMSD 和RMSF的結果。發現和首幀比較,CCND1 與木犀草素在時間為80 ns的模擬中,在 12 ns達到平衡,表明CCND1 和木犀草素的體系迅速到達穩定狀態以及未出現過多的波動(圖10A)。RMSF 的值位于0.1~1.20 nm 的范圍內(圖10B),其中殘基GLY160 的RMSF值是0.1 nm,表示氫鍵發揮限制GLY160 的效果。
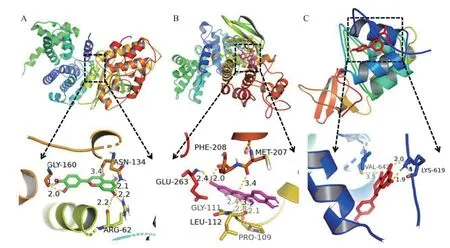
圖9 分子對接結果可視化圖
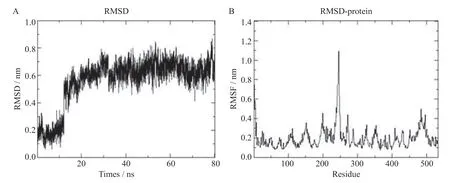
圖10 分子動力學模擬木犀草素-CCND1 活性位點的結合模式
3 討論
3.1 肝硬化治療現狀
肝硬化目前是全球第11 大最常見的死亡原因[8]。肝硬化分為代償期和失代償期,代償期肝硬化的治療目標是減緩、停止或逆轉纖維化進展為失代償期,而失代償期肝硬化的重點是防止進一步失代償和死亡。
肝硬化與肝纖維化關系緊密,肝纖維化如果未得到及時治療或控制,會逐漸發展成為肝硬化,早期發現和阻斷肝纖維化被認為是治療肝硬化的重要方法之一。有多種途徑會促進纖維化的發生,如肝細胞的凋亡與壞死、肝星狀細胞(HSC)活化、巨噬細胞、淋巴細胞的募集[8]。其中HSC活化是肝纖維化的中心環節[9],抗HSC及抑制巨噬細胞是抗肝纖維化/肝硬化的重要方法。在現代醫學尚無有效抗肝纖維化、肝硬化藥物的困境下[10],中醫藥特有的理論及防治經驗,在改善臨床癥狀、阻止及逆轉肝纖維化、預防及治療并發癥方面有獨特優勢,中醫藥辨治肝硬化發展前景良好[11]。中醫藥多成分、多靶點、多通路特點或許是治療肝硬化的突破點[12]。
3.2 七氣消聚散及其有效成分抗肝硬化作用
肝硬化的治療策略主要包括抑制肝臟炎癥反應、促進肝細胞再生、改善肝臟代謝異常以及阻止肝纖維化進展4 個方面。香附的功效是治療肝郁氣滯,在七氣消聚散中以香附作為君藥治療肝硬化。香附多糖已被證實能有效緩解機體炎癥反應、改善氧化應激,并在動物實驗中可有效改善大鼠肝臟纖維化程度[13]。莪術的主要活性成分莪術醇已被證實抑制 TGF-β1/Smad信號通路的活動來發揮抗肝纖維化的作用機制[14]。在三棱莪術顆粒聯合西藥治療肝硬化腹水的研究中,三棱-莪術的聯合使用減少腹水及肝損傷,通過化瘀、破氣消積聚等功效有效改善肝硬化患者的預后[15]。
七氣消聚散的有效成分包括柚皮素、槲皮素、異鼠李素、山奈酚、木犀草素、川陳皮素等。在抗肝纖維化上,槲皮素通過影響TGF-β1/Smads 和PI3K/Akt 通路來減少自噬[16],山奈酚則通過抑制Jag1 水平[17],兩者皆通過抑制肝星狀細胞活化來發揮作用。在抗炎和抑制氧化應激上,槲皮素也發揮著重要作用,通過降低肝臟脂質積累來改善代謝紊亂[18]。在降低機體炎癥反應上,柚皮素通過下調肝巨噬細胞和肝細胞中的NLRP3/NF-κB 信號通路減弱了炎癥對小鼠下肝臟的刺激[19],木犀草素除可抑制NF-κB通路外[20],還通過抑制AKT/mTOR/ p70S6K 和TGF-β/Smad 信號通路減輕肝纖維化[21]。在非酒精性脂肪性肝炎(NASH)小鼠模型中,異鼠李素可改善脂肪變性、抑制肝膠原沉積和減少肝細胞凋亡[22]。川陳皮素在喂食高脂飲食的小鼠中,表現出抑制肝脂肪變性和血脂代謝異常的作用[23]。本研究發現,柚皮素、槲皮素及木犀草素與CCND1和RELA 靶點的結合穩定。我們推測七氣消聚散對NF-κB 信號通路的關鍵轉錄因子RelA(p65)進行調控[24],通過抑制炎癥阻止肝硬化的進行性加重,并可通過CCND1 調節細胞 G1/S 期的轉換來促進肝細胞的再生[25]來保護肝功能。
3.3 研究結果和研究價值分析
網絡藥理學通過建立藥物-靶點-通路等多層網絡,可以快速準確地預測藥物作用的目標和機制,我們通過建立七氣消聚散有效成分與肝硬化疾病的共同靶點,挖掘出七氣消聚散可能通過肝硬化疾病網絡核心靶點MYC、TP53、CCND1、RELA 發揮抗肝硬化的效果。在篩選過程中發現,柚皮素、槲皮素、木犀草素與核心基因CCND1 及RELA的分子對接中結合能低,成鍵穩定。其中木犀草素與CCND1 的結合最穩定。
分子動力學模擬是一種計算模擬方法,用于研究分子的運動、結構和相互作用,可以獲取原子的運動軌跡,還可以觀察到原子運動過程中各種微觀細節[26]。本研究利用分子動力系模擬對木犀草素與CCND1 的結合進行更深入的研究,結果顯示木犀草素與CCND1 具有良好的結合能力,提示木犀草素可調控細胞周期。
通過分析GEO芯片結果,我們發現核心靶點基因CCND1、RELA等在正常組織和肝硬化組織間存在表達差異,這提示七氣消聚散可能通過其有效成分影響核心靶點基因發揮抗肝硬化的功效,這些核心靶點基因在肝硬化中發揮的作用值得進行深入研究。研究表明,PI3K/Akt 和P53 通路通過對細胞外基質(ECM)降解的作用影響HSC增殖和HSC凋亡,從而影響肝纖維化的發生和進展[27-28]。本研究KEGG 富集分析表明七氣消聚散可調節PI3K/AKT、P53 信號通路,七氣消聚散可能通過影響這些通路治療肝硬化。
本研究以七氣消聚散治療積聚為基礎,借助網絡藥理學、分子對接、分子動力學模擬及生物信息學分析,結果提示七氣消聚散可通過抗炎、影響細胞凋亡發揮抗肝硬化的作用。本研究為七氣消聚散治療肝硬化的實驗和臨床研究提供了理論依據。

