南柴胡多糖理化性質及拮抗白細胞黏附研究
羅幸凱,黃麗麗
南柴胡多糖理化性質及拮抗白細胞黏附研究
羅幸凱,黃麗麗
寧波市醫療中心李惠利醫院藥學部,浙江寧波 315000
探究南柴胡多糖(polysaccharide,BP)的理化性質、溶液高級構象及拮抗P-選擇素介導的細胞黏附能力。采用水提醇沉法制備BP,利用化學法(苯酚硫酸法、間羥基聯苯法、Bradford法)、高效液相色譜、傅里葉紅外光譜、剛果紅染色和圓二色譜分析BP的理化性質及溶液高級構象,利用細胞黏附和蛋白互作實驗評價BP拮抗P-選擇素介導的細胞黏附活性。BP是相對分子質量為36.44kDa的酸性雜多糖,糖醛酸含量為19.33%,由鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖5種單糖組成;BP在溶液狀態下,不存在三股螺旋結構,分子具有明顯的不對稱性,但不對稱性受濃度和溫度影響;BP顯著抑制P-選擇素介導的HL-60與CHO-P細胞的黏附,并阻斷P-選擇素與P-選擇素糖蛋白配體1(P-selectin glycoprotein ligand 1,PSGL-1)的相互作用。BP是由5種單糖組成的酸性多糖,能阻斷P-選擇素介導的白細胞黏附作用,具有開發成為新型抗炎藥物的潛力。
南柴胡;多糖;理化性質;溶液構象;P-選擇素;抗炎
柴胡是一味傳統中藥材,始載于《神農本草經》,至今已有上千年歷史。《中國藥典》2020年版規定本品為傘形科(北)柴胡(DC.)或狹葉(南)柴胡(Willd.)的干燥根,具有疏散退熱、疏肝解郁、升舉陽氣等功效[1]。南柴胡廣泛分布于內蒙古、江蘇、安徽等地區,主要含有黃酮類、皂苷類、多糖類等活性化合物,具有抗炎、鎮痛、解熱、保肝等藥理活性[2-3]。但關于南柴胡多糖(polysscharide,BP)的高級構象及其抗炎活性的研究報道較少,為豐富BP的結構信息、發掘其生物活性,本研究運用多種化學和光譜分析方法揭示BP的理化性質及溶液高級構象,并利用靜止黏附、平行板流動小室和體外蛋白互作實驗評價其拮抗P-選擇素介導的白細胞黏附能力,為促進南柴胡資源的開發利用提供理論基礎。
1 材料與方法
1.1 BP的制備
采用水提醇沉法制備BP。取適量脫脂南柴胡粉末,沸水浸提3次(:=1 : 20),每次3h。合并提取液,過濾,減壓濃縮。濃縮液中緩慢滴加95%乙醇至終濃度為80%,4℃靜置過夜,經離心處理后收集沉淀,真空冷凍干燥。采用反復凍融法和Sevag法除去蛋白質,得BP。
1.2 理化性質分析
采用苯酚-硫酸法測定糖含量;采用間羥基聯苯法測定糖醛酸含量;蛋白含量測定采用考馬斯亮藍法;采用TENSOR27型傅里葉變換紅外光譜儀(德國Bruker公司),在4000~400cm–1波長范圍內進行掃描;利用Lambda 750紫外全波長掃描儀(美國PerkinElmer公司)在190~900nm波長范圍內掃描多糖樣品;采用高效液相色譜法測定BP的相對分子量。以不同分子量的葡聚糖標準品繪制標準曲線,將多糖樣品的保留時間代入標準曲線,即得重均分子量;采用柱前衍生化及反相高效液相色譜法對單糖組成進行分析。首先將多糖樣品進行酸水解,產物經1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl- 5-pyrazolone,PMP)衍生化后進樣,對比各單糖標準品衍生物的保留時間及峰面積,確定BP的單糖組成及摩爾比。
1.3 溶液高級構象分析
將剛果紅試劑和BP配制成不同濃度(0~0.5mol/L)的NaOH溶液,在200~600nm范圍內,進行紫外-可見全波長掃描,測定溶液的最大吸收波長λmax,以去離子水代替BP溶液作為對照。
采用Chirascan圓二色譜儀(英國Applied Photophysics公司)測定不同濃度和溫度下BP溶液構象。檢測條件為掃描波長范圍190~400nm,帶寬1.0nm,步進值1.0nm。
1.4 拮抗P-選擇素介導的細胞黏附能力分析
1.4.1 細胞培養 中華倉鼠卵巢(Chinese hamster ovary,CHO)細胞和人早幼粒白血病細胞(human myelocytic leukemia,HL-60)細胞購置于中科院上海細胞庫。通過將全長人P-選擇素載體轉染到CHO細胞中,獲得穩定表達P-選擇素的CHO-P細胞。所有細胞均培養于Iscove Modified Dulbecco Media培養基,培養基中補充10%熱滅活的胎牛血清,100units/ml青霉素和100 μg/ml鏈霉素,培養箱環境設置為37℃和5%CO2濃度。
1.4.2 靜止黏附實驗 將CHO-P或CHO細胞接種到24孔板中過夜形成單層,分別與P-選擇素阻斷型抗體9E1、非阻斷型抗體AC1.2及BP(100μg/ml和200μg/ml)于37℃孵育30min。將HL-60細胞用鈣調蛋白-AM(5μm)進行熒光標記,并加入到CHO-P或CHO單層細胞中孵育1h。磷酸鹽緩沖液(phosphate buffered saline,PBS)洗滌4次后,使用熒光酶標儀測量各孔熒光強度。
1.4.3 平行板流動小室實驗 平行板流室分析BP阻斷HL-60細胞和CHO-P單層細胞動態相互作用的能力。將CHO和CHO-P細胞分別接種在35mm培養皿中過夜形成細胞單層,分別加入9E1、AC1.2和BP(100μg/ml和200μg/ml),37℃孵育30min。將培養皿組裝在平行板流動室(Glycotech公司,美國),并安裝在倒置顯微鏡上進行觀測。用PBS洗滌后,將HL-60細胞注入流動小室,并通過CCD隨機選擇視野記錄3min。利用NIH ImageJ軟件計算在CHO或CHO-P細胞上滾動的HL-60細胞數量和相對滾動速度。
1.4.4 體外蛋白結合測定 重組人P-選擇素/Fc嵌合蛋白(P-Fc,2μg)與20μl Protein G瓊脂糖凝膠在4°C下孵育1h后,加入BP(100μg/ml和200μg/ml)繼續孵育1h。HL-60細胞經細胞裂解液冰上裂解30min,于4°C環境中以8000轉/min的速度離心15min,將裂解液上清與包被P-Fc的Protein G凝膠孵育2h,經離心反復洗滌后,加入上樣緩沖液并沸騰,免疫印跡法檢測P-選擇素糖蛋白配體1(P-selectin glycoprotein ligand 1,PSGL-1)及P-選擇素含量,使用ImageJ軟件對條帶灰度值進行量化分析。
1.5 統計學方法
2 結果
2.1 BP的理化性質分析
采用水提醇沉法獲得BP,收率為12.8%,BP的總糖含量為96.43%,其中糖醛酸含量為19.33%,而蛋白含量僅占0.33%,同時260nm和280nm處無吸收峰(圖1A),表明BP中蛋白被有效除去。BP的相對分子質量為36.44 kDa,是由5種單糖組成的酸性雜多糖:鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖,摩爾比為0.23∶0.40∶1.00∶0.22∶0.32(圖1B)。
BP的紅外光譜結果如圖1C所示。3384cm–1處為分子內羥基伸縮振動,為多糖的特征吸收峰;2931cm–1處的較弱吸收峰為C-H的伸縮振動;1746cm–1和1612cm–1吸收峰是由C=O和COO-的伸縮振動引起;1412cm–1處有吸收峰,表明存在糖醛酸;1100~1020cm–1區間及765cm–1的吸收峰表明單糖殘基以吡喃環形式存在;831cm–1處的吸收峰,表明存在α-糖苷鍵。
2.2 BP的溶液高級構象分析
剛果紅能夠與具有三股螺旋構象的多糖形成絡合物。在一定NaOH濃度范圍,三股螺旋構象可通過可見光譜中最大吸收波長的紅移來確定。與剛果紅對照組相比,隨著NaOH濃度的增加,剛果紅-BP配合物的最大吸收波長均未發生紅移(圖1D),說明BP中不存在三股螺旋結構。
圓二色譜(circular dichroism,CD)可靈敏地反映生物分子的空間結構。在水溶液中,由于多糖分子之間存在相互作用,導致分子發生纏繞、折疊等無規則卷曲,使其產生不對稱性,從而在CD譜上呈現明顯Cotton效應[4]。不同濃度BP的溶液構象如圖1E所示,改變濃度并未影響BP的峰形,但振幅強度發生了顯著的變化,隨著BP濃度的增加,200nm附近的吸收峰及負Cotton效應均大幅度增強,說明濃度升高會增加BP分子的不對稱性。這可能是由于隨著BP濃度的增加,多糖分子鏈間的作用力增強,從而使多糖分子鏈之間發生聚集和纏繞。溫度對BP溶液構象有一定影響(圖1F),當測定溫度達到55℃時,BP的CD譜峰型發生偏移,并且Cotton效應增強、負Cotton效應減弱。多糖溶液構象受多糖分子間和分子內的氫鍵鍵合這種典型的熱力學行為影響[5]。因此,BP溶液構象的改變極有可能是由于維系分子構象行為的氫鍵發生斷裂所致。

圖1 BP的理化性質及溶液構型分析
A.紫外可見光掃描圖譜;B.單糖組成分析;C.紅外光譜圖;D.剛果紅實驗;E.圓二色譜(不同濃度);E.圓二色譜(不同溫度)
2.3 拮抗P-選擇素介導的白細胞黏附能力
BP在100μg/ml和200μg/ml的濃度下,均可顯著抑制HL-60和CHO-P細胞之間的靜態黏附作用,黏附細胞比例分別下降到34.7%和11.3%,200μg/ml BP組的抑制作用接近P-選擇素阻斷型抗體9E1,見圖2A。利用平行板流小室評價BP在動態條件下抑制細胞滾動黏附的作用效果。BP處理顯著減少CHO-P細胞單層上滾動黏附的HL-60細胞比例,在100μg/ml和200μg/ml濃度作用下分別減少到40.2%和6.2%,200μg/ml BP組與阻斷型單抗9E1的抑制效果接近(>0.05),圖2B。另外,使用NIH ImageJ軟件計算HL-60細胞的相對滾動速度(圖2C),由于BP處理可抑制細胞間的黏附作用,與對照組相比,BP處理后HL-60細胞的相對滾動速度顯著增加。

圖2 BP拮抗P-選擇素介導的白細胞黏附能力
A.靜止黏附細胞比例;B.滾動黏附細胞比例;C.相對滾動速度
注:CHO-P:穩定表達P-選擇素的CHO細胞;與對照組比較,*<0.001
PSGL-1是白細胞特異性表達的糖基化蛋白,是P-選擇素介導白細胞在血管內皮起始招募和滾動黏附的重要生理配體。P-選擇素與PSGL-1展現出較高的親和力,而經過BP處理后,P-選擇素與PSGL-1之間的相互作用明顯減弱,100μg/ml和200μg/ml BP組分別降低55.3%和90.3%,見圖3。上述結果表明,BP通過直接阻斷P-選擇素與PSGL-1之間的相互作用來抑制P-選擇素介導的白細胞黏附作用。
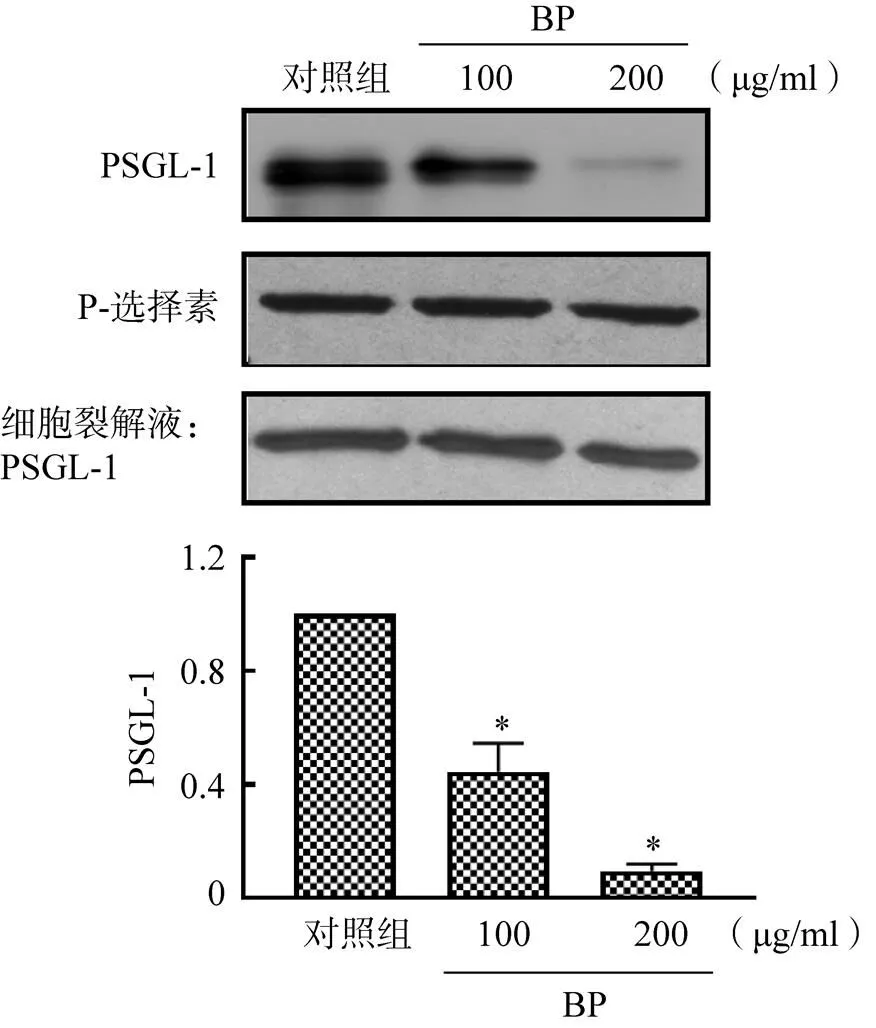
圖3 BP阻斷P-選擇素與PSGL-1的相互作用
注:與對照組比較,*<0.001
3 討論
中藥南柴胡為傘形科狹葉柴胡的干燥根,味苦,性寒,歸肝、膽經,在臨床上廣泛應用于抗炎治療。現代醫學研究發現,其主要活性成分為柴胡皂苷、黃酮類、柴胡多糖等。本研究采用水提醇沉法制備的BP是由鼠李糖、半乳糖糖醛酸、葡萄糖、半乳糖及阿拉伯糖等組成的酸性雜多糖,摩爾比為0.23 : 0.40 : 1.00: 0.22 : 0.32。肖炳坤等[6]發現北柴胡多糖中單糖組分主要是阿拉伯糖和半乳糖,分別占比46.0%和34.5%,還含有少量的鼠李糖、半乳糖醛酸和木糖等單糖成分。顏軍等[7]從產自于四川省的柴胡中提取分離柴胡多糖,由木糖、鼠李糖、半乳糖、葡萄糖和阿拉伯糖5種單糖組成,其摩爾比為1.00 : 2.19 : 2.27 : 2.44 : 3.21。由此得出,不同產地和不同屬的柴胡在單糖組成上存在一定的差異。
多糖的生物活性與其溶液高級空間構象密切相關[8]。β-(1-3)-D-葡聚糖的免疫調節活性被認為與其三股螺旋結構有關,當其變性后,免疫調節功能也隨之消失[9]。因此,對多糖高級結構的研究將有助于闡釋其構效關系。多糖在溶液中的構象特征包括多糖分子的尺寸、形態、剛性/柔順性、無規線團、單股螺旋、雙股螺旋和三股螺旋等[8]。盡管目前對柴胡多糖分子的一級結構已有一定了解,但空間構象、溶液行為及聚集態結構的研究在國內外鮮有報道。本研究通過剛果紅實驗和CD技術,探究BP的溶液行為,豐富BP的溶液高級構象信息。
中藥多糖在炎癥發生、發展的多個階段均可展現抗炎能力,如抑制炎癥信號傳導,減少促炎細胞因子釋放,阻止白細胞的黏附和浸潤[10]。作為重要的細胞黏附分子,P-選擇素參與活化的血管內皮對中性粒細胞的招募及黏附作用,在炎癥發生、發展中起至關重要的作用[11]。因此,干預P-選擇素介導的細胞黏附成為治療炎癥相關疾病的潛在策略。P-選擇素與其生理配體的結合可被多種天然多糖拮抗[12-13]。在本研究中BP作為P-選擇素高親和力配體以拮抗其與PSGL-1的結合,阻斷白細胞與血管內皮的識別與黏附,表明其具有開發成為抗炎功效的新型醫藥產品的潛質。然而,由于BP的復雜化學組成與高級構象,其構效關系仍不清楚。后續研究中有必要表征BP的精細結構并進行位點特異性修飾,以揭示BP與P-選擇素的分子識別和相互作用模式。
[1] 國家藥典委員會. 中華人民共和國藥典[M]. 北京: 中國醫藥科技出版社, 2020: 293.
[2] 黃涵簽,王瀟晗, 付航, 等. 柴胡屬藥用植物資源研究進展[J]. 中草藥, 2017, 48(14): 2989–2996.
[3] 李艷鳳, 劉雅舒, 李艷生. 柴胡的化學成分與藥理作用研究進展[J]. 西北藥學雜志, 2022, 37(5): 186–192.
[4] 王小梅, 王妙, 薛紅杰, 等. 熱水提取與超聲提取的麥冬多糖結構與構象特征的比較研究[J]. 分析測試學報, 2018, 37(1): 23–30.
[5] 張繼賢. 亞臨界水萃取溫度對香菇多糖化學結構、鏈構象轉變及生物活性的影響研究[D]. 鎮江: 江蘇大學, 2021.
[6] 肖炳坤, 駱傳環, 黃榮清, 等. 氣相色譜法測定柴胡多糖的組分[J]. 生命科學儀器, 2005, 3(3): 34–35.
[7] 顏軍, 劉嵬, 鄔曉勇, 等. 柴胡多糖的分子量測定及單糖組成分析[J]. 安徽農業科學, 2010, 38(9): 4550–4552.
[8] PATEL B K, CAMPANELLA O H, JANASWAMY S, et al. Impact of urea on the three-dimensional structure, viscoelastic and thermal behavior of iotacarrageenan[J]. Carbohydr Polym, 2013, 92(2): 1873–1879.
[9] CASTRO D M E, CALDER P C, ROCHE H M. β-1,3/1,6-glucans and immunity: State of the art and future directions[J]. Mol Nutr Food Res, 2021, 65(1): e1901071.
[10] HOU C, CHEN L, YANG L, et al. An insight into anti-inflammatory effects of natural polysaccharides[J]. Int J Biol Macromol, 2020, 153: 248–255.
[11] ZINELLU A, MANGONI A A. Systematic review and meta-analysis of the effect of statins on circulating E-selectin, L-selectin, and P-selectin[J]. Biomedicines, 2021, 9(11): 1707.
[12] WU S Y, LIU J, ZHANG Y, et al. Structural characterization and antagonistic effect against P-selectin-mediated function of SFF-32, a fucoidan fraction from[J]. J Ethnopharmacol, 2022, 295: 115408.
[13] WU S Y, ZHANG X, LIU J, et al. Physicochemical characterization offucoidan fractions and their antagonistic effect against P-selectin-mediated cell adhesion[J]. Int J Biol Macromol, 2019, 133: 656–662.
Physicochemical properties and antagonistic capacity against cell adhesion of polysaccharide isolated from
Department of Pharmacy, Ningbo Medical Center Lihuili Hospital, Ningbo 315000, Zhejiang, China
To preparepolysaccharide (BP) to characterize its physical and chemical properties, advanced structure in solution, as well as antagonistic capacity against P-selectin-mediated cell adhesion.BP was prepared by hot water extraction method, chemical methods (phenol sulfuric acid method, meta-hydroxybiphenyl method, Bradford method), high performance liquid chromatography, Fourier infrared transform spectroscopy, Congo red staining and circular dichroism were used to analyze the physical and chemical properties of BP and the advanced structure in the solution, we also evaluated its antagonistic function against P-selectin-mediated neutrophil adhesion.BP is an acidic heteropolysaccharide with a molecular weight of 36.44kDa. It contains 19.33% uronic acid content and is composed of five monosaccharides: Xylose, rhamnose, glucose, galactose, and arabinose. In its aqueous state, BP lacks a triple-helix structure, exhibiting pronounced asymmetry at the molecular level. However, this asymmetry is influenced by both concentration and temperature; BP significantly inhibited the P-selectin-mediated adhesion of HL-60 and Cho-P cells, and blocked the interaction between P-selectin and its physiological ligand P-selectin glycoprotein ligand 1 (PSGL-1).polysaccharide BP is an acidic polysaccharide composed of 5 kinds of monosaccharides, and BP can block P-selectin dependent cell adhesion, these results provide a novel therapeutical strategy for amelioration of inflammation-related disease.
; Polysaccharide; Physical and chemical properties; Solution conformation; P-selectin; Anti-inflammation
R285.5
A
10.3969/j.issn.1673-9701.2023.30.011
浙江省寧波市醫學重點學科建設項目(2022-F06)
黃麗麗,電子信箱:727751578@qq.com
(2022–10–28)
(2023–10–10)

