基因工程改造巨噬細胞及其應用①
鮑佳明 趙晨旭 孫凌云 趙 勇 (中國科學院動物研究所膜生物學國家重點實驗室,北京 100101)
巨噬細胞是一類專職的吞噬細胞和抗原遞呈細胞,是免疫系統的重要組成,廣泛參與病原體清除、炎癥反應介導、組織微環境穩態維持和修復等過程。巨噬細胞與人類許多疾病密切相關,包括癌癥、自身免疫病等[1]。此外,巨噬細胞也與移植物排斥反應相關[2]。因此,以巨噬細胞為靶點的疾病治療策略具有巨大應用潛力。巨噬細胞的基因工程改造手段受到廣泛關注。轉導技術作為改造細胞的一種重要手段廣泛用于科研和臨床。但巨噬細胞作為一種天然免疫細胞,一方面其胞內有多種核酸酶和蛋白酶,能夠破壞外源核酸和蛋白結構;另一方面在受到抗原或細胞因子刺激后迅速活化與極化,給巨噬細胞基因工程改造帶來挑戰。此外,由于巨噬細胞是終末分化細胞,幾乎不能進行增殖。因此巨噬細胞改造時保證細胞活性十分重要。本文簡要介紹目前常用的幾種巨噬細胞基因工程改造方法,并分析其優缺點,展望基因工程改造巨噬細胞在治療腫瘤、自身免疫病等疾病和抗移植物排斥反應方面的應用前景。
1 巨噬細胞改造方法
目前常用的巨噬細胞基因工程改造方法包括脂質體轉染法、電轉染法、腺相關病毒(adeno-associated virus,AAV)轉導法、慢病毒(lentivirus,LV)轉導法和生物材料法,各種改造方法均存在其優缺點,以下進行簡要介紹(表1)。
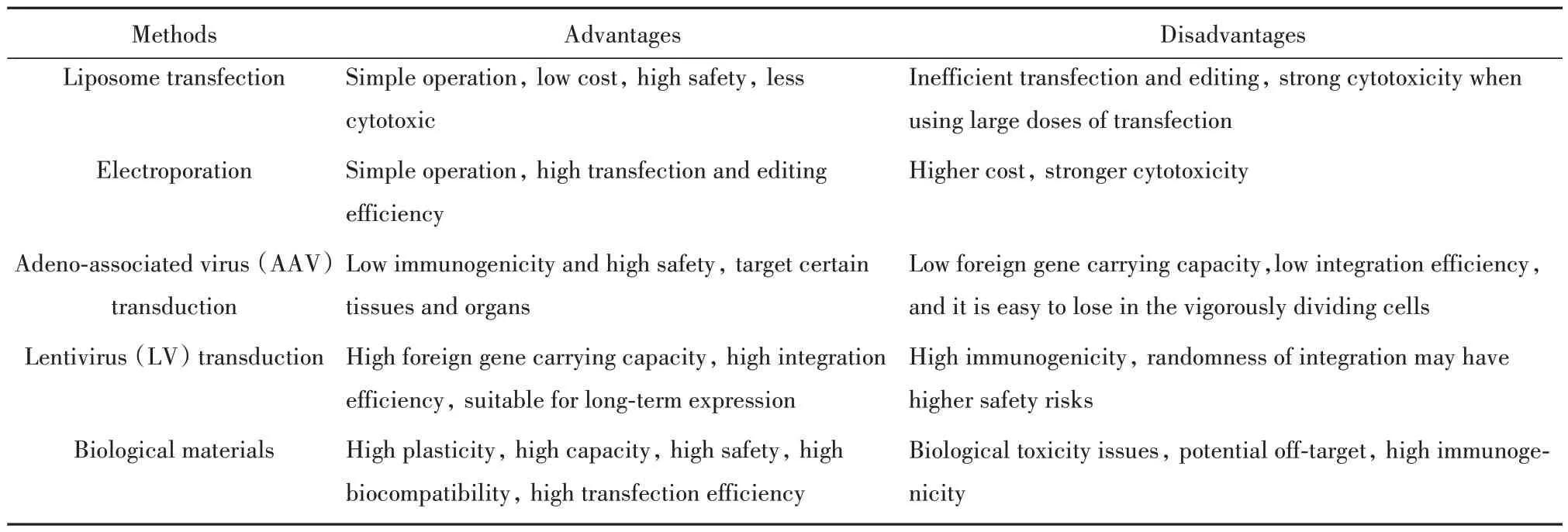
表1 巨噬細胞改造方法及其優缺點Tab.1 Methods of macrophage editing and their advantages and disadvantages
1.1 脂質體轉染法 將外源核酸片段通過主動或被動方式導入宿主細胞的過程稱為轉染。脂質體轉染法是利用帶正電荷的陽離子人工雙層膜結構通過靜電作用包裹帶負電荷的核酸從而形成脂質體,再通過膜融合方式將外源核酸序列傳遞到細胞中,從而實現細胞改造。與病毒轉導或電轉染法相比,脂質體轉染具有操作簡便、成本低、安全性高和細胞毒性小等特點。但巨噬細胞對脂質體轉染不敏感,難以使用脂質體對其進行轉染[3]。主要原因為:①巨噬細胞膜上含有大量糖蛋白,不利于膜融合;②巨噬細胞內含有核酸酶,易破壞外源核酸片段,此外,受到外源核酸刺激后,巨噬細胞會迅速活化,導致巨噬細胞狀態發生變化;③巨噬細胞作為終末分化細胞,幾乎不能增殖,導致巨噬細胞核膜完整性高,外源核酸片段很難入核進行復制、轉錄[4]。
目前針對脂質體轉染巨噬細胞效率低下這一技術瓶頸,研究人員從不同角度對脂質體轉染進行了優化。凋亡細胞會產生一類被稱為凋亡小體(apoBD)的囊泡,巨噬細胞能夠識別這類囊泡并以胞吞形式將apoBD 攝入細胞。根據這一特點,LAI等[3]通過在脂質體中加入Ca2+和1,2,二油酰基-sn-甘油-3-磷脂酰絲氨酸(DOPS)模擬apoBD 結構,借此增加巨噬細胞對脂質體的主動攝取。但脂質體大多帶正電荷,大劑量脂質體轉染會產生很強的細胞毒性。NOGUEIRA 等[5]在脂質體中摻入中性二油酰磷脂酰膽堿(DOPC)緩解陽離子脂質體的細胞毒性作用,在體內實現巨噬細胞MCL1基因沉默。隨著脂質體轉染條件不斷優化,脂質體作為一種新型的生物材料在靶向編輯巨噬細胞方面將發揮重要作用,這部分內容將在后續生物材料章節中進行介紹。
1.2 電轉染法 電轉染又稱電穿孔,指細胞膜在強電脈沖作用下形成小孔,親水性核酸、蛋白等分子通過這一小孔進入細胞的過程[6]。隨后這些小孔重新關閉維持細胞膜結構完整性[7]。當附加電場刺激超過閾值時,細胞膜結構無法恢復,導致細胞死亡。電場閾值與細胞大小等多因素相關,而細胞形態、大小、結構、狀態具有高度不均一性,這就解釋了為什么電轉染的細胞毒性較大,易造成細胞大量死亡。值得重視的是,巨噬細胞作為終末分化細胞,幾乎無法進行增殖,巨噬細胞改造時需更加關注細胞活性狀態。單核細胞作為巨噬細胞前體,能夠有效誘導發育為巨噬細胞,且單核細胞具有一定增殖能力,因此研究人員將目光轉移到單核細胞基因編輯上。目前已通過優化電轉程序成功實現了對單核/巨噬細胞系(RAW264.7、THP-1)和骨髓來源單核/巨噬細胞的基因編輯,且轉染效率達90%以上,存活率達70%以上[8]。需要注意的是,單核/巨噬細胞電轉染死亡率與轉染的核酸片段大小有關[9]。電轉染后,骨髓來源單核/巨噬細胞激活標志物上調,說明電轉染在一定程度導致原代單核/巨噬細胞激活[8]。如何根據需要有效調控巨噬細胞激活可能是未來電轉染改造巨噬細胞的發展目標之一。
盡管電轉染法存在高細胞毒性的弊端,但與脂質體轉染相比,電轉染有極高的轉染效率及更高的基因整合率。電轉染能夠打開巨噬細胞核膜,從而增加外源核酸片段進入細胞核內的機會,提高編輯效率。脂質體轉染和電轉染法不適合需要持續表達外源基因的巨噬細胞改造,因為隨機整合是一個低概率事件,難以篩選出穩定表達外源基因的巨噬細胞群體,而游離于基因組外的核酸片段會發生失活、水解或丟失[10]。使用AAV 和LV 轉導技術改造巨噬細胞并持續表達外源基因是更優選擇。
1.3 AAV 轉導法 轉導指通過病毒將一個宿主DNA 轉移到另一個宿主細胞引起基因重組的現象。AAV是一類結構簡單的單鏈DNA細小病毒,基因組大小約為4.7 kb,為復制缺陷型,需要輔助病毒(通常為腺病毒)存在才能復制。AAV 具有強大的基因傳遞能力、較高的安全性和缺乏致病性等優點,已作為臨床最有潛力的病毒載體受到關注。不同AAV 亞型由于受體不同,具有不同組織偏好性,能夠感染特定的組織細胞,如AAV2 能夠以硫酸乙酰肝素蛋白聚糖(HSPG)、人類成纖維細胞生長因子受體1(FGFR1)等作為受體,幾乎能夠感染人體所有細胞[11]。而AAV8 能夠識別層黏連蛋白受體,靶向感染肝臟細胞[12]。這種不同亞型病毒的不同組織偏好性無疑給AAV帶來了更高的應用潛力。
限制AAV 應用的原因之一是AAV 仍具有一定免疫原性(雖然免疫原性低于LV),引起人體免疫應答,導致病毒很快被清除,使用AAV 對巨噬細胞進行改造時尤其如此。巨噬細胞膜上的TLR2 能夠識別AAV 衣殼蛋白結構;而巨噬細胞胞內的TLR9 能夠識別AAV 核酸的CpG 區[13]。這些因素導致使用AAV 轉導巨噬細胞的效率降低或巨噬細胞活化或極化。研究發現,在AAV 基因組中加入1 個24 bp的含有4個CpG 區域的高度炎癥性寡脫氧核糖核苷酸(ODN)能夠有效降低TLR9 活性,原因可能為ODN 競爭性與TLR9 結合,導致巨噬細胞TLR9 處于“無應答”狀態,從而降低巨噬細胞對AAV 的免疫應答[14]。通過對AAV 衣殼蛋白三重對稱軸附近的堿基進行點突變能夠降低AAV 衣殼蛋白免疫原性,但過多的點突變可能導致衣殼蛋白無法正確 折疊[15]。第二,由于AAV病毒結構簡單,導致AAV 能夠接入的外源片段較短(不能大于4.5 kb)[16]。第三,不同于慢病毒,AAV 基因組主要以附加體形式存在于宿主細胞核,不易整合進入細胞基因組,導致AAV 在轉導分裂旺盛的細胞時易造成外源基因丟失[17]。最后,由于AAV 基因組是單鏈的,但轉導靶細胞后,病毒基因組必須首先轉換為具有轉錄活性的雙鏈形式,這是AAV 載體轉基因表達中重要的限速步驟,而這一過程往往需要1~2 周時間。目前開發的自配對型AAV(scAAV)能夠解決這一問題,scAAV 基因組在進入宿主細胞后能夠通過自我配對形成具有轉錄活性的雙鏈形式,加快外源基因表達[18]。雖然使用scAAV 可加快外源基因表達,但更長的病毒基因組會壓縮外源基因插入空間,導致能夠接入外源片段的長度進一步縮短。
1.4 LV轉導法 LV整個生命周期完成需要3個基因參與:gag、pol和env。其中gag基因編碼慢病毒結構蛋白,pol基因負責將病毒基因組整合進入宿主基因組,而env基因則負責編碼慢病毒包膜糖蛋白。LV 載體中使用水泡性口炎病毒糖蛋白編碼基因VSV-G替換慢病毒env蛋白。VSV-G 蛋白能識別低密度脂蛋白(LDL)受體,使LV 載體能夠識別并侵染多種細胞,提高LV 轉染效率[19]。經過幾代發展,LV安全性基本得到了保證。
除安全性和轉染能力外,與AAV 載體相比,LV載體能穩定地將其基因組整合到宿主細胞基因組,不會隨著細胞分裂導致外源基因丟失。LV 載體更偏好于將自己的基因組整合到轉錄基因下游區域,而非啟動子區域[20]。與啟動子區域相比,下游區域更穩定,更有利于保證插入基因長期穩定表達。LV能夠接受的外源基因片段長度為9 kb,是AAV 的2 倍。與AAV 相同的是,LV 也存在一定免疫原性。除TLR2 能夠識別其衣殼蛋白外,TLR7 和TLR9 能夠識別LV 的基因組RNA,導致Ⅰ型干擾素產生[21-22]。目前可通過將LV 與地塞米松等免疫抑制藥物聯用抑制Ⅰ型干擾素產生,從而提高LV 轉導效率[23]。需要注意的是,地塞米松可能導致巨噬細胞發生線粒體依賴性細胞凋亡,因此使用地塞米松提高LV 對巨噬細胞的轉導效率時需格外注意巨噬細胞活性[24]。除TLR 外,巨噬細胞存在SAMHD1 蛋白,能夠通過耗竭掉LV 逆轉錄所需的三磷酸核苷酸限制LV 逆轉錄過程。研究發現,包裝LV 過程中整合1 個病毒蛋白X(Vpx)使SAMHD1 蛋白失活,提高LV 對巨噬細胞的編輯效率[25]。有趣的是,使用shRNA 耗竭掉THP-1 細胞的SAMHD1 后,發現耗竭掉SAMHD1 不影響THP-1 正常免疫應答,說明利用Vpx 使巨噬細胞SAMDH1 失活后,可能并不影響巨噬細胞的功能[26]。
1.5 生物材料法 近年生物材料表現出高可塑性、高容量、高安全性、高生物相容性、高轉染效率,使其越來越受到重視[27]。生物材料可依賴巨噬細胞主動吞噬能力促進巨噬細胞對外源物質的主動攝取。生物材料顆粒大小、所帶電荷和形狀都會影響巨噬細胞對其吞噬[28]。研究發現,生物材料大小控制為30 nm~3 μm有利于巨噬細胞攝取,生物材料過大或過小均影響巨噬細胞攝取效率[29]。YU 等[30]發現帶有強正電荷或強負電荷的生物材料能夠以更快速度被巨噬細胞吞噬。巨噬細胞優先吞噬球狀生物材料顆粒,而桿狀或棒狀顆粒則不易被吞噬[31]。因此,包裝顆粒的選擇很大程度影響巨噬細胞對生物材料的攝取效率,從而影響編輯效率。
1.5.1 脂質體 脂質體類型生物材料是目前最常用的生物材料。與常規脂質體轉染不同,作為生物材料的脂質體需經過改造增加其靶向性和轉染效率,同時延長其血液半衰期。研究發現,直徑小于85 nm的帶負電荷脂質體可促進單核/巨噬細胞對其吞噬;相反,大的帶正電荷的脂質體更易引起單核/巨噬細胞激活[32]。目前臨床常用的DOPC 脂質體經過不同表面修飾后能夠促進M2 型巨噬細胞或/和Na?ve 巨噬細胞向M1 型極化,為脂質體治療疾病提供了新思路[33]。ANSELMO等[34]開發了一種扁平的圓形脂質體,稱為“細胞背包”(cellular backpage,BPs),這種脂質體能夠靶向單核細胞,BPs 接觸到單核細胞后不會被吞噬,而是緊緊附著于單核細胞,且不影響單核細胞趨化功能和向巨噬細胞分化的潛力。利用單核細胞的趨化功能將攜帶藥物的脂質體通過單核細胞攜帶到炎癥組織,為治療炎癥性疾病提供了新策略。
1.5.2 無機納米材料 納米材料擁有廣泛的臨床疾病診斷和治療潛力。根據納米材料性質可將其分為無機納米材料、有機納米材料和有機-無機雜化納米材料,其中無機納米材料由于高穩定性、高可塑性受到青睞。目前常見無機納米材料又可分為量子點(包括碳量子點、硅量子點、鎘量子點,直徑2~20 nm)、納米二氧化硅(直徑20~80 nm)和金屬納米顆粒(直徑<5.5 nm)等。研究發現,通過直接使用金屬納米顆粒、二氧化鈦或包裹某些物質(IL-4、RGD 序列等)能夠靶向誘導組織巨噬細胞極化,用于治療急性肝炎、急性腎損傷或加快成骨和肌肉修復[35]。有趣的是,<30 nm 的無機納米材料常用于誘導M2 型巨噬細胞極化,而>100 nm 的無機納米材料則用于誘導M1 型巨噬細胞極化。碳納米材料可在體內外引起巨噬細胞轉錄組改變,從而引起巨噬細胞M1 或M2 型極化[36]。體外研究表明,巨噬細胞極化水平與碳納米材料處理濃度和時間相關[37]。因此需要根據目的選擇納米材料種類、大小及優化使用濃度和時間,以達到最佳的巨噬細胞改造效果。
限制無機納米材料應用的最大問題是其人體毒性,無機納米材料常在內皮系統中積聚,導致長期人體毒性和靶向性減弱。值得注意的是,不同無機納米粒子聯用可能增強細胞毒性,TSUGITA 等[38]發現,使用二氧化硅和二氧化鈦同時處理巨噬細胞能夠激活Caspase-1炎癥小體,導致IL-1β產生,提示使用多種無機納米材料進行巨噬細胞改造時應合理選擇,降低細胞毒性。目前采取的方法有在無機納米材料中加入有機結構(如PEG),即有機-無機雜化納米材料加速納米材料溶解或通過整合某些酶反應位點,促進氧化或還原反應,加快材料降解等[39]。
2 基因工程改造巨噬細胞與疾病
巨噬細胞具有可塑性,受其外界微環境影響發生極化。巨噬細胞根據激活方式不同常分為兩個亞型:經典激活的M1 型和替代激活的M2 型。對巨噬細胞進行體內或體外的基因工程改造緩解甚至治愈某些疾病具有廣闊應用前景。
2.1 基因工程改造巨噬細胞與腫瘤 目前已證明基因工程改造巨噬細胞在腫瘤診斷和治療方面具有潛力(圖1)。
2.1.1 基因工程改造巨噬細胞與腫瘤診斷 實體腫瘤微環境中常存在大量腫瘤相關巨噬細胞(tumor-associated macrophage,TAM),且TAM 往往與腫瘤預后不良相關[29]。AALIPOUR等[40]在小鼠模型中開發了一種過繼改造后同源巨噬細胞診斷癌癥的方法,發現小鼠過繼的巨噬細胞能夠遷移到腫瘤部位,且這一偏好比遷移到其他位置強4倍,遷移到腫瘤部位的巨噬細胞能夠被腫瘤微環境誘導為M2型,Arg-1 表達上調200 倍,因此將熒光素報告基因與Arg-1 基因啟動子相偶聯并通過LV 轉導改造巨噬細胞,從而實現熒光素在腫瘤微環境中的高特異性表達。過繼改造巨噬細胞后,通過觀察熒光信號分布能夠發現25~50 mm3的腫瘤,對腫瘤的敏感性遠超當前正電子發射斷層掃描(positron emission tomography,PET)的200 mm3,可以發現更早期的腫瘤,為腫瘤診斷提供了更靈敏的手段。
2.1.2 腫瘤微環境內巨噬細胞改造 前文提到,腫瘤微環境中常存在大量M2 型巨噬細胞浸潤,發揮免疫抑制功能,促進腫瘤血管形成、腫瘤轉移,加速腫瘤生長[41-42]。目前治療腫瘤思路之一是耗竭TAM 或馴化TAM 使其發揮抑制腫瘤生長功能。QIAN 等[43]開 發 了 一 種M2 型TAM 靶 向 納 米 顆 粒M2NPs,并在M2NPs上裝載了針對CSF-1R的siRNA,通過阻斷M2型TAM 存活信號耗竭腫瘤微環境中的M2 型巨噬細胞。根據肺癌中TAM 葉酸受體β 上調的特點,TIE 等[44]通過將葉酸與脂質體融合靶向肺癌TAM,同時在脂質體中包裹1 個編碼促凋亡蛋白BIM 的 質 粒 促 進TAM 凋 亡。ZHANG 等[45]開 發 了一種納米載體包裹體外轉錄的IRF5 和IKKβ mRNA對TAM 中的M2 型巨噬細胞進行重編程,促進其向M1型極化,使其從促腫瘤狀態轉向抑制腫瘤發展狀態。RODELL 等[46]設 計 了 一 種 裝 載R848(一 種TLR7、TLR8 激動劑)的β-環糊精納米顆粒靶向TAM,實現了TAM由M2型向M1型轉化。
TAM 中除具有促進腫瘤生長的M2 型巨噬細胞,還有能夠執行正常腫瘤殺傷功能的M1 型巨噬細胞,這些具有腫瘤殺傷潛力的巨噬細胞正常功能受到抑制或處于一種無應答狀態,無法發揮正常的腫瘤殺傷功能。改造這類巨噬細胞使其發揮正常功能也是一個腫瘤治療策略。抑制受體調節蛋白-α(SIRPα)是在髓系細胞表達的一類免疫檢查點分子,能夠與正常細胞的跨膜蛋白CD47 結合,從而抑制巨噬細胞對正常細胞的吞噬[47]。腫瘤細胞常有CD47分子表達,從而限制巨噬細胞對腫瘤細胞的吞噬作用。RAO 等[48]設計了一種基因工程細胞膜包被的磁性納米顆粒(gCM-MNs),其中納米膜囊泡包被SIRPα 突變體CV1,CV1 對CD47 的親和力是正常SIRPα的50 000倍以上,可有效阻斷SIRPα-CD47通路。而內部磁納米顆粒可將gCM-MNs靶向至腫瘤微環境,并促進TAM由M2型向M1型極化。將gCM-MNs靜脈注射到荷瘤小鼠中,腫瘤生長明顯減緩,且未觀察到明顯體內毒性作用。除通過阻斷SIRPα-CD47恢復巨噬細胞對腫瘤正常的吞噬功能外,研究人員在卵巢癌和三陰性乳腺癌中發現這些腫瘤高表達CD24,能與巨噬細胞Siglec 10 結合促進其免疫逃逸[49]。在巨噬細胞中敲除Siglec 10或使用抗體進行阻斷后能夠顯著增加巨噬細胞對這些腫瘤的吞噬作用,為卵巢癌和三陰性乳腺癌這類無靶向藥的腫瘤提供了新的治療靶點[50]。此外,針對TAM 在腫瘤中無法執行正常抗原遞呈作用這一問題,MURAOKA等[51]開發了一種膽固醇支鏈淀粉(cholesterol amylopectin,CHP)納米凝膠,將CHP 納米凝膠和腫瘤抗原復合物靜脈注射荷瘤小鼠,發現CHP 抗原復合物能夠有效聚集于腫瘤,恢復TAM 正常抗原遞呈能力,從而激活CD8+T細胞,發揮抗腫瘤作用。
2.1.3 改造巨噬細胞作為藥物載體 巨噬細胞被CCL2、CSF-1和補體級聯產物等招募至腫瘤微環境,從而執行腫瘤殺傷功能或促進腫瘤發展和轉移[52]。根據巨噬細胞能夠越過生理屏障而被招募到腫瘤微環境的這一特點,科研人員嘗試使用改造后的巨噬細胞作為藥物載體達到向腫瘤中特異性遞送藥物并增加藥物半衰期的目的[53]。CHOI 等[54]使用脂質體包裹阿霉素(Dox)增加巨噬細胞對Dox的攝取,且能夠顯著降低Dox 對巨噬細胞的毒性,巨噬細胞攜帶Dox 進入腫瘤后,隨著Dox 釋放殺傷腫瘤細胞。將金納米顆粒(AuNS)與巨噬細胞共同孵育促進巨噬細胞對AuNS 的攝取,裝載AuNS 的巨噬細胞在使用近紅外激光照射時,導致巨噬細胞及其周圍腫瘤細胞發生熱誘導的死亡,這一治療方法稱為光熱療法[55]。目前這一治療方法在體內或體外被證明對乳腺癌、頭頸鱗癌等有良好的治療效果[56-57]。盡管使用巨噬細胞進行藥物遞送能夠提高對腫瘤的靶向性,降低全身反應性和延長藥物半衰期等優點,需要注意的是,裝載到巨噬細胞的藥物對巨噬細胞具有毒性,CHOI 等[54]發現裝載Dox 的巨噬細胞24 h后活性就會降低,因此巨噬細胞能裝載的藥物有限。此外,使用巨噬細胞進行藥物遞送時還存在脫靶效應,全身注射巨噬細胞48 h 后,除腫瘤部位外,肝臟、脾臟和肺中也觀察到大量巨噬細胞積累[58]。這些因素可能限制改造巨噬細胞藥物遞送體系應用。
2.1.4 嵌合抗原受體巨噬細胞(CAR-M) 近年隨著基因工程技術不斷發展,體外改造巨噬細胞技術越來越成熟。最近,KLICHINSKY 等[59]通過AAV 載體Ad5f35 轉導人THP-1 細胞系,構建表達針對HER2 嵌合抗原受體(CAR)的巨噬細胞(CAR-M),發現HER2 CAR-M 能夠以劑量和時間依賴方式清除HER2+SKOV3卵巢腫瘤,且CAR-M 在腫瘤部位存活100 d 以上。重要的是,由于腺病毒載體Ad5f35的存在,使CAR-M始終處于M1型極化狀態,保證了CAR-M 的抗腫瘤能力。ZHANG 等[60]構建了一種CAR-HER2-CD147,由用來識別人HER2 的scFV 胞外區和小鼠CD147 跨膜區和胞內區組成,利用LV轉導方式構建了CAR-HER2-CD147-RAW264.7 細胞系,當CAR-HER2-CD147-RAW264.7 識別到腫瘤表面的HER2分子時,激活CD147下游信號通路,促進巨噬細胞產生基質金屬蛋白酶降解腫瘤細胞外基質,從而增加T細胞浸潤,發揮抗腫瘤作用。值得關注的是,CAR-HER2-CD147-RAW264.7 與HER2-4T1 在體外共培養并無直接殺傷腫瘤功能,說明改造后的巨噬細胞作用方式更加溫和,毒副作用更小。
利用基因工程改造巨噬細胞治療腫瘤已成為一種有前景的腫瘤治療方式,但如何提高靶向性及降低人體毒性仍是亟待解決的問題。此外,大規模細胞檢測技術、單細胞測序技術、多重免疫組化可幫助選擇新的巨噬細胞靶點,從而提高治療腫瘤效果[61]。總之,巨噬細胞憑借其強大的趨向性、可塑性,在腫瘤治療中的地位逐漸凸顯,巨噬細胞特異性靶點、高效率巨噬細胞改造工具和巨噬細胞靶向性生物材料等開發可能成為未來這一領域研究重點。
2.2 基因工程改造巨噬細胞與自身免疫病 巨噬細胞與多種自身免疫病相關,包括哮喘、系統性紅斑狼瘡、腎小球腎炎、自身免疫性神經炎、炎癥性腸病(inflammatory bowel disease,IBD)、類風濕關節炎(rheumatoid arthritis,RA)、系統性硬化病等[62]。自身免疫病發生常伴隨巨噬細胞浸潤增加及M1與M2型巨噬細胞極化失衡。通過改造巨噬細胞進行免疫治療是緩解某些自身免疫病的有效手段,具有廣闊應用前景。
2.2.1 基因工程改造巨噬細胞與RA RA 是一類與M1/M2 比例失衡相關的自身免疫病[63]。研究發現,在小鼠體內通過注射AAV2/8 載體在巨噬細胞中過表達IL-38,可緩解膠原誘導關節炎和K/BxN 血清轉移性關節炎小鼠癥狀[64]。此外,在THP-1 細胞系中使用LV 載體過表達IL-38 能夠抑制IL-6、IL-23和TNF-α等促炎因子產生,說明IL-38過表達巨噬細胞在治療RA方面具有潛力[64]。
2.2.2 基因工程改造巨噬細胞與腎小球腎炎 腎小球腎炎中常發現巨噬細胞浸潤,說明巨噬細胞在腎小球腎炎中發揮作用。20 年前,WILSON 等[65]利用腺病毒載體在骨髓來源巨噬細胞中過表達IL-10并回輸至小鼠,發現腎小球腎炎癥狀得到緩解。PEREIRA 等[66]使用DEF(一種鐵螯合劑)在體內處理腎小球腎炎小鼠模型,通過改變巨噬細胞代謝方式限制巨噬細胞M1型極化緩解腎小球腎炎。
2.2.3 基因工程改造巨噬細胞與IBD IBD 包括潰瘍性結腸炎和克羅恩病。IBD 與M1/M2比例失衡而導致的腸道微生物或食物抗原耐受降低及慢性炎癥相關[67]。有報道稱,維生素D3的活性形式1,25(OH)2D3能夠減少巨噬細胞TNF-α、IL-1β 和COX-2產生,并增加IL-10 產生[68]。ZAI 等[69]開發了一種不會被胃酸破壞的納米結構脂質載體NLCs,通過口服給藥方式到達腸道后被腸道巨噬細胞攝取,減少巨噬細胞炎癥因子分泌,緩解IBD 癥狀。CAO 等[70]制備了一種利用殼聚糖包裹胰島素樣生長因子1C 端結構域(IGF-1)的水凝膠CS-IGF-1,將CS-IGF-1注射到小鼠體內能夠激活并誘導M2 型巨噬細胞極化,從而促進IBD小鼠腸道上皮修復,減輕癥狀。
2.3 基因工程改造巨噬細胞與抗移植物排斥 器官移植是挽救終末期器官衰竭患者生命的一項重要策略。近年巨噬細胞在急性和慢性排斥反應中的作用受到重視。巨噬細胞在移植物中積累被認為是移植物排斥的特征之一,與患者預后較差相關[2]。肝臟缺血再灌注損傷中,供體肝臟中駐留的Kupffer 細胞向M1 型極化,造成移植物功能障礙[71]。急性排斥反應過程中,巨噬細胞能夠產生IL-6、TNF-α、iNOS、MCP-1 等炎癥因子和趨化因子招募和激活白細胞導致移植物微血管損傷。此外,巨噬細胞還能發揮抗原遞呈作用激活適應性免疫細胞介導供體特異性細胞毒反應。除分泌炎癥因子、發揮抗原遞呈等作用介導急性排斥反應外,巨噬細胞可直接作為效應細胞通過穿孔素依賴途徑直接排斥小鼠同種異體移植物[72]。慢性排斥反應在移植后數月至數年內發生,長期活化的巨噬細胞向M2 型偏移并發揮促纖維化功能[73]。據報道,術后1年,患者移植物內90%以上巨噬細胞表現出CD68+CD206+的M2 型巨噬細胞表型[74]。WU 等[75]使用氯膦酸脂質體清除心臟移植受體大鼠全身巨噬細胞后發現,心臟功能下降減緩,移植物存活時間延長。
巨噬細胞在誘導抑制免疫耐受方面也發揮重要作用。CONDE 等[76]在小鼠異位心臟同種異體移植模型中,使用anti-CD40L 單克隆抗體誘導耐受期間,觀察到CD11b+CSF1R+Ly6CloLy6G-巨噬細胞在移植物中積累,這種積累依賴CSF1驅動的單核前體向Ly6Clo抑制性巨噬細胞增殖和轉化。基于這一發現,BRAZA 等[77]制備了一種辛伐他汀-高密度脂蛋白納米載體限制單核前體增殖,發現CSF1誘導的免疫耐受抑制狀態被打破。說明CSF1 可促進單核前體增殖和向免疫耐受方向轉化,可能是未來改造巨噬細胞發揮抗移植物排斥反應功能的潛在靶點。BRAZA 等[78]利用高密度脂蛋白包裹mTOR 抑制劑制備了兩種納米顆粒,這兩種納米顆粒聯用可促進Ly6Clo巨噬細胞積累,移植后100 d,移植物存活率仍超過70%。Zbtb7a 表達僅局限于肺泡巨噬細胞,在肺移植小鼠模型中過繼Zbtb7a 敲除的巨噬細胞能夠通過降低肺泡巨噬細胞抗原遞呈能力,限制T 細胞增殖,減輕支氣管堵塞,延長移植物存活時間[79]。此外,IL-33能夠刺激移植物內巨噬細胞脂肪酸攝取并限制巨噬細胞M1 型極化,減輕急性排斥反應[80]。IL-34 處理CD14++CSF-1R+PTPξ+單核細胞促進其向具有免疫耐受特性的巨噬細胞分化[81]。盡管目前基因工程改造巨噬細胞在抗移植物排斥方面的研究較少,前期基礎研究為后期基因工程改造巨噬細胞提供了新靶點和思路,改造巨噬細胞在移植免疫中存在巨大應用潛力。
3 討論
基因工程改造巨噬細胞為許多疾病如腫瘤、自身免疫病、感染性疾病、移植物排斥等提供了新的診斷方式、治療思路和手段。多種以改造巨噬細胞為目標的疾病治療手段已進入臨床試驗,如CAR-M、金納米顆粒等,為使用現有手段難以治療的疾病帶來了新希望。盡管如此,現階段基因工程改造巨噬細胞仍存在一些技術瓶頸需要克服和優化。首先是巨噬細胞難以轉染的問題,現有轉染手段或多或少存在靶向性低、效率不高、對細胞毒性大、引起細胞狀態改變等問題,因此,需要對現有基因工程改造手段進行優化或開發新的改造方法提高轉染和編輯效率,提高安全性,并根據治療需要誘導巨噬細胞極化。改造能否能夠穩定維持巨噬細胞特定功能也是考量其臨床應用價值的重要因素。改造后的巨噬細胞應能夠維持較長時間活性和穩定性而不會被微環境重新誘導。此外,如何有效降低臨床應用成本也是改造巨噬細胞時需要考慮的重要問題。總之,基因工程改造巨噬細胞的臨床應用仍有諸多問題需要解決。幸運的是,大量細胞分子生物學等領域新技術開發為有效解決基因工程改造巨噬細胞現有問題和瓶頸、實現巨噬細胞精準“馴化”及提高治療效果提供了新手段和新策略。