牛蒡子苷元對葡聚糖硫酸鈉誘導的小鼠炎癥性腸病的治療作用及機制①
李家駒 黃佑嬌 李遠迪 何可可 蘇 敏 (貴州醫科大學基礎醫學院,貴陽 550025)
炎癥性腸病(inflammatory bowel disease,IBD)是一種由腸黏膜上皮破壞引起的慢性、復發性炎癥疾病,主要包括潰瘍性結腸炎(ulcerative colitis, UC)和克羅恩病(Crohn's disease, CD)。IBD 是環境和遺傳因素相互作用的結果,通常導致腸道黏膜免疫反應異常和腸道炎癥發生[1-2]。此外,腸道表面由黏膜組成,主要由緊密連接(tight junction,TJs)覆蓋,而TJs是腸道的主要屏障[3]。TJs 蛋白的異常表達與IBD密切相關[4]。我國IBD 的發病率顯著上升,然而其發病機制和病因尚未闡明。目前用于治療IBD的藥物存在明顯的不良反應,如全身免疫抑制、頭痛、惡心和疲勞[5-6]。因此,探索可用于治療IBD 的藥物具有重要意義。
許多天然產物由于具有抗炎作用和相對低的毒性而獲得了相當多的關注。牛蒡子是菊科牛蒡屬植物干燥成熟的果實,是一種傳統中藥,廣泛用于治療風熱邪咳嗽、咽喉腫痛等。牛蒡子苷元是從牛蒡子中提取分離而來的木質素類化合物。作為牛蒡子的主要活性成分,牛蒡子苷元被發現具有抗病毒和抗炎等作用。據報道,牛蒡子苷元能抑制炎癥和氧化應激,但其在IBD 中的作用還有待研究[7]。本研究旨在探究牛蒡子苷元對脂多糖(lipopolysaccharide,LPS)誘導的人腸道細胞Caco-2 和葡聚糖硫酸鈉(dextran sulfate sodium,DSS)誘導的小鼠結腸炎模型的作用及其相關的機制。
1 材料與方法
1.1 材料 6~8 周齡C57BL/6J 雄性小鼠(20~22 g,SPF 級)購自貴州醫科大學實驗動物中心;Caco-2 細胞購自中國科學院科學細胞庫(上海,中國);牛蒡子苷元(純度≥98%;分子量372.411 7)購自上海源葉生物科技有限公司。胎牛血清和DMEM 購自美國Gibco公司;DSS購自美國Sigma公司;ELISA 試劑盒購自美國Thermo Fisher Scientific 公司;磷酸化細胞核因子κB p65(nuclear factor kappa-B p65,NF-κB p-p65)、緊密連接蛋白(zonula occludens-1,ZO-1),GAPDH 抗體均購自美國Abcam 公司;HRP 標記的山羊抗兔IgG 購自上海碧云天生物科技有限公司;Multiskan FC酶標儀購自美國Thermo Fisher Scientific公司;蛋白電泳凝膠儀和The Trans-Blot Turbo 蛋白轉膜儀購自美國Bio-Rad 生物有限公司;OLYMPUS AX70顯微鏡購自日本Olympus公司。
1.2 方法
1.2.1 小鼠IBD 模型建立 采用DSS 建立IBD 小鼠模型[8]。C57BL/6 小鼠隨機分為4 組:空白對照組、模型組、牛蒡子苷元低劑量組(10 mg/kg)和牛蒡子苷元高劑量組(40 mg/kg)。對照組小鼠自由飲用自來水,其余各組小鼠通過連續飲用4%(wt./vol)DSS 7 d制備小鼠IBD模型。模型鼠在造模第3~4天后,小鼠會表現出明顯的疾病跡象,包括駝背、皮毛隆起、腹瀉和黏液膿血便。隨機挑選3只模型鼠,處死后取出結腸組織,通過組織病理學觀察可見潰瘍、隱窩膿腫、杯狀細胞丟失、黏液層丟失和大量中性粒細胞浸潤到固有層,表明造模成功。小鼠在造模前連續灌胃牛蒡子苷元2 d,于第3 天進行DSS 造模,各給藥組均連續灌胃給予相應藥物10 d,1次/d,對照組和DSS 組給予等體積生理鹽水。給藥期間,小鼠標準飲食、自由飲水。該動物實驗獲得貴州醫科大學動物保護和使用委員會批準。動物使用許可證號:SYXK(黔)2016-0003。
1.2.2 細胞培養 Caco-2 細胞(1×105個/ml)接種于96 孔板,培養在含有10%胎牛血清、100 U/ml 青霉素和100 μg/ml 鏈霉素的PRMI1640 中,并置于37 ℃和5%CO2的培養箱中。當96 孔板中的Caco-2細胞貼壁后,分為4 組:空白對照組、LPS 組、LPS+10 μmol/L 牛蒡子苷元組,LPS+40 μmol/L 牛蒡子苷元組。Caco-2 細胞與牛蒡子苷元(10、40 μmol/L)孵育1 h,然后37 ℃下用LPS(1 μg/ml)刺激24 h,與對照組比較差異顯著,表明建模成功[9]。
1.2.3 ELISA 測定各組細胞上清中TNF-α、IL-1β、IL-6、MDA 和SOD 水平 在洗凈的小鼠結腸中加入3 倍的生理鹽水,采用超聲粉碎法將結腸組織勻漿,按試劑盒說明書方法操作,ELISA 對小鼠結腸組織中TNF-α、IL-1β、IL-6、MDA 和SOD 的 含 量 進 行測定。
1.2.4 Western blot 分析 使用RIPA 裂解液提取細胞和組織中的蛋白;取20 μl 蛋白樣品采用10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(120 V,2 h);電轉法將蛋白轉至聚偏氟乙烯膜(250 mA,2 h);10%脫脂奶粉室溫封閉1 h,一抗4 ℃過夜孵育,二抗室溫孵育2 h。凝膠成像儀檢測蛋白條帶,Image-Pro Plus軟件分析條帶灰度值。
1.2.5 HE 染色 采用HE 染色評價結腸組織病理學變化。在實驗完成后,小鼠被處死,移除每只小鼠的整個結腸。將5 mm 長的結腸用4%多聚甲醛中過夜固定。隨后,將石蠟包埋的結腸切片用蘇木精和伊紅進行HE 染色。采用顯微鏡下觀察組織病理改變。
1.2.6 胸腺指數與脾臟指數計算 將各組中的小鼠脫頸椎處死后稱量體質量(g)。無菌條件下剪開腹腔摘取小鼠的胸腺和脾臟。使用濾紙吸干胸腺和脾臟的殘血后,稱重(mg)。計算胸腺指數=(胸腺重量mg/小鼠體質量g)×10;脾臟指數=(脾臟重量mg/小鼠體質量g)×10。
1.3 統計學處理 采用SPSS23.0統計學軟件進行數據分析。實驗數據以±s表示。兩組間比較采用t檢驗,多組間比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 牛蒡子苷元抑制LPS誘導的人腸道細胞Caco-2炎癥因子分泌 ELISA 結果顯示:與空白對照組比較,LPS 處理后,Caco-2 細胞炎癥因子TNF-α、IL-1β和IL-6 分泌顯著增加(P<0.05);與LPS 組比較,牛蒡子苷元治療24 h 后降低了炎癥因子的分泌,而高劑量牛蒡子苷元(40 μmol/L)的治療效果明顯優于低劑量牛蒡子苷元(10 μmol/L)(P<0.05)。見圖1。2.2 牛蒡子苷元減輕LPS誘導的人腸道細胞Caco-2氧化應激 ELISA 結果顯示:與空白對照組比較,LPS處理后,Caco-2細胞中SOD 含量顯著下降,MDA含量顯著上升(P<0.05);而10 μmol/L 或40 μmol/L牛蒡子苷元處理顯著增加了SOD 含量,減少了MDA含量(P<0.05)。見圖2。
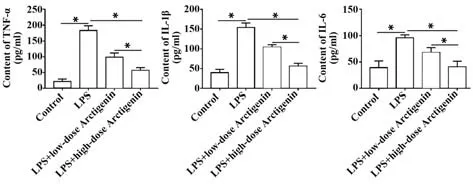
圖1 牛蒡子苷元抑制Caco-2細胞中炎癥因子表達Fig.1 Arctigenin inhibits expressions of inflammatory factors in Caco-2 cells
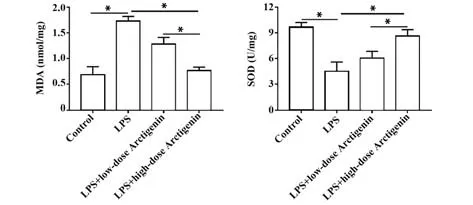
圖2 牛蒡子苷抑制Caco-2細胞中氧化應激Fig.2 Arctigenin inhibits oxidative stress in Caco-2 cells
2.3 牛蒡子苷元抑制LPS 誘導的人腸道細胞NF-κB 通路激活 Western blot 結果顯示,LPS 誘導Caco-2 細胞后,NF-κB p65 蛋白的磷酸化水平顯著升高,其下游蛋白ZO-1 表達顯著降低(P<0.05);10 μmol/L 或40 μmol/L 牛蒡子苷元處理后,逆轉了LPS 誘導的NF-κB p65 蛋白磷酸化水平上升和ZO-1表達水平降低。見圖3。
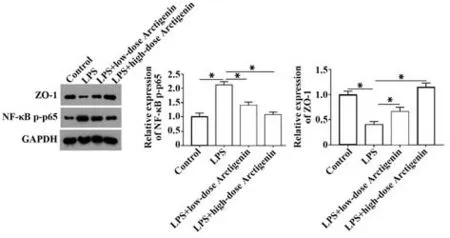
圖3 牛蒡子苷元抑制Caco-2細胞中NF-κB通路激活Fig.3 Arctigenin inhibits activation of NF-κB pathway in Caco-2 cells
2.4 牛蒡子苷元減輕DSS 誘導的IBD 小鼠炎癥因子分泌 與對照組比較,DSS 誘導的IBD 模型組小鼠結腸組織中TNF-α、IL-1β 和IL-6 含量顯著增加(P<0.01)。牛蒡子苷元低和高劑量組(10 mg/kg 和40 mg/kg)TNF-α、IL-1β 和IL-6 含 量 明 顯 降 低,40 mg/kg牛蒡子苷元組效果更為顯著(P<0.01)。見表1。
表1 牛蒡子苷元對DSS誘導小鼠結腸組織炎癥因子含量的影響(±s,n=6,pg/mg)Tab.1 Effect of arctigenin on content of inflammatory factors in colon tissues of mice induced by DSS(±s,n=6,pg/mg)

表1 牛蒡子苷元對DSS誘導小鼠結腸組織炎癥因子含量的影響(±s,n=6,pg/mg)Tab.1 Effect of arctigenin on content of inflammatory factors in colon tissues of mice induced by DSS(±s,n=6,pg/mg)
Note:Compared with control group, 1)P<0.01; compared with model group, 2)P<0.01; compared with 10 mg/kg Arctigenin, 3)P<0.01.
Groups Control Model 10 mg/kg Arctigenin 40 mg/kg Arctigenin F TNF-α 26.75±12.51 366.83±28.131)229.07±19.752)IL-1β 55.01±7.30 303.82±28.441)205.52±16.392)IL-6 72.79±6.22 163.48±14.701)136.28±11.522)110.42±12.333)66.34 108.22±9.263)370.40 91.09±8.553)255.60
2.5 牛蒡子苷元減輕DSS 誘導的IBD 小鼠的氧化應激 與對照組比較,DSS 處理的小鼠結腸組織中SOD 活性降低,而10 mg/kg 或40 mg/kg 牛蒡子苷元可顯著提高SOD 活性(P<0.01)。與對照組小鼠相比,DSS 誘導的IBD 模型組小鼠MDA 濃度顯著增加,而10 mg/kg 或40 mg/kg 牛蒡子苷元治療小鼠的MDA濃度明顯降低(P<0.01)。見表2。
表2 牛蒡子苷元對DSS誘導的小鼠結腸組織MDA和SOD含量的影響(±s,n=6)Tab.2 Effect of arctigenin on contents of MDA and SOD in colon tissues of mice induced by DSS (±s,n=6)
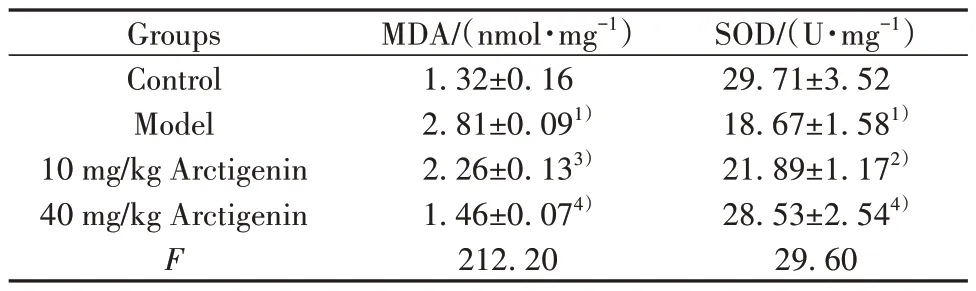
表2 牛蒡子苷元對DSS誘導的小鼠結腸組織MDA和SOD含量的影響(±s,n=6)Tab.2 Effect of arctigenin on contents of MDA and SOD in colon tissues of mice induced by DSS (±s,n=6)
Note:Compared with control group, 1)P<0.01; compared with model group,2)P<0.05,3)P<0.01;compared with 10 mg/kg Arctigenin,4)P<0.01.
SOD/(U·mg-1)29.71±3.52 18.67±1.581)21.89±1.172)28.53±2.544)29.60 Groups Control Model 10 mg/kg Arctigenin 40 mg/kg Arctigenin F MDA/(nmol·mg-1)1.32±0.16 2.81±0.091)2.26±0.133)1.46±0.074)212.20
2.6 牛蒡子苷元抑制DSS 誘導的IBD 小鼠NF-κB通路激活 與對照組相比,模型組小鼠結腸組織中NF-κB p-p65 蛋白表達增加,ZO-1 表達下降(P<0.05);10 mg/kg 和40 mg/kg 牛蒡子苷元組逆轉了DSS 誘導的NF-κB p-p65 表達增加和ZO-1 表達降低(P<0.05)。見圖4。
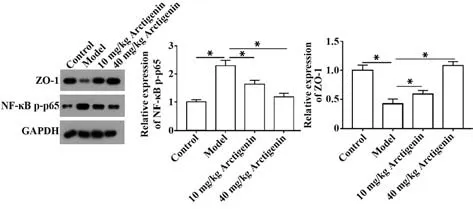
圖4 牛蒡子苷元抑制DSS 誘導的IBD 小鼠NF-κB 通路激活Fig.4 Arctigenin inhibits DSS-induced activation of NFκB pathway in IBD mice
2.7 牛蒡子苷元增強免疫功能和減輕結腸組織損傷 免疫功能的強弱可通過胸腺指數和脾臟指數反映。與對照組相比,DSS誘導后,小鼠胸腺指數和脾臟指數顯著降低(P<0.01);10 mg/kg 或40 mg/kg牛蒡子苷元治療后,小鼠的胸腺指數和脾臟指數升高(P<0.01)。見表3。HE 染色結果顯示:對照組小鼠的結腸組織結構完整,組織絨毛排列整齊,無炎癥細胞浸潤和壞死。IBD 模型組小鼠結腸組織細胞浸潤絨毛排列紊亂,黏膜上皮細胞結構被破壞,有中性粒細胞浸潤跡象,個別區域細胞壞死明顯。10 mg/kg 牛蒡子苷元組小鼠結腸組織損傷程度減輕,組織結構層次分明,局部組織炎癥細胞浸潤減少,組織形態較好。40 mg/kg 牛蒡子苷元組結腸組織結構基本完整,腸腺排列整齊,黏膜上皮細胞淋巴細胞浸潤顯著減少。見圖5。
表3 胸腺指數和脾臟指數(±s,n=6)Tab.3 Thymus index and spleen index (±s,n=6)
Note:Compared with control group, 1)P<0.01; compared with model group, 2)P<0.05; compared with 10 mg/kg Arctigenin, 3)P<0.05.
Spleen index 0.006 16±0.000 57 0.004 08±0.000 391)0.004 77±0.000 432)0.005 42±0.000 483)21.29 Groups Control Model 10 mg/kg Arctigenin 40 mg/kg Arctigenin F Thymus index 0.001 83±0.000 12 0.001 31±0.000 181)0.001 52±0.000 142)0.001 74±0.000 183)24.79
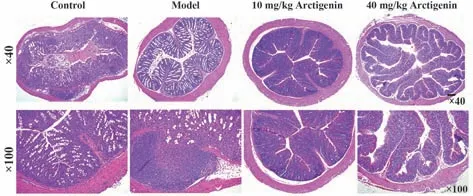
圖5 牛蒡子苷元對DSS誘導的IBD小鼠結腸組織病理學的影響Fig.5 Effect of arctigenin on colonic histopathology of DSS-induced IBD mice
3 討論
IBD 是消化道常見的一種復發性、長期性的炎癥性疾病,對患者的身心健康有害。此外,IBD 屬于自身免疫性疾病,可能增加結直腸癌患病風險。目前用于改善IBD相關臨床癥狀和炎癥的藥物包括糖皮質激素、氨基水楊酸、免疫抑制劑和其他生物制劑。然而,這些藥物也有副作用。因此,開發更安全、有效和靶向治療IBD的藥物是必要的。
越來越多的研究表明牛蒡子苷元具有多種生物功能。牛蒡子苷元已被報道可抑制小鼠免疫細胞防止急性肝炎引起的肝損傷[10]。HYAM 等[11]發現牛蒡子苷元通過抑制PI3K/AKT 通路將M1 巨噬細胞極化為M2 樣巨噬細胞來改善體外和體內炎癥。ZHANG 等[12]發現牛蒡子苷元通過抑制MAPK、HO-1 和iNOS 的信號傳導,降低LPS 誘導的急性肺損傷,其分子機制可能與其抗炎和抗氧化應激的能力有關。此外,已有文獻報道牛蒡子苷元顯示出較高的抗癌活性,可以促進結腸癌細胞凋亡[13]。鑒于以上結果,本研究通過體內和體外實驗探討牛蒡子苷元對IBD 的治療作用及機制。體外研究結果表明,LPS刺激人腸道細胞Caco-2后,炎癥因子TNF-α、IL-1β 和IL-6 分泌顯著增加,SOD 活性降低,MDA 含量增加。牛蒡子苷元可明顯降低炎癥因子的分泌以及氧化應激水平。本研究通過小鼠自由飲用4%DSS 溶液7 d 誘導潰瘍性IBD 小鼠模型,從而進行體內研究。造模3 d 后,小鼠的脾臟指數和胸腺指數降低,表明免疫功能被抑制;同時觀察到,小鼠結腸黏膜損傷,結腸組織中MDA和炎癥因子TNF-α,IL-1β和IL-6水平均上升,SOD水平下降。高劑量牛蒡子苷元可明顯減輕DSS 誘導的腸黏膜損傷,抑制炎癥因子分泌和氧化應激水平。
目前有關IBD的病因和發病機制仍不明確。大量的文獻表明,IBD 的發病機制涉及復雜的炎癥反應。IBD 時腸黏膜促炎細胞因子表達升高,而抑炎細胞因子分泌相對不足,使腸黏膜發生炎癥反應,引起腸道損傷[14-15]。氧化應激在慢性炎癥過程中發揮直接作用,可導致中性粒細胞和巨噬細胞的數量增加,從而促進炎癥反應的發生[16]。NF-κB 通路已被證明與炎癥反應和IBD 密切相關。在IBD 中,miR-19b 通過上調Runx3、阻斷NF-κB 和PI3K/AKT信號通路緩解LPS 誘導的Caco-2 細胞炎癥損傷[17]。IBRAHIM 等[18]發現,PIK3R3 通過NF-κB 通路調控炎癥性腸病中ZO-1 表達,抑制PIK3R3 使NF-κB 通路失活,ZO-1表達下調,進而減輕IBD。以上研究表明,抑制NF-κB 通路的激活,可顯著改善IBD。已有研究對牛蒡子苷元與NF-κB 通路的關系進行了探究。ZHOU 等[19]發現牛蒡子苷元通過抑制小鼠PI3K/AKT 和NF-κB 信號通路,抑制炎癥因子的表達,從而防止骨關節炎。牛蒡子苷元通過HMGB1/TLR4-和TNF-α/TNFR1-介導的NF-κB 信號通路激活減輕神經炎癥,發揮抗抑郁作用[20]。然而,牛蒡子苷元是否可以通過抑制NF-κB 激活減輕炎癥從而緩解IBD 尚未見報道。因此,本課題組對牛蒡子苷元進行研究。體內和體外實驗結果顯示,牛蒡子苷元通過降低NF-κB p-65 蛋白表達,抑制NF-κB 通路激活,促進ZO-1表達,減輕IBD。
綜上所述,本研究結果表明了牛蒡子苷元通過調節NF-κB/ZO-1 通路抑制炎癥因子分泌和氧化應激,從而對IBD有顯著的改善作用。