西瓜連作根際土壤微生物群落演替特征
郭晗玥,王東升,阮楊,喬亦鑄,張蕓滔,李玲,黃啟為,郭世偉,凌寧,沈其榮
西瓜連作根際土壤微生物群落演替特征

1南京農業大學資源與環境科學學院/國家有機肥重點實驗室/江蘇省固體有機廢物利用重點實驗室,南京 210095;2南京市蔬菜科學研究所,南京210042
【目的】研究連作對西瓜根際土壤中細菌、真菌群落構建和潛在功能的影響,明確根際微生物對環境變化的適應性,為西瓜連作障礙的生態防治和農田土壤的健康保持提供理論基礎。【方法】以未連作(對照)、連作2茬和連作 6茬的西瓜根際土壤為研究對象,利用16S rRNA和ITS高通量測序技術解析西瓜連作對根際土壤細菌、真菌群落特征和演替的影響。【結果】隨著連作茬次的增加,西瓜根際土壤中細菌多樣性指數呈現先下降后上升趨勢,真菌多樣性指數顯著下降。在細菌屬水平,多茬次的連作降低了西瓜根際土壤中鞘氨醇單胞菌屬()和溶桿菌屬()的相對豐度;在真菌屬水平,鐮刀菌屬()相對豐度隨連作茬次增加呈增加趨勢。與對照相比,連作的網絡復雜度更高,但網絡結構穩定性低。此外,相比于對照,連作6茬顯著減少有害物質的生物降解途徑以及氨基酸的代謝途徑的相對豐度,并且在連作6茬后真菌群落中病原真菌相對豐度顯著增多。在群落演替過程中,隨機性過程主導連作下西瓜根際細菌群落構建,而確定性過程主導連作下西瓜根際真菌群落構建。【結論】連作引起根際細菌和真菌的群落特征、功能組成和演替過程變化,細菌群落關鍵功能的減少、病原真菌相對豐度的增加以及微生物群落網絡穩定性的減小可能是導致西瓜連作障礙發生的重要因素。
西瓜;連作土壤;根際微生物群落;功能預測;群落演替
0 引言
【研究意義】西瓜(Thunb. Matsum and Naka)是我國乃至世界主要的夏季水果之一[1],其具有較高的經濟價值以及巨大的市場需求,促使農戶利用現代農業技術進行集約化生產。然而西瓜連年單作現象十分普遍[2],導致西瓜連作障礙愈發嚴重且成為了限制西瓜產業持續穩定發展的重要因素[3]。長期連作也會引起土壤理化性質改變、土壤病原菌富集以及自毒物質的積累,最終導致作物生長受限[4-5]。土壤微生物在保持土壤功能和根際生態系統可持續性方面起著至關重要的作用,且通常被認為是土壤健康的敏感生物指標[6-7]。研究連作對西瓜根際土壤中細菌、真菌群落結構和多樣性的影響,對防治西瓜連作障礙和保持農田土壤的健康具有重要意義。【前人研究進展】有研究表明,對連作土壤進行滅菌能夠顯著提高植物的生長和品質[8],這表明生物因素是植物連作土壤病害發生的主要原因。植物根際擁有大量微生物,它們參與土壤養分循環,影響植物對養分的吸收與利用,對于植物生長起著至關重要的作用[9-10]。植物根際同時也是土傳病原菌進入植物的必經之地,在入侵植物體之前,病原菌會先與土著微生物競爭生態位,再從根際感染植物體[5,11]。過往研究發現,長期的單一作物栽培所引起的土壤性質惡化以及植物根系分泌物在內的化感作用會改變根際微生物群落特征[12-14]。有研究表明,連作會簡化土壤微生物群落生態網絡并降低網絡穩定性,這可能與土壤理化性質惡化、土壤肥力下降密切相關[15]。此外,了解微生物群落組裝的生態過程有助于識別微生物群落組成如何響應環境變化,其中確定性過程和隨機性過程基于生態位理論和中性理論,通常用于解釋微生物群落構建[16]。確定性過程包括非生物(pH、鹽度、有機碳含量[17-18])和生物(捕食、共生和寄生等[19])因素,決定物種的存在與否和相對豐度,與生態選擇相關;隨機過程包括不可預測的擾動、概率性的散布和隨機的出生-死亡事件等,這些變化不是由環境決定的適應性結果。確定性過程和隨機過程在構建生態群落中同時起作用來調節群落構建[20-21]。【本研究切入點】目前對西瓜長期連作體系下根際土壤微生物群落特征及其構建過程研究較少,這對于預測根際微生物在調節植物-微生物生態系統功能中的作用是至關重要的。【擬解決的關鍵問題】本研究以不同連作茬次的西瓜為研究對象,采用16S rRNA和ITS高通量測序技術,研究連作對西瓜根際土壤細菌和真菌群落組成的影響,同時結合PICRUSt2和FUNGuild分別分析連作土壤細菌群落功能和真菌營養型變化,并探究連作對根際微生物分子生態網絡復雜性和穩定性的影響,最后通過計算Modified Stochasticity Ratio(校正的隨機率)來解析根際微生物群落構建機制。總之,研究有助于揭示西瓜連作的障礙機制,從而為西瓜的種植和產業可持續發展提供理論支持。
1 材料與方法
1.1 研究地點概況
在南京市蔬菜花卉科學研究所(31°43′N,118°47′E)建立了一個長期試驗大棚。試驗地土壤為黃棕壤,年平均日照時數2 016.4 h,年均氣溫14.7℃。
1.2 試驗設計和土壤樣品采集
本試驗在同一地塊種植品種為8424西瓜,種植面積為28 m2,共種植32株,種植間距為0.45 m,其生長期間日均溫度38℃,夜均溫度24℃。自2014年,每年進行春(3月)、秋(8月)兩茬種植。本試驗共設置3個連作時間點進行采樣,分別于2014(西瓜未連作,對照組CK)、2015(連作2茬,CC2)、2017年(連作6茬,CC6)的5月采集西瓜根際土壤樣品。在每一個時間點隨機采取9株長勢相似西瓜的根際土,其中每3株合并為一個混合樣本,即每個時間點有3個重復樣本。共獲得9個樣本(3個時間點×3次重復)。對于根際土壤的采集,將根部完整取出,并輕微搖動去除松散的可見土壤[22]。將根樣品切成約2 cm小段,裝入50 mL無菌無酶離心管中,加入適量無菌蒸餾水,置于搖床中以180 r/min轉速振蕩30 min,洗滌緊貼根部表面的土壤,之后將離心管中的根取出,并以8 000 r/min離心10 min得到根際土壤樣品[23],將收集的根際土壤保存在-80℃冰箱中進行后續分析。
1.3 DNA提取和Illumina MiSeq測序
使用FastDNA?(MP Biomedicals, Cleveland, OH, USA)土壤DNA提取試劑盒從0.5 g濕重土壤中提取根際土壤微生物總DNA。之后使用Qubit?DNA濃度檢測試劑盒測定提取的DNA質量。分別使用引物515F/907R和ITS1F/ITS2R引物擴增細菌基因V4—V5區和真菌基因ITS1區。使用Illumina Miseq系統進行測序。
1.4 數據統計與分析
使用MOTHUR軟件對下機數據進行質量控制[24]。具體而言,將短序列以及低質量序列進行去除,通過數據庫比對,去除存在的嵌合體序列。將剩余的高質量序列以97%的閾值生成可操作分類單元(operational taxonomic units,OTUs)并選取代表序列進行分類學分析,再基于樣本最小序列數對所有樣本抽平后計算chao1、richness和shannon多樣性指數。基于 Bray-Curtis 距離用“R(v4.0.2)”中的“vegan”包進行主坐標分析(PCoA)。使用“pheatmap”和“ggplot2”包在R環境中揭示不同土壤樣品中細菌和真菌物種在門水平和屬水平上的差異。采用PICRUSt2軟件對細菌OTU豐度表進行標準化后進行功能基因預測分析,將OTU信息與KEGG(Kyoto Encyclo-pediaof Genesand Genomes)數據庫進行比對,獲得三級功能基因的豐度,參考KEGG的二級代謝通路的功能基因類別劃分歸類,獲得功能基因組成。為了確定真菌營養模式分類群,使用FUNGuild進行注釋[25],并保留probable和highly probable置信度的數據,以及single mode和mixed mode的數據。
使用隨機矩陣理論(RMT)自動確定合適的網絡閾值[26],基于所有處理的細菌和真菌總OTU豐度矩陣進行物種共發生網絡分析并使用Gephi0.9.2得到細菌總網絡和真菌總網絡。之后從總節點和邊文件中抽提出每個處理所擁有的節點和邊,得到每個處理的細菌子網絡和真菌子網絡。通過計算網絡各節點的模塊內連通性()和模塊間連通性(),識別網絡中潛在關鍵物種[27]。通過計算和值的大小,將網絡關鍵物種劃分為三類:模塊中心(模塊內高度連接的節點,>2.5和<0.62)、網絡中心(整個網絡內高度連接的節點,>2.5和>0.62)和網絡連接節點(連接不同模塊的節點,<2.5和>0.62)[26]。使用Gephi0.9.2繪制網絡圖。使用自然連通度指標確定網絡結構的穩定性[28],通過去除網絡中的節點來模擬受到的外界擾動,并計算節點去除后網絡的穩定性,以評估網絡在受到隨機攻擊后穩定性下降的速度。最后,使用校正的隨機率(modified stochasticity ratio,MST)來量化確定性和隨機過程在群落組裝過程中的相對重要性,以50%作為更確定性(MST<50%)和更隨機(MST>50%)集合之間的分界點[16]。
2 結果
2.1 連作對西瓜根際細菌和真菌群落多樣性和組成的影響
不同連作茬次下西瓜根際細菌群落的chao1、richness和shannon指數隨著連作茬次的延長呈現先下降后上升的趨勢(圖1-A),而真菌群落的相應指數顯著降低(圖1-B)。這表明,連作在一定程度上有利于細菌群落豐富度的增加,而降低了真菌群落豐富度。基于Bray-Curtis距離的主坐標分析(PCoA)對對照、連作2茬、連作6茬的根際細菌和真菌群落組成特征進行可視化,結果表明,不同連作茬次中根際細菌和真菌群落聚集成不同的簇,也說明了隨著連作茬次的增加,微生物群落組成發生顯著改變(圖2-A,Adonis2=0.71,=0.003;圖2-B,Adonis2=0.84,=0.004)。
我們將平均相對豐度大于1%的細菌門和真菌門劃分為優勢菌門,3種不同連作茬次的根際土壤中細菌優勢門分別是變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)、放線菌門(Actinobacteria)(圖2-C)。在細菌群落中,變形菌門在3種不同連作茬次中土壤的比例均最高,占比為83.3%—47.1%,并且隨著連作茬次增加呈先減少后增加趨勢。相比于對照,擬桿菌門和厚壁菌門的相對豐度在連作2茬中增加了22.2%和11.2%,而在連作6茬中分別增加了5.1%和0.76%(圖2-C)。屬于優勢真菌門的是子囊菌門(Ascomycota)、擔子菌門(Basidiomycota)、壺菌門(Chytridiomycota)(圖2-D)。真菌群落中,子囊菌門和擔子菌門不僅相對豐度最高,且隨連作茬次表現出不同的差異變化。在真菌群落中,子囊菌門在3個不同連作茬次土壤中的占比均最高,為32.16%—66.1%,并且其相對豐度隨連作茬次增加呈先減少后增加趨勢。而擔子菌門的相對豐度呈先增加后減少趨勢(圖2-D)。在屬水平,相比于對照,連作2茬和6茬細菌群落中鞘氨醇單胞菌屬()相對豐度分別減少了4.5%和0.6%,鞘氨醇菌屬()相對豐度分別減少了7.6%和7.2%,溶桿菌屬()相對豐度分別減少了2.5%和1.6%;連作6茬與對照相比,劍菌屬()和芽孢桿菌屬()相對豐度分別減少了1.1%和0.2%(圖2-E)。真菌群落中,相比于對照,連作2茬和6茬的鐮刀菌屬()相對豐度分別增加了4.1%和60.6%(圖2-F)。這些結果表明連作過程明顯改變了根際細菌、真菌群落結構,且群落組成相似度隨連作茬次的增加而降低。
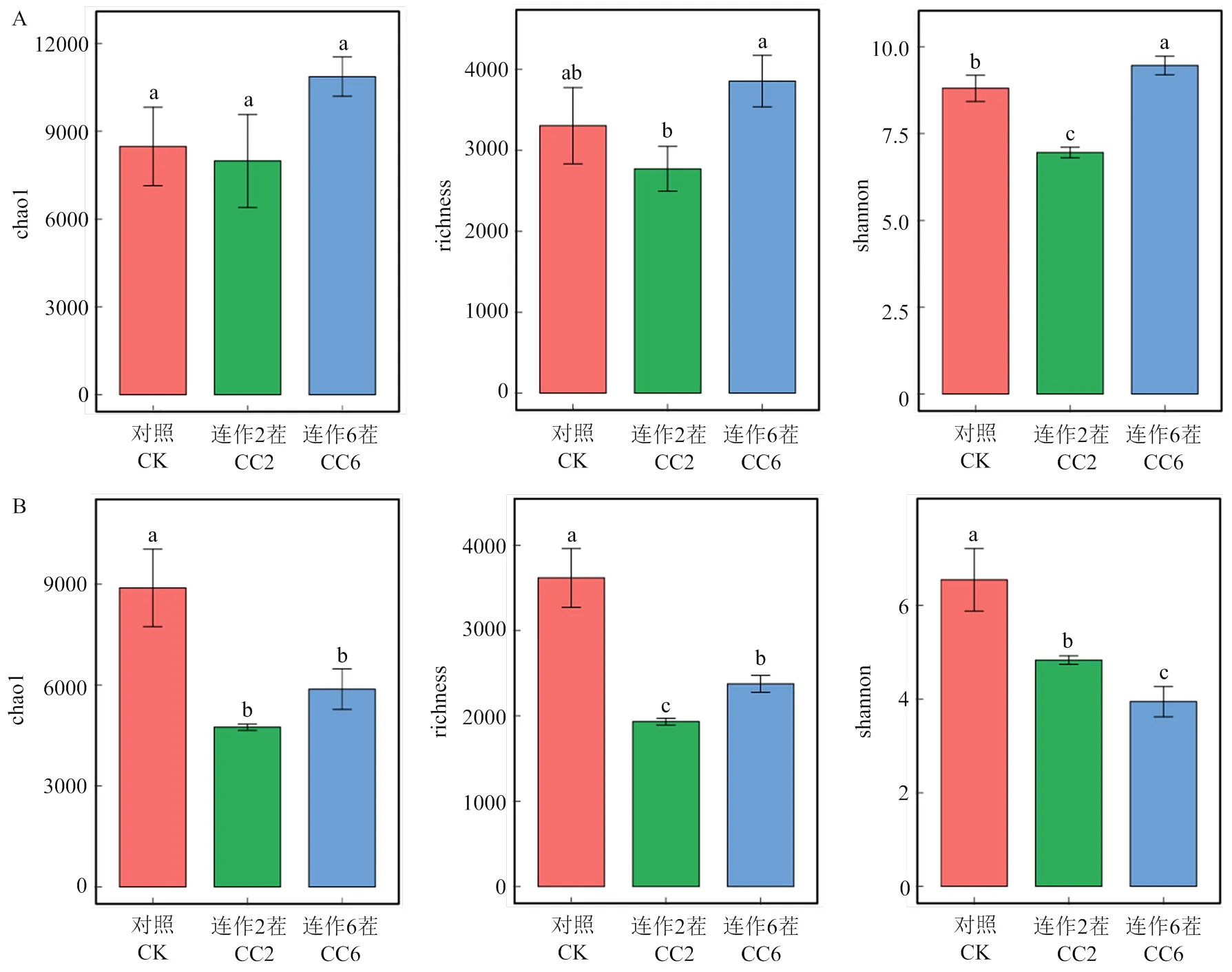
A:不同連作茬次下根際細菌群落chao1、richness和shannon指數;B:不同連作茬次下根際真菌群落chao1、richness和shannon指數。不同的字母表示不同處理間細菌、真菌豐度的顯著差異(P<0.05)
2.2 連作對西瓜根際細菌和真菌群落預測功能的影響
采用PICRUSt2對各個連作茬次中根際細菌群落進行功能預測。在三級功能水平的預測功能中,對照的西瓜根際細菌群落共得到297個代謝通路,相較于其他兩個時期,富集了50個代謝通路;連作2茬共得到295個代謝通路,相較于其他兩個時期,富集了41個代謝通路;連作6茬共得到298個代謝通路,相較于其他兩個時期,富集了26個代謝通路(圖3-a)。將所獲得相對豐度高的代謝通路進行二級功能水平歸類,結果顯示,除其他次生代謝物的生物合成外,其余功能基因的相對豐度隨連作茬次變化均有不同的響應(圖3-c)。相比于對照,連作2茬會顯著減少碳水化合物、萜類和多酮類化合物的代謝、細胞生長和死亡等代謝途徑相對豐度,而增加了復制和修復、輔助因子和維生素的代謝、運輸和分解代謝等途徑;連作6茬會顯著減少有害物質的生物降解和代謝及其他氨基酸的代謝等途徑的相對豐度,反而增加了多糖的生物合成和代謝途徑(圖3-c)。真菌功能群使用FUNGuild進行預測,其中連作6茬會顯著富集病理型(pathotroph)真菌(圖3-b)。其中相比于對照,連作6茬會顯著富Plant pathogen(植物病原體)類型真菌,而Soil saprotroph(土壤腐生生物)會顯著減少(圖3-d)。
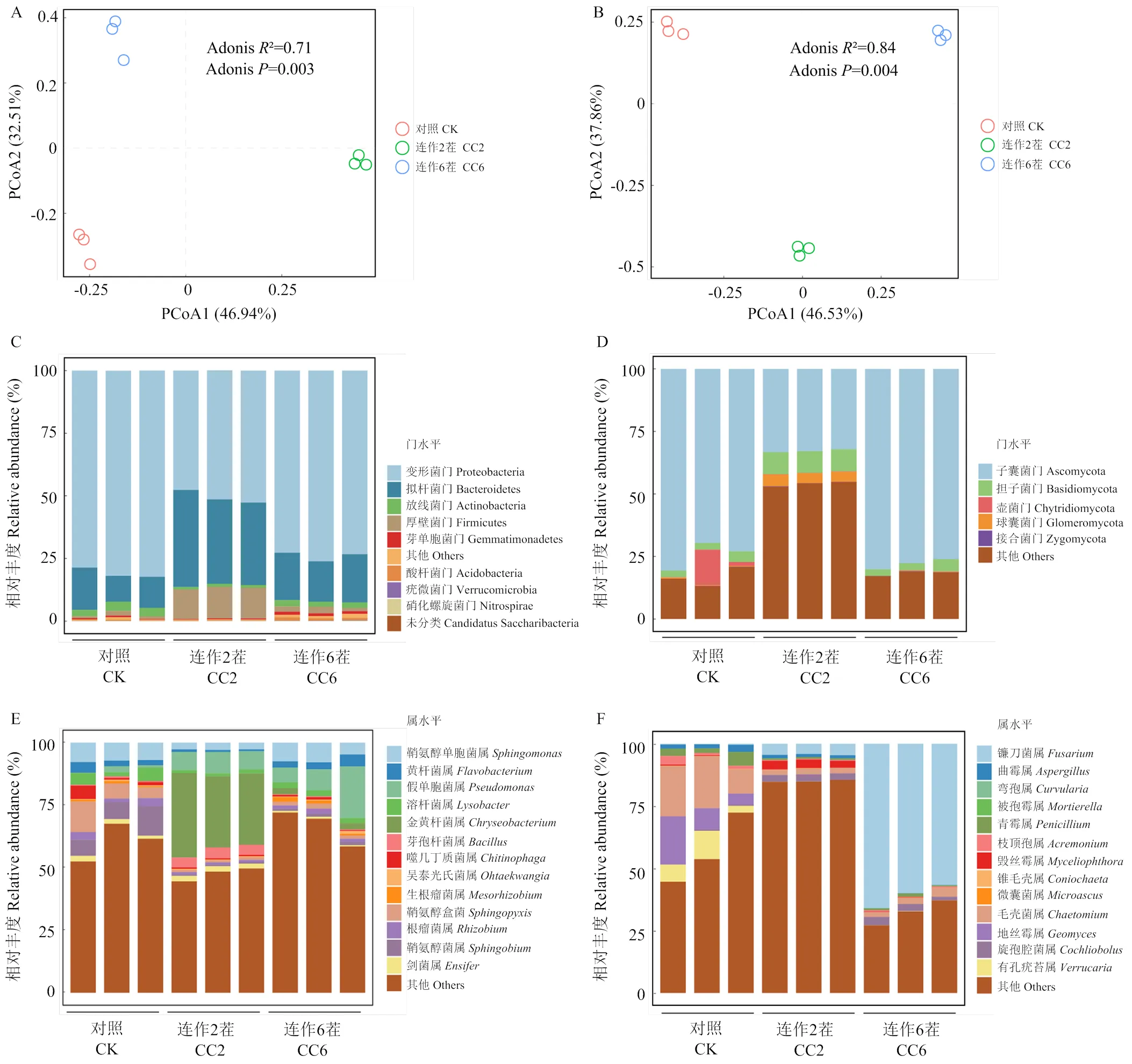
A:不同連作茬次下根際細菌群落主坐標分析(PCoA);B:不同連作茬次下根際真菌群落主坐標分析(PCoA);C:不同連作茬次下根際細菌群落門水平組成;D:不同連作茬次下根際真菌群落門水平組成;E:不同連作茬次下根際細菌群落屬水平組成;F:不同連作茬次下根際真菌群落屬水平組成
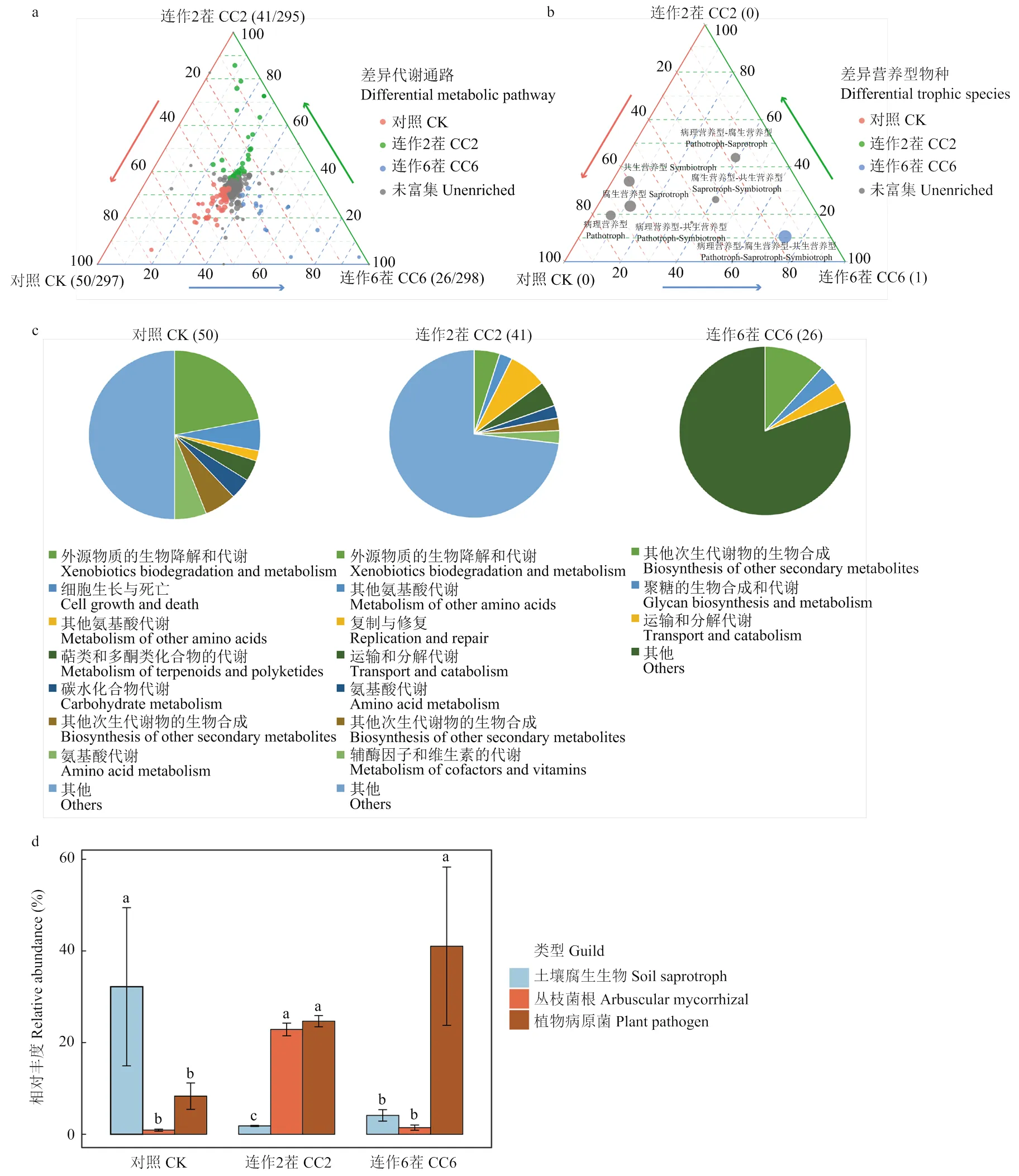
a:不同連作茬次中KEGG三級代謝通路相對豐度差異變化。括號中的數字分別代表著比其他兩個處理顯著富集的代謝通路數量和預測得到的代謝通路總數;b:不同連作茬次中根際真菌營養型相對豐度的差異分析,括號中的數字代表著比其他兩個處理顯著富集的真菌營養型數量;c:餅圖表示將圖a中富集的三級代謝通路歸類于二級代謝通路;d:不同連作茬次中根際真菌營養亞型相對豐度的差異分析
2.3 連作對西瓜根際細菌和真菌群落共生網絡結構和關鍵物種的影響
基于OTU豐度矩陣進行物種共發生網絡分析并得到細菌總網絡和子網絡以及真菌總網絡和子網絡(圖4-a)(見方法2.4)。結果顯示,連作2茬與連作6茬的根際細菌和真菌網絡比對照具有更多的網絡節點、平均度和種間相互作用,而模塊化指數隨著連作茬次增加而下降(表1)。變形菌門在3個連作茬次(對照組、連作2茬和連作6茬,分別占62.6%、63.4%和65.9%)的網絡互作關系中占主導地位,與其他物種相互聯系的數量最多(圖4-a)。這表明與對照相比,連作增加了網絡中變形菌門物種的比例。在真菌群落網絡中,子囊菌門在3個連作茬次中(對照組、連作2茬和連作6茬,分別占73.2%、70.7%和69.6%)的網絡互作關系中占主導地位,與其他物種相互聯系的數量最多(圖4-d)。這表明與對照相比,連作減少了網絡中子囊菌門物種的比例。此外,對照、連作2茬與連作6茬的真菌共生網絡中正相關連接數占比分別為41.33%、51.48%和55.30%(表1),表明在連作過程中根際真菌間趨于競爭關系而不是合作關系。
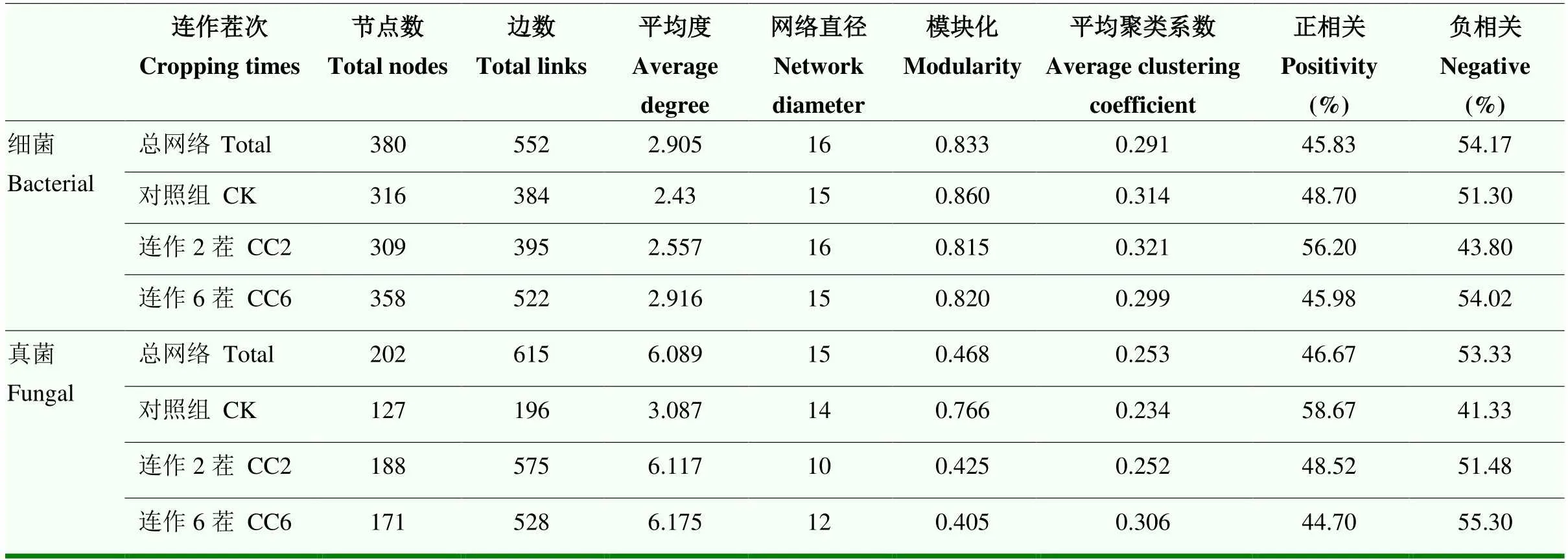
表1 不同連作茬次下西瓜根際細菌和真菌網絡拓撲結構
網絡結構穩定性的結果顯示,在細菌群落中,雖然連作6茬的根際初始網絡自然連通性最高(0.0078),其次是連作2茬(0.0075)和對照網絡(0.0068),但是當去除20%的網絡節點時,連作6茬的自然連通性急劇降至0.0028;當去除40%的網絡節點時,連作2茬的自然連通性急劇降至0.0024(圖4-b)。隨著節點不斷被移除,對照網絡的連通度下降趨勢(Slope=-0.004)比連作2茬(Slope=-0.005)和連作6茬(Slope=-0.006)更加平穩(圖4-b)。而真菌群落中,連作6茬的根際初始網絡自然連通性仍是最高(0.085),其次是對照組(0.023)和連作2茬(0.013)網絡,但是當去除40%的網絡節點時,連作6茬的自然連通性急劇降至0.0071,而連作2茬網絡隨著節點不斷被移除,其自然連通性下降趨勢(Slope=-0.011)比連作2茬(Slope=-0.021)和連作6茬(Slope=-0.077)更加平穩(圖4-e);對照網絡在去除20%的網絡節點后,其自然連通性穩定在一定水平(圖4-e)。這些結果表明在移除網絡節點后,對照的根際微生物網絡結構仍保持相對較高的穩定性。
對照的細菌群落共擁有9個關鍵物種(圖4-c),網絡模塊中心(module hubs)主要來源于變形菌門和厚壁菌門,其中主要來自于假單胞菌屬()、芽孢桿菌屬()和鞘氨醇單胞菌屬()等。對照的真菌群落共擁有1個關鍵物種(圖4-f),網絡模塊中心(module hubs)主要來源于子囊菌門的閉小囊菌屬()。
2.4 連作對西瓜根際細菌和真菌群落構建過程的影響
使用校正的隨機率(MST)定量生態過程中的隨機性和確定性。結果表明,在細菌群落中,隨機性過程在對照和連作6茬的細菌群落內占主導,而在連作2茬的細菌群落中確定性過程占主導(圖5-A);在真菌群落中,確定性過程在連作2茬和連作6茬中占主導(圖5-B)。
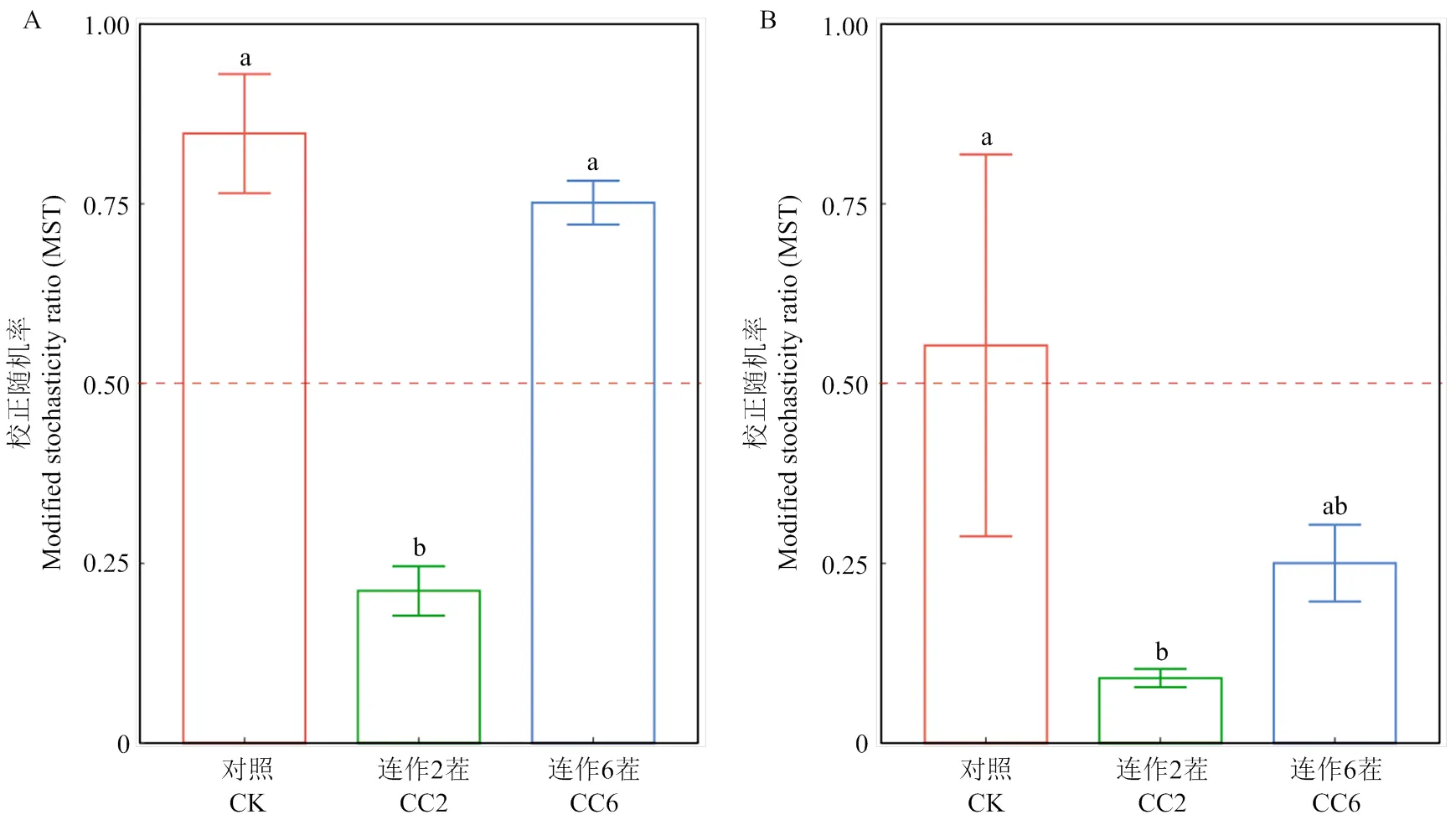
A:不同連作茬次下根際細菌群落的MST柱狀圖;B:不同連作茬次下根際真菌群落的MST柱狀圖。不同的字母表示不同處理間的顯著差異(P<0.05)
3 討論
3.1 西瓜連作對根際土壤細菌和真菌群落組成和功能的影響
在本研究中,利用Illumina Miseq高通量技術分析了連作后西瓜根際土壤細菌和真菌群落結構。我們發現隨著連作茬次的增加,細菌和真菌群落特征差異較大。這可能是由于在連作系統中,相同的田間管理模式、植物化感物質的長期累積以及同類型根系分泌物長期釋放的生態效應,會使微生物區系發生顯著改變[13,29]。具體來說,相比于對照,西瓜根際細菌群落的richness和shannon指數在連作2茬和6茬中表現出先下降后上升的趨勢,而chao1指數沒有顯著的變化,這與部分前人的研究結果一致[30-31]。多樣性指數出現下降的原因可能是在2茬的連作過程中肥料的添加會暫時的增加營養物質,土壤中的部分物種對營養物質的添加反應迅速,進而通過快速繁殖占領寡營養微生物的生態位,導致微生物多樣性立即下降[32]。而連作6茬過程中,隨著養分長期大量的積累,包括肥料的連續性投入和植物分泌物和殘體遺留,土壤中生態位會在一定程度上擴張,會有更多的有機物質和養分易被微生物利用,從而促進了細菌的生長,有利于根際土壤中細菌多樣性的提高。有研究表明,變形菌門和酸桿菌門在養分循環中起重要作用,并且也與抑制病害等功能相關[33-35]。其中鞘氨醇單胞菌屬(變形菌門)具有降解多環芳烴和降低纖維素的能力[36],溶桿菌屬(變形菌門)對真菌、革蘭氏陰性細菌、革蘭氏陽性細菌和線蟲都有突出的拮抗作用[37]。而本研究結果中,相對于對照,連作后的變形菌門和酸桿菌門的相對豐度都呈現降低的趨勢,而且鞘氨醇單胞菌屬和芽孢桿菌屬等的相對豐度降低,從而導致植物抵御病原菌感染的能力下降,并且這種降低也會增加發生土壤病害的風險。而連作后的真菌群落相比于對照,chao1、richness和shannon指數顯著降低,這與吳鳳芝等的研究結果相一致[38]。有研究指出,微生物多樣性的減少是發生土壤病害的重要原因[5],而在本研究中真菌群落的多樣性指數在連作后顯著降低,可能增加發生土壤病害的風險。在真菌群落中,有研究表明鐮刀菌屬(子囊菌門)為致病菌,會引起西瓜、黃瓜枯萎病的發生[39-40],而本研究結果顯示出鐮刀菌屬的相對豐度在連作6茬后顯著增加。在CHEN等[41]的研究中得出,真菌病原體的增加和有益真菌的減少可能是導致連作植物生長和產量下降的重要因素。因此,連作會改變微生物群落多樣性和組成,破壞根際生態平衡,從而更加容易引起連作障礙。
我們利用PICRUSt2對不同連作茬次下根際細菌群落進行功能預測,發現根際細菌群落積極參與了基本的代謝過程。其中碳水化合物代謝途徑與固氮、溶磷等作用有著密切的關聯,而且該途徑的產物為其他物質的合成提供了原料[42];有害物質的生物降解和代謝途徑包括了苯甲酸降解、多環芳烴降解和二甲苯降解途徑,這些途徑與植物抗逆能力密切相關;氨基酸代謝與脫氨和轉氨等作用息息相關,并且主要參與了植物氮素循環[43]。而本研究的結果表明,連作會減少根際細菌對碳源的利用、有害物質的降解及次生代謝物的合成代謝途徑。尤其是相比于對照,連作6茬后的根際細菌氨基酸代謝相對豐度顯著降低,這可能表明連作后根際環境不利于細菌的繁殖、代謝和合成物質,并且土壤養分循環可能受到一定程度的抑制。因此,在連作下,一些比較重要的代謝功能(如,碳水化合物代謝途徑,有害物質的降解和次生代謝物的合成代謝途徑)的減少或者喪失會是形成連作障礙的主要原因之一[44]。此外,我們利用FUNGuild來確定真菌分類群的營養模式。結果顯示,相比于對照,連作6茬會顯著增加病原真菌,這種真菌會通過損害宿主細胞而獲取營養[45],并且營養亞型中植物病原體(如鐮刀菌屬)的相對豐度也會顯著增加,這些也可能是引起連作障礙的主要原因之一。
3.2 西瓜連作對根際土壤細菌和真菌群落網絡結構的影響
物種間相互作用是影響土壤病害的發生一種重要的生物因素,在群落構建過程中發揮重要作用[46],與關鍵生態過程和宿主健康密切相關[47]。本研究結果表明,多茬次的連作使細菌和真菌群落產生更復雜的潛在相互作用,這可能是因為植物殘體量的增加,以及前茬作物產生的各種分泌物和遺傳效應影響土壤微生物群落[48]。對照的網絡直徑和模塊化均大于連作2茬和連作6茬,并且有研究指出具有更高模塊化的微生物網絡結構更能抵抗環境干擾[44,49]。因此,連作會導致根際微生物對環境變化的抵抗力減弱,容易引起連作障礙的發生。另外,本研究結果表明,在去除一定比例的網絡節點后,連作6茬的網絡穩定性指數急劇下降,表明連作使西瓜根際網絡結構更加脆弱。因此,連作時長可能是影響根際網絡穩定性的關鍵因素。
網絡中潛在的關鍵物種在維持多物種共存和生態系統功能方面可能至關重要[50-51]。我們觀察到,在對照的西瓜根際微生物網絡中,關鍵類群有芽孢桿菌屬()、鞘氨醇菌屬()、劍菌屬()和鞘氨醇單胞菌()等菌屬。據報道芽孢桿菌屬具有分解土壤中有機物的能力,如纖維素和木質素[52];鞘氨醇單胞菌屬的成員具有降解復雜有機物質、拮抗植物病原真菌以及分泌胞外多糖等多種生態功能[53];鞘氨醇菌屬能降解多環芳烴或酚類有機物[54],適應環境能力強[55];劍菌屬能夠作為有益菌接種至土壤中促進植物的生長[56],有助于維持植物激素平衡、控制根系發育、促進營養獲取以及預防宿主植物疾病[57]。而在連作6茬后這些關鍵類群的相對豐度相比于對照發生了明顯的減少,因此連作土壤病害的發生可能是由于關鍵類群的減少或者缺失。
3.3 西瓜連作對根際土壤細菌和真菌群落組裝的影響
為了更好地了解微生物群落組成如何響應環境變化,我們探究了西瓜根際微生物群落組裝的生態過程。在本研究中,當短期連作時(連作2茬),一些非生物環境因素(如pH、鹽度、有機碳含量)的選擇(環境過濾和物種間相互的拮抗與協同作用)會使細菌群落構建過程從隨機性轉變為確定性[20];但在較長連作茬次下,細菌種群更容易受到隨機性事件的影響,這可以用體型-可塑性假說來解釋[58],即較小的生物更可能受到擴散限制而不是物種分類的影響,因為較小的生物(如,細菌類群)具有更大的代謝可塑性和更大的環境耐受性,因此可以生活在不同的棲息地[59];相對于真菌的生活史策略而言,細菌類群的生存策略更加傾向于r策略,且在長期連作下,養分較為充足,細菌的生長沒有受到環境的限制,趨向于隨機性過程。而在真菌群落中,隨機性過程在對照中更為突出,但連作后逐漸轉變為確定性過程。這可能是一些環境變量對根際微生物群落的組裝的潛在影響,如植物分泌物和殘體的增加、土壤理化性質的變化等。環境因素的差異也可能隨著連作茬次的增加而增加,并在根際微生物群落構建中發揮關鍵作用[60]。值得注意的是,當地環境的變化逐漸增加了真菌群落的確定性選擇的重要性,而細菌群落的隨機性卻占主導,這可能是因為長期連作引起環境變化是由真菌性病害引起的(即由尖孢鐮刀菌引起的西瓜枯萎病),植物可能會向環境釋放特定的次生物質來招募更多的病原性真菌[12-14],真菌群落因此會受到更強的環境選擇。同時細菌和真菌群落的MST值也呈現先降低后增大的趨勢,表明隨機性和確定性過程共同調控著連作環境下根際微生物群落的構建。
4 結論
多茬次的連作顯著影響了西瓜根際細菌和真菌群落結構,包括有益菌屬的相對豐度減少和致病菌屬的相對豐度增加,也會導致微生物群落網絡的相互作用更加復雜,但群落穩定性和對環境變化的抵抗性減弱。此外,細菌群落功能組成發生顯著變化,包括有害物質的生物降解和代謝,氨基酸的代謝等功能基因相對豐度在長期連作后降低;而真菌群落中病原真菌的相對豐度在連作6茬后顯著增多。多茬次的連作也會使微生物群落組裝的機制發生變化,隨機性和確定性過程共同調控著連作環境下根際微生物群落的構建。因此,在實際生產中,應注意通過輪作或施用微生物肥料來維持西瓜根際土壤微生態的穩定,以緩解連作障礙。本研究結果為理解連作與微生物群落結構差異的關系提供了新視角,并揭示了長期連作下微生物群落構建過程和潛在機制,同時為開發微生物肥料進行土壤改良,進而緩解連作障礙提供理論依據。
[1] 田晴, 高丹美, 李慧, 劉守偉, 周新剛, 吳鳳芝. 小麥根系分泌物對西瓜連作土壤真菌群落結構的影響. 中國農業科學, 2020, 53(5): 1018-1028. doi:10.3864/j.issn.0578-1752.2020.05.013.
TIAN Q, GAO D M, LI H, LIU S W, ZHOU X G, WU F Z. Effects of wheat root exudates on the structure of fungi community in continuous cropping watermelon soil. Scientia Agricultura Sinica, 2020, 53(5): 1018-1028. doi:10.3864/j.issn.0578-1752.2020.05.013. (in Chinese)
[2] 耿士均, 劉刊, 商海燕, 權俊嬌, 陸小平, 王波. 園藝作物連作障礙的研究進展. 北方園藝, 2012(7): 190-195.
GENG S J, LIU K, SHANG H Y, QUAN J J, LU X P, WANG B. Research progress of continuous cropping obstacle in horticultural plants. Northern Horticulture, 2012(7): 190-195. (in Chinese)
[3] MARTYN R. Fusarium wilt of watermelon: 120 years of research. Horticultural Reviews, 2014, 42: 349-442.
[4] 滕凱, 陳前鋒, 周志成, 向青松, 張敏, 尹華群, 劉勇軍. 煙草連作障礙與土壤理化性質及微生物多樣性特征的關聯. 微生物學通報, 2020, 47(9): 2848-2856.
TENG K, CHEN Q F, ZHOU Z C, XIANG Q S, ZHANG M, YIN H Q, LIU Y J. Effect of soil physical and chemical properties and microbial community on continuous cropping obstacles in tobacco field. Microbiology China, 2020, 47(9): 2848-2856. (in Chinese)
[5] YUAN J, WEN T, ZHANG H, ZHAO M L, PENTON C R, THOMASHOW L S, SHEN Q R. Predicting disease occurrence with high accuracy based on soil macroecological patterns of Fusarium wilt. The ISME Journal, 2020, 14(12): 2936-2950.
[6] DESSAUX Y, GRANDCLéMENT C, FAURE D. Engineering the rhizosphere. Trends in Plant Science, 2016, 21(3): 266-278.
[7] BORDENSTEIN S R, THEIS K R. Host biology in light of the microbiome: Ten principles of holobionts and hologenomes. PLoS Biology, 2015, 13(8): e1002226.
[8] 張樹生, 楊興明, 茆澤圣, 黃啟為, 徐陽春, 沈其榮. 連作土滅菌對黃瓜(Cucumis sativus)生長和土壤微生物區系的影響. 生態學報, 2007, 27(5): 1809-1817.
ZHANG S S, YANG X M, MAO Z S, HUANG Q W, XU Y C, SHEN Q R. Effects of sterilization on growth of cucumber plants and soil microflora in a continuous mono-cropping soil. Acta Ecologica Sinica, 2007, 27(5): 1809-1817. (in Chinese)
[9] BRADFORD M A, MCCULLEY R L, CROWTHER T W, OLDFIELD E E, WOOD S A, FIERER N. Cross-biome patterns in soil microbial respiration predictable from evolutionary theory on thermal adaptation. Nature Ecology & Evolution, 2019, 3(2): 223-231.
[10] BAHRAM M, HILDEBRAND F, FORSLUND S K, ANDERSON J L, SOUDZILOVSKAIA N A, BODEGOM P M, BENGTSSON-PALME J, ANSLAN S, COELHO L P, HAREND H, HUERTA-CEPAS J, MEDEMA M H, MALTZ M R, MUNDRA S, OLSSON P A, PENT M, P?LME S, SUNAGAWA S, RYBERG M, TEDERSOO L, BORK P. Structure and function of the global topsoil microbiome. Nature, 2018, 560(7717): 233-237.
[11] GAO Z Y, HAN M K, HU Y Y, LI Z Q, LIU C F, WANG X, TIAN Q, JIAO W J, HU J M, LIU L F, GUAN Z J, MA Z M. Effects of continuous cropping of sweet potato on the fungal community structure in rhizospheric soil. Frontiers in Microbiology, 2019, 10: 2269.
[12] HU L F, ROBERT C A M, CADOT S, ZHANG X, YE M, LI B B, MANZO D, CHERVET N, STEINGER T, VAN DER HEIJDEN M G A, SCHLAEPPI K, ERB M. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota. Nature Communications, 2018, 9: 2738.
[13] LI X G, DING C F, HUA K, ZHANG T L, ZHANG Y N, ZHAO L, YANG Y R, LIU J G, WANG X X. Soil sickness of peanuts is attributable to modifications in soil microbes induced by peanut root exudates rather than to direct allelopathy. Soil Biology and Biochemistry, 2014, 78: 149-159.
[14] XU W H, LIU D, WU F Z, LIU S W. Root exudates of wheat are involved in suppression of Fusarium wilt in watermelon in watermelon-wheat companion cropping. European Journal of Plant Pathology, 2015, 141(1): 209-216.
[15] 曾維愛, 楊昭玥, 黃洋, 谷亞冰, 陶界錳, 劉勇軍, 謝鵬飛, 蔡海林, 尹華群. 長期連作農田土壤細菌群落結構和共現網絡拓撲性質對土壤理化性質的響應. 微生物學報, 2022, 62(6): 2403-2416.
ZENG W A, YANG Z Y, HUANG Y, GU Y B, TAO J M, LIU Y J, XIE P F, CAI H L, YIN H Q. Response of soil bacterial community structure and co-occurrence network topology properties to soil physicochemical properties in long-term continuous cropping farmland. Acta Microbiologica Sinica, 2022, 62(6): 2403-2416. (in Chinese)
[16] NING D L, DENG Y, TIEDJE J M, ZHOU J Z. A general framework for quantitatively assessing ecological stochasticity. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(34): 16892-16898.
[17] GRYTA A, FR?C M, OSZUST K. The application of the biolog EcoPlate approach in ecotoxicological evaluation of dairy sewage sludge. Applied Biochemistry and Biotechnology, 2014, 174(4): 1434-1443.
[18] GUO J J, LIU W B, ZHU C, LUO G W, KONG Y L, LING N, WANG M, DAI J Y, SHEN Q R, GUO S W. Bacterial rather than fungal community composition is associated with microbial activities and nutrient-use efficiencies in a paddy soil with short-term organic amendments. Plant and Soil, 2018, 424(1): 335-349.
[19] GUO H P, DONG P S, GAO F, HUANG L, WANG S P, WANG R Y, YAN M C, ZHANG D M. Sucrose addition directionally enhances bacterial community convergence and network stability of the shrimp culture system. NPJ Biofilms and Microbiomes, 2022, 8: 22.
[20] CHEN Q L, HU H W, YAN Z Z, LI C Y, NGUYEN B A T, SUN A Q, ZHU Y G, HE J Z. Deterministic selection dominates microbial community assembly in termite mounds. Soil Biology and Biochemistry, 2021, 152: 108073.
[21] BURNS A R, STEPHENS W Z, STAGAMAN K, WONG S, RAWLS J F, GUILLEMIN K, BOHANNAN B J. Contribution of neutral processes to the assembly of gut microbial communities in the zebrafish over host development. The ISME Journal, 2016, 10(3): 655-664.
[22] TOJU H, OKAYASU K, NOTAGUCHI M. Leaf-associated microbiomes of grafted tomato plants. Scientific Reports, 2019, 9: 1787.
[23] LING N, SONG Y, RAZA W, HUANG Q W, GUO S W, SHEN Q R. The response of root-associated bacterial community to the grafting of watermelon. Plant and Soil, 2015, 391(1): 253-264.
[24] SCHLOSS P D, WESTCOTT S L, RYABIN T, HALL J R, HARTMANN M, HOLLISTER E B, LESNIEWSKI R A, OAKLEY B B, PARKS D H, ROBINSON C J, SAHL J W, STRES B, THALLINGER G G, VAN HORN D J, WEBER C F. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541.
[25] NGUYEN N H, SONG Z W, BATES S T, BRANCO S, TEDERSOO L, MENKE J, SCHILLING J S, KENNEDY P G. FUNGuild: An open annotation tool for parsing fungal community datasets by ecological guild. Fungal Ecology, 2016, 20: 241-248.
[26] DENG Y, JIANG Y H, YANG Y F, HE Z L, LUO F, ZHOU J Z. Molecular ecological network analyses. BMC Bioinformatics, 2012, 13: 113.
[27] SHI S J, NUCCIO E E, SHI Z J, HE Z L, ZHOU J Z, FIRESTONE M K. The interconnected rhizosphere: high network complexity dominates rhizosphere assemblages. Ecology Letters, 2016, 19(8): 926-936.
[28] PENG G S, WU J. Optimal network topology for structural robustness based on natural connectivity. Physica A: Statistical Mechanics and Its Applications, 2016, 443: 212-220.
[29] LI X G, JOUSSET A, DE BOER W, CARRIóN V J, ZHANG T L, WANG X X, KURAMAE E E. Legacy of land use history determines reprogramming of plant physiology by soil microbiome. The ISME Journal, 2019, 13(3): 738-751.
[30] ZHU S Y, WANG Y Z, XU X M, LIU T M, WU D Q, ZHENG X, TANG S W, DAI Q Z. Potential use of high-throughput sequencing of soil microbial communities for estimating the adverse effects of continuous cropping on ramie (L. Gaud). PLoS ONE, 2018, 13(5): e0197095.
[31] 李晶晶, 續勇波. 連作年限對設施百合土壤微生物多樣性的影響. 土壤通報, 2020, 51(2): 343-351.
LI J J, XU Y B. Effects of continuous cropping years of lily on soil microbial diversities under greenhouse cultivation. Chinese Journal of Soil Science, 2020, 51(2): 343-351. (in Chinese)
[32] VAN BRUGGEN A H C, SEMENOV A M. In search of biological indicators for soil health and disease suppression. Applied Soil Ecology, 2000, 15(1): 13-24.
[33] ZHANG Y, CAO C Y, PENG M, XU X J, ZHANG P, YU Q J, SUN T. Diversity of nitrogen-fixing, ammonia-oxidizing, and denitrifying bacteria in biological soil crusts of a revegetation area in Horqin Sandy Land, Northeast China. Ecological Engineering, 2014, 71: 71-79.
[34] MUNOZ R, TEELING H, AMANN R, ROSSELLó-MóRA R. Ancestry and adaptive radiation of Bacteroidetes as assessed by comparative genomics. Systematic and Applied Microbiology, 2020, 43(2): 126065.
[35] KWAK M J, KONG H G, CHOI K, KWON S K, SONG J Y, LEE J, LEE P A, CHOI S Y, SEO M, LEE H J, JUNG E J, PARK H, ROY N, KIM H, LEE M M, RUBIN E M, LEE S W, KIM J F. Rhizosphere microbiome structure alters to enable wilt resistance in tomato. Nature Biotechnology, 2018, 36(11): 1100-1109.
[36] 王濤, 藍慧, 田云, 盧向陽. 多環芳烴的微生物降解機制研究進展. 化學與生物工程, 2016, 33(2): 8-14.
WANG T, LAN H, TIAN Y, LU X Y. Research progress on microbial degradation mechanisms for polycyclic aromatic hydrocarbons. Chemistry & Bioengineering, 2016, 33(2): 8-14. (in Chinese)
[37] 姜英華, 胡白石, 劉鳳權. 植物土傳病原菌拮抗細菌的篩選與鑒定. 中國生物防治, 2005, 21(4): 260-264.
JIANG Y H, HU B S, LIU F Q. Selection and identification of antagonistic bacteria against soil-borne plant pathogens. Chinese Journal of Biological Control, 2005, 21(4): 260-264. (in Chinese)
[38] 吳鳳芝, 王學征. 設施黃瓜連作和輪作中土壤微生物群落多樣性的變化及其與產量品質的關系. 中國農業科學, 2007, 40(10): 2274-2280. doi:10.3321/j.issn: 0578-1752.2007.10.021.
WU F Z, WANG X Z. Effect of monocropping and rotation on soil microbial community diversity and cucumber yield, quality under protected cultivation. Scientia Agricultura Sinica, 2007, 40(10): 2274-2280. doi:10.3321/j.issn: 0578-1752.2007.10.021. (in Chinese)
[39] PLIEGO C, RAMOS C, DE VICENTE A, CAZORLA F M. Screening for candidate bacterial biocontrol agents against soilborne fungal plant pathogens. Plant and Soil, 2011, 340(1): 505-520.
[40] ?í?KOVá D, ?R?TKA P, KOLA?íK M, KUBáTOVá A, PA?OUTOVá S. Assessing the pathogenic effect of Fusarium, Geosmithia and Ophiostoma fungi from broad-leaved trees. Folia Microbiologica, 2005, 50(1): 59-62.
[41] CHEN M N, LI X, YANG Q L, CHI X Y, PAN L J, CHEN N, YANG Z, WANG T, WANG M, YU S L. Soil eukaryotic microorganism succession as affected by continuous cropping of peanut: Pathogenic and beneficial fungi were selected. PLoS ONE, 2012, 7(7): e40659.
[42] 徐偉, 葛陽陽, 陳翠婷, 馬婷婷. 基于宏基因組技術分析傳統紅茶菌中菌群組成及其主要代謝通路. 食品工業科技, 2018, 39(5): 119-123, 129.
XU W, GE Y Y, CHEN C T, MA T T. Microorganism composition and main metabolic pathways analysis of traditional Kombucha by metagenomic technology. Science and Technology of Food Industry, 2018, 39(5): 119-123, 129. (in Chinese)
[43] 丁鈺珮, 杜宇佳, 高廣磊, 張英, 曹紅雨, 朱賓賓, 楊思遠, 張儆醒, 邱業, 劉惠林. 呼倫貝爾沙地樟子松人工林土壤細菌群落結構與功能預測. 生態學報, 2021, 41(10): 4131-4139.
DING Y P, DU Y J, GAO G L, ZHANG Y, CAO H Y, ZHU B B, YANG S Y, ZHANG J X, QIU Y, LIU H L. Soil bacterial community structure and functional prediction ofvar. mongolica plantations in the Hulun Buir Sandy Land. Acta Ecologica Sinica, 2021, 41(10): 4131-4139. (in Chinese)
[44] 李曉雪. 辣椒對土壤連作障礙的響應及其成因研究[D]. 保定: 河北農業大學, 2021.
LI X X. The mechanisms of continuous cropping obstacle formation of chilli pepper and the response of chilli pepper to continuously mono-cropped system[D]. Baoding: Hebei Agricultural University, 2021. (in Chinese)
[45] TOJU H, KISHIDA O, KATAYAMA N, TAKAGI K. Networks depicting the fine-scale co-occurrences of fungi in soil horizons. PLoS ONE, 2016, 11(11): e0165987.
[46] KONOPKA A, LINDEMANN S, FREDRICKSON J. Dynamics in microbial communities: Unraveling mechanisms to identify principles. The ISME Journal, 2015, 9(7): 1488-1495.
[47] LAYEGHIFARD M, HWANG D M, GUTTMAN D S. Disentangling interactions in the microbiome: A network perspective. Trends in Microbiology, 2017, 25(3): 217-228.
[48] NUCCIO E E, STARR E, KARAOZ U, BRODIE E L, ZHOU J Z, TRINGE S G, MALMSTROM R R, WOYKE T, BANFIELD J F, FIRESTONE M K, PETT-RIDGE J. Niche differentiation is spatially and temporally regulated in the rhizosphere. The ISME Journal, 2020, 14(4): 999-1014.
[49] YUAN M M, GUO X, WU L W, ZHANG Y, XIAO N J, NING D L, SHI Z, ZHOU X S, WU L Y, YANG Y F, TIEDJE J M, ZHOU J Z. Climate warming enhances microbial network complexity and stability. Nature Climate Change, 2021, 11(4): 343-348.
[50] HERREN C M, MCMAHON K D. Keystone taxa predict compositional change in microbial communities. Environmental Microbiology, 2018, 20(6): 2207-2217.
[51] CHEN L J, JIANG Y J, LIANG C, LUO Y, XU Q S, HAN C, ZHAO Q G, SUN B. Competitive interaction with keystone taxa induced negative priming under biochar amendments. Microbiome, 2019, 7(1): 77.
[52] SUN X L, XU Z H, XIE J Y, HESSELBERG-THOMSEN V, TAN T M, ZHENG D Y, STRUBE M L, DRAGO? A, SHEN Q R, ZHANG R F, KOVáCS á T.stimulates resident rhizospherefor plant health through metabolic interactions. The ISME Journal, 2022, 16(3): 774-787.
[53] WHITE D C, SUTTON S D, RINGELBERG D B. The genus Sphingomonas: Physiology and ecology. Current Opinion in Biotechnology, 1996, 7(3): 301-306.
[54] 閻潔, 余雪巍, 李鑒博, 顧海萍, 郭二輝. 一株菲降解細菌產生生物表面活性劑特性的研究. 生態環境學報, 2021, 30(8): 1683-1694.
YAN J, YU X W, LI J B, GU H P, GUO E H. Research on the characterization of surfactant produced by a phenanthrene-degrading strain. Ecology and Environmental Sciences, 2021, 30(8): 1683-1694. (in Chinese)
[55] ZHOU X Y, LIANG Y, REN G F, ZHENG K W, WU Y, ZENG X Y, ZHONG Y, YU Z Q, PENG P A. Biotransformation of tris(2- chloroethyl) phosphate (TCEP) in sediment microcosms and the adaptation of microbial communities to TCEP. Environmental Science & Technology, 2020, 54(9): 5489-5497.
[56] SCHMITZ L, YAN Z C, SCHNEIJDERBERG M, DE ROIJ M, PIJNENBURG R, ZHENG Q, FRANKEN C, DECHESNE A, TRINDADE L M, VAN VELZEN R, BISSELING T, GEURTS R, CHENG X. Synthetic bacterial community derived from a desert rhizosphere confers salt stress resilience to tomato in the presence of a soil microbiome. The ISME Journal, 2022, 16(8): 1907-1920.
[57] XU J, ZHANG Y Z, ZHANG P F, TRIVEDI P, RIERA N, WANG Y Y, LIU X, FAN G Y, TANG J L, COLETTA-FILHO H D, CUBERO J, DENG X L, ANCONA V, LU Z J, ZHONG B L, ROPER M C, CAPOTE N, CATARA V, PIETERSEN G, VERNIèRE C, AL-SADI A M, LI L, YANG F, XU X, WANG J, YANG H M, JIN T, WANG N. The structure and function of the global citrus rhizosphere microbiome. Nature Communications, 2018, 9: 4894.
[58] ISABWE A, YAO H F, ZHANG S X, JIANG Y J, BREED M F, SUN X. Spatial assortment of soil organisms supports the size-plasticity hypothesis. ISME Communications, 2022, 2: 102.
[59] WU W X, LU H P, SASTRI A, YEH Y C, GONG G C, CHOU W C, HSIEH C H. Contrasting the relative importance of species sorting and dispersal limitation in shaping marine bacterial versus protist communities. The ISME Journal, 2018, 12(2): 485-494.
[60] DELGADO-BAQUERIZO M, MAESTRE F T, REICH P B, JEFFRIES T C, GAITAN J J, ENCINAR D, BERDUGO M, CAMPBELL C D, SINGH B K. Microbial diversity drives multifunctionality in terrestrial ecosystems. Nature Communications, 2016, 7: 10541.
Characteristics and Succession of Rhizosphere Soil Microbial Communities in Continuous Cropping Watermelon
GUO HanYue1, WANG DongSheng2, RUAN Yang1, QIAO YiZhu1, ZHANG YunTao1, LI Ling1, HUANG QiWei1, GUO ShiWei1, LING Ning1, SHEN QiRong1
1College of Resources and Environment Science, Nanjing Agricultural University/Key Laboratory of Organic-based Fertilizers of China/Jiangsu Provincial Key Laboratory for Solid Organic Waste Utilization, Nanjing 210095;2Nanjing Institute of Vegetable Science, Nanjing 210042
【Objective】The aim of this study was to investigate the effects of continuous cropping on the construction and potential functions of bacterial and fungal communities in the rhizosphere soil of watermelon, and to clarify the adaptability of rhizosphere microorganisms to environmental changes, so as to provide a theoretical basis for ecological control of watermelon continuous cropping obstacles and healthy maintenance of farmland. 【Method】In this study, the rhizosphere soil of watermelon without continuous cropping (CK), continuous cropping for 2 times and continuous cropping for 6 times was used as the research object. 16S rRNA and ITS high-throughput sequencing were used to analyze the effects of continuous cropping on the bacterial and fungal communities of rhizosphere soil of watermelon. 【Result】With the increasing continuous cropping times, the bacterial diversity index in the rhizosphere soil of watermelon showed a trend of first decreasing and then increasing, while the fungal diversity index decreased significantly. At the bacterial genus level, multiple times of continuous cropping decreased the relative abundance ofandin watermelon rhizosphere soil; at the fungal genus level, the relative abundance ofincreased with the continuous cropping times. Compared with CK, the network complexity of continuous cropping was higher, but the stability of network structure was lower. In addition, compared with CK, the relative abundance of biodegradation pathways of harmful substances and metabolic pathways of amino acids could be significantly reduced after continuous cropping for 6 times; the relative abundance of pathogenic fungi significantly increased in the fungal community after continuous cropping for 6 times. During community succession, the stochastic processes dominated rhizosphere bacterial community construction in watermelon under continuous cropping, while the deterministic processes dominated rhizosphere fungal community construction in watermelon. 【Conclusion】Continuous cropping caused changes in community characteristics, functional composition and succession process of rhizosphere bacteria and fungi. The decrease of key functions of bacterial community, the increase of pathologic fungi and the decrease of stability of microbial community network might be the important factors leading to occurrence of watermelon continuous cropping obstacles.
watermelon; continuous cropping soil; rhizosphere microbial community; function prediction; community succession
2022-11-19;
2023-01-09
國家自然科學基金(31972506)
郭晗玥,E-mail:2020103110@stu.njau.edu.cn。通信作者凌寧,E-mail:nling@njau.edu.cn
(責任編輯 李云霞)

