腫瘤浸潤淋巴細胞數量、微衛星不穩定性與大腸癌分期的相關性及對預后的評估價值分析
張翼臻 裴大兵
大腸癌是結直腸癌的統稱,臨床較常見,發病年齡趨于老年化,且男性患者多發。大腸癌患者早期一般無明顯癥狀,一般只有消化不良、大便潛血等輕微癥狀,但是隨著病情發展,患者會出現腸梗阻、發熱消瘦等較為明顯的全身癥狀[1],所以,尋找判斷大腸癌分期和預后的指標,盡早制定治療方案對預后有積極意義。TILs 與癌細胞的生長、浸潤和轉移密切相關,是腫瘤環境參數,可反映大腸癌侵襲能力和預后[2]。MSI是指腫瘤中DNA 發生錯配修復而導致的缺陷[3],是腫瘤免疫治療的重要生物標志物之一,其檢測近年來備受關注。故本研究主要對TILs 數量、MSI 與大腸癌分期及預后的相關性進行分析,旨在為臨床治療提供指導作用。
1 資料與方法
1.1 一般資料選取2018 年1 月~2020 年1 月本院收治的98 例大腸癌患者,納入標準:①符合大腸癌診斷標準[4];②臨床資料完整,患者或家屬知情同意。排除標準:①處于妊娠/哺乳期者;②合并其他腫瘤者[5];③有精神疾病者;④近1 個月內接受過放化療者。98 例大腸癌患者年齡26~78 歲,平均年齡(57.83±11.23)歲;男52 例,女46 例;其中原發腫瘤位于結腸45 例,位于直腸53 例;大腸癌分期:Ⅰ期20 例,Ⅱ期38 例,Ⅲ期21 例,Ⅳ期19 例。根據腫瘤分期將Ⅰ期和Ⅱ期設為早期組(58 例),Ⅲ期和Ⅳ期設為晚期組(40 例)。早期組患者年齡27~75 歲,平均年齡(57.45±11.24)歲;男31 例,女27 例。晚期組患者年齡26~78 歲,平均年齡(58.29±11.37)歲;男21 例,女19 例。早期組和晚期組一般資料比較差異無統計學意義(P>0.05),具有可比性。將患者根據生存情況分為存活組(82 例)和死亡組(16 例)。
1.2 檢測方法 TILs 檢測:采用免疫組織化學法檢測,將患者腫瘤標本使用甲醛溶液固定,用常規石蠟包埋,將標本連續切片(3 μm)后制片,進行檢測。主要流程為二甲苯溶液脫蠟、水化后水洗,進行抗原修復后孵育沖洗。滴加稀釋的免疫組化染色液,觀察出現終止反應后沖洗、復染,通過鹽酸酒精分化,水洗、沖洗、漂洗后以中性樹膠封片。CD4+和CD8+為細胞膜著色,通過顯微鏡選擇5 個具有代表性區域在×400 視野下計算CD4+和 CD8+T 淋巴細胞數量,求平均值。微衛星狀態:采用聚合酶鏈式反應檢測MSI,通過比較腫瘤細胞和正常細胞中核苷酸重復序列的長度來檢測,通過聚合酶鏈式反應擴增選擇性微衛星以及在自動測序儀上通過毛細管電泳分析片段大小來識別,分為MSI 高(MSI-H,≥30%標記物不穩定)、MSI 低(MSI-L,<30%標記物不穩定)和微衛星穩定(MSS,無標記物不穩定)3 種類型。
1.3 治療方法 兩組患者均進行化療,根據相關診療指南[6]制定患者的化療方案,包括卡培他濱片(江蘇恒瑞醫藥股份有限公司,國藥準字H20133365)1250 mg/m2,分早晚兩次飯后30 min 口服,患者服藥2 周后停藥1 周;奧沙利鉑(深圳海王藥業有限公司,國藥準字H20031048)按照患者體表面積130 mg/m2給藥,加入5%葡萄糖溶液250~500 ml 中靜脈滴注2~6 h,每3 周給藥1 次。同時給予常規護理干預,嚴密監測患者生命體征,并給予抗生素以防感染。
1.4 觀察指標 比較早期組和晚期組TILs 數量和微衛星狀態(表達陰性數量),分析TILs 數量和微衛星狀態與大腸癌分期的相關性。對患者進行隨訪,自患者入組之日開始隨訪,隨訪截止時間為2023 年1 月,比較存活組和死亡組TILs 數量和微衛星狀態(表達陰性數量),分析TILs 數量和微衛星狀態對大腸癌預后的評估價值。
1.5 統計學方法 采用SPSS22.0 統計學軟件進行數據統計分析。計量資料以均數±標準差 ()表示,采用t檢驗;計數資料以率(%)表示,采用χ2檢驗;TILs 數量和微衛星狀態與大腸癌分期的相關性采用Pearson 相關分析,TILs 數量和微衛星狀態在大腸癌患者預后評估中的價值采用ROC 曲線評估。P<0.05 表示差異具有統計學意義。
2 結果
2.1 早期組和晚期組患者TILs 數量和微衛星狀態比較 早期組患者CD4+和CD8+T 淋巴細胞數量及微衛星表達陰性數量均高于晚期組,差異有統計學意義(P<0.05)。見表1。
表1 早期組和晚期組大腸癌TILs 數量和微衛星狀態比較()

表1 早期組和晚期組大腸癌TILs 數量和微衛星狀態比較()
注:與晚期組比較,aP<0.05
2.2 TILs 數量和微衛星狀態與大腸癌分期的相關性分析 Pearson 相關性分析顯示:大腸癌分期與CD4+和CD8+T 淋巴細胞數量及微衛星表達陰性數量呈負相關(r=-0.451、-0.447,-0.487,P<0.05)。
2.3 存活組和死亡組患者TILs 數量和微衛星狀態比較 存活組患者CD4+和CD8+T 淋巴細胞數量及微衛星表達陰性數量均高于死亡組,差異有統計學意義(P<0.05)。見表2。
表2 存活組和死亡組患者TILs 數量和微衛星狀態比較()
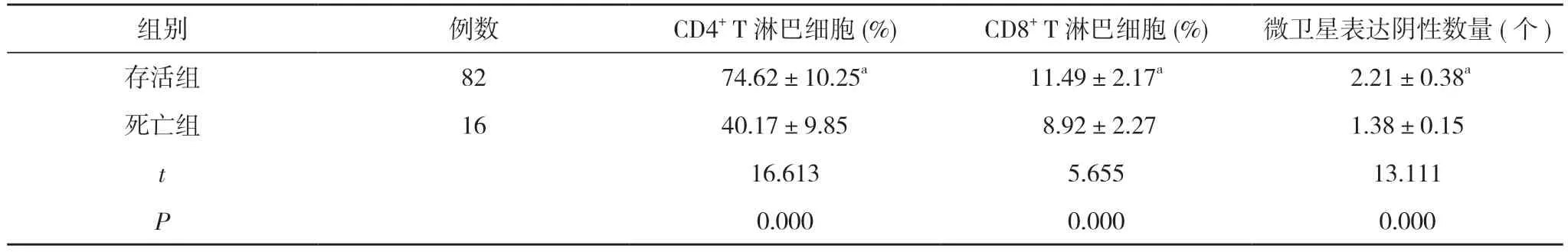
表2 存活組和死亡組患者TILs 數量和微衛星狀態比較()
注:與死亡組比較,aP<0.05
2.4 TILs 數量和微衛星狀態與大腸癌預后的ROC 分析 ROC 結果顯示,CD4+和CD8+T 淋巴細胞數量和微衛星表達陰性數量診斷大腸癌預后的AUC 分別為0.765、0.741 和0.730,此時各水平的截斷值分別為60.240%、9.157%和1.940 個(P<0.05)。見圖1,表3。
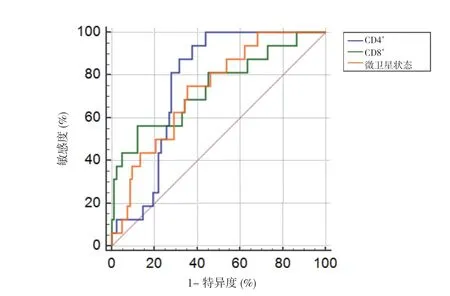
圖1 TILs 數量和微衛星狀態與大腸癌患者預后的ROC 曲線圖
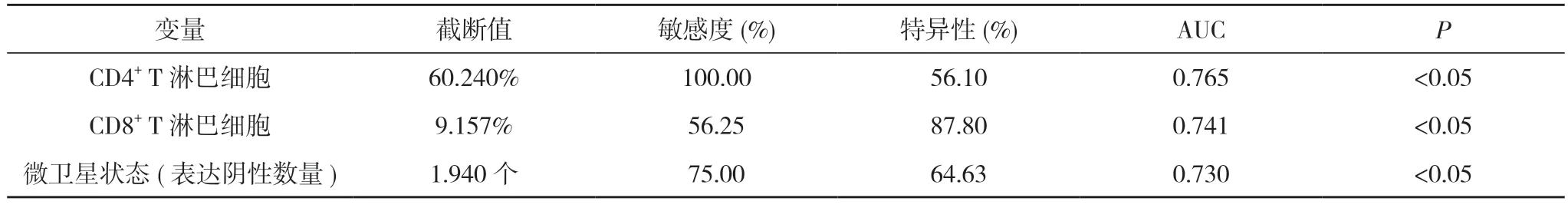
表3 TILs 數量和微衛星狀態對大腸癌患者預后的ROC 曲線分析
3 討論
流行病學研究顯示,2020 年全球新發近200 萬大腸癌患者,發病率居于惡性腫瘤第3 位,另外生存率較低,5 年內死亡率高達50%,占第2 位[7],目前臨床主要執行以手術切除為主的綜合治療方案,但是制定手術綜合治療方案前需要明確患者的具體情況,對其治療效果和預后具有重要意義。TILs 是腫瘤特異性免疫反應的一種產物[8],微衛星狀態檢測已成為大腸癌患者診療的常規檢查項目[9]。有研究顯示,MSI 臨床檢測對患者病情篩查、治療方案的制定有重要意義[10]。近年來,人們逐漸重視在控制腫瘤進展中宿主免疫系統的重要性,并將新的免疫生物標記物作為其治療效果和預后的預測工具。本次研究結果顯示,Pearson 相關性分析顯示:大腸癌分期與CD4+和CD8+T 淋巴細胞數量及微衛星表達陰性數量呈負相關(r=-0.451、-0.447,-0.487,P<0.05)。由此提示與MSS 相比,MSI-H的大腸癌患者具有更好的預后,其預后的改善可能與宿主抗腫瘤免疫反應更明顯相關。事實上,淋巴細胞浸潤在MSI 大腸癌患者中也很突出,這是由于錯配修復蛋白系統的缺失以及隨之產生的幀移突變的積累導致氨基酸序列改變的多肽(新抗原)的轉錄和翻譯,新抗原由人類白細胞抗原Ⅰ(HLAⅠ)類呈現并被細胞毒性T 細胞識別[11]。病情發展不良的大腸癌患者一般免疫功能較差,CD8+T 細胞浸潤多發生在癌癥早期,隨著病程的進展會不斷變少,說明這些細胞可以限制腫瘤細胞浸潤生長[12,13]。
本次研究結果顯示,早期組患者CD4+和CD8+T 淋巴細胞數量及微衛星表達陰性數量均高于晚期組,差異有統計學意義(P<0.05)。存活組患者CD4+和CD8+T 淋巴細胞數量及微衛星表達陰性數量均高于死亡組,差異有統計學意義(P<0.05)。由此說明微衛星不穩定患者的預后情況明顯優于微衛星穩定患者,且患者的病情會隨著微衛星高頻數量的減少而加重。相關研究顯示[14,15],MSI 是篩查大腸癌的重要工具,是患者化療和免疫治療效果和預后結局的重要標志物,其中MSI-H 腫瘤多發生于右半結腸,具有密集的免疫浸潤,與腫瘤發生具有密切的相關性。MSI-H 患者淋巴結遠處轉移幾率均較低,微衛星不穩定患者的預后較好,淋巴結轉移和遠處轉移較少。
綜上所述,大腸癌患者的TILs 數量和MSI 會隨著患者的病情加重而減少,且這兩種指標對大腸癌患者的預后有一定的評估效能,可以為臨床治療提供指導作用。

