Beckwith-Wiedemann綜合征產前診斷的臨床進展
安祥友 綜述 袁 靜,楊媛媛 審校
Beckwith-Wiedemann綜合征(Beckwith-Wiede mann syndrome,BWS)是一種過度生長和胚胎性腫瘤易感的印記障礙性疾病,與染色體11p15.5區域的遺傳或表觀遺傳異常導致的親本等位基因表達異常有關。據報道[1-2],BWS發病率約為1/10 000~1/13 700,通過輔助生殖技術(assisted reproductive techniques, ART)妊娠的胎兒患BWS的風險比自然受孕胎兒增加10倍[3]。BWS具有臨床異質性,主要表現為巨舌、腹壁缺陷、偏側增生、內臟腫大、耳朵特殊折痕、新生兒低血糖、胚胎性腫瘤易感等。BWS具有遺傳多樣性,11p15.5區域包括受印記中心1(imprinting center 1, IC1)調控的H19和IGF2及IC2調控的KCNQ1、KCNQ1OT1、CDKN1C。約80%的BWS患兒在11p15.5區域內有分子缺陷[4],其中IC2區域的甲基化缺失(loss of methylation, LOM)約見于50%的患者,IC1區域的過度甲基化(gain of methylation, GOM)約見于5%~10%的患者,父源性單親二倍體(paternal uniparental isodisomy, pUPD)約見于20%的患者,CDKN1C突變約見于5%的散發性BWS和40%的家族遺傳性病例,另有少部分患者為染色體結構異常[5]。BWS患者中約85%為散發性病例,15%為家族遺傳性病例。
BWS常通過患者的臨床表型進行診斷,BWS國際共識小組建立了臨床評分體系[1],見表1。由于巨舌、偏側增生、新生兒低血糖、胚胎性腫瘤等典型表型多于妊娠中、晚期及產后出現,大多數病例于新生兒期或兒童期被診斷。因此,產前早期診斷BWS并進行遺傳咨詢對圍產期及產后臨床處理具有重要意義。
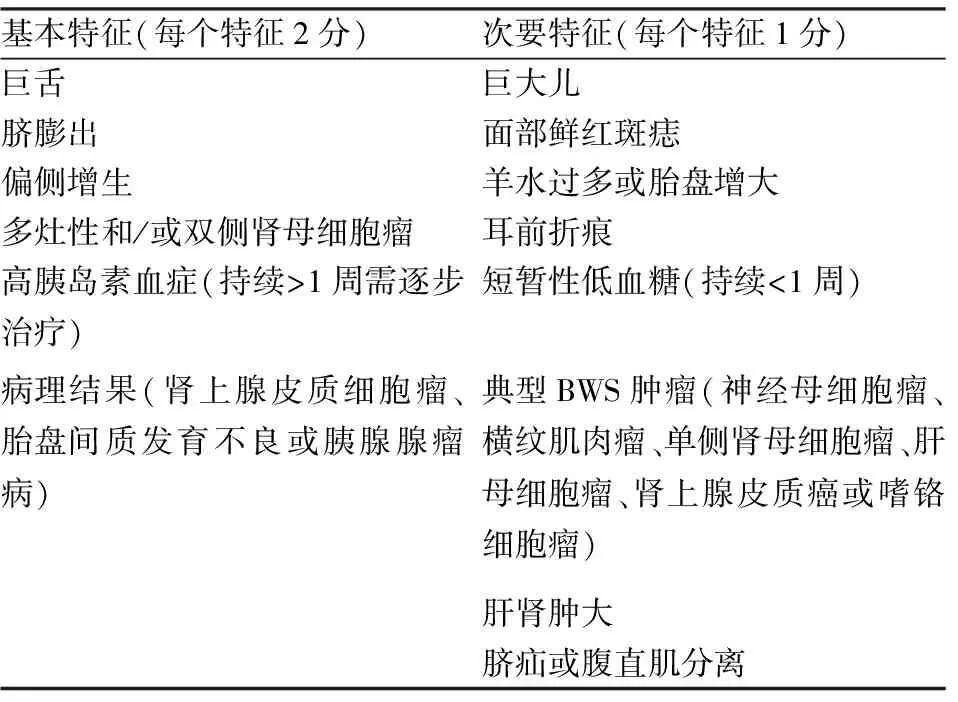
表1 BWS的臨床表型
1 BWS的產前診斷
1.1 一般生化檢查妊娠早、中期的血清學標志物聯合篩查:甲胎蛋白(alpha-fetoprotein, AFP)、β-人絨毛膜促性腺激素(beta human chorionic gonadotropin, β-hCG)、游離雌三醇(unconjugated estriol, μE3)和抑制素A (inhibin A)四聯篩查常用于唐氏綜合征、18-三體、神經管缺陷的篩查。這4種血清學標志物水平升高也可能與BWS有關[6-7],在沒有其他明顯異常的情況下可能有助于BWS的早期發現,基于這4種血清學標志物的異常升高和胎兒臍膨出,可早在妊娠14周發現BWS[6]。但是血清學篩查對BWS的特異性并不高,這也為BWS的產前早期診斷增加了難度。
1.2 產前超聲檢查大多數BWS病例是在出生后依據患者的臨床表型被診斷出來的,但產前胎兒影像學檢查可以發現某些提示BWS的特征:包括腹壁缺陷(臍疝、臍膨出)、羊水過多、巨大兒、巨舌,其他可見的特征還包括胎盤間質發育不良或胎盤腫大、胼胝體發育不全、腹內臟器腫大、心臟橫紋肌瘤、腎上腺腫大/腎上腺皮質癌等[8-9]。目前臨床上根據妊娠中期超聲檢查,可以依據兩個主要特征(巨舌、巨大兒、腹壁缺陷)或一個主要特征加兩個次要特征(羊水過多、腎腫大/腎發育不全、腎上腺腫塊/腎上腺巨細胞瘤、胎盤間質發育不良)來判斷是否需要進行進一步產前診斷BWS。
Shieh et al[10]關于對BWS孕期影像學檢查的一項研究表明,腹壁缺陷是最常見且最早發現的異常表現,發現腹壁缺陷的時間明顯早于巨大兒和巨舌,中位胎齡為妊娠18周,并且出生后100%得到證實,其余體征多在妊娠晚期時發現,因此,可對早期提示腹壁缺陷的胎兒進行連續超聲監測,以便及時發現妊娠期間可能出現的其他BWS體征。有10%~20%的孤立性臍膨出的胎兒會被診斷為BWS,如果合并其他表型,診斷率可能會增加[10-11]。BWS是巨舌最常見原因之一,高達50%的巨舌胎兒會被診斷為BWS[12],但巨舌往往很難在胎兒期被超聲發現。胎盤間質發育不良的胎兒約20%被診斷為BWS[13]。相比最常見的腹壁缺陷,巨舌和胎盤間質發育不良在產前診斷BWS上具有更高的特異性[14]。由于BWS胎兒表型譜廣且特異性不高,通過超聲診斷BWS并不容易。
1.3 產前基因檢測產前基因診斷用于既往有BWS病史或存在BWS相關體征的家族史或本次妊娠超聲檢查疑似BWS的情況下。根據BWS的遺傳學機制,甲基化特異性多重連接依賴式探針擴增(methylation-specific multiplex ligation-dependent probe amplification, MS-MLPA)可檢測印記中心DNA的甲基化水平,染色體核型分析可檢測染色體重復、易位、倒位,熒光原位雜交(fluorescence in situ hybridization, FISH)可檢測染色體的微缺失和易位[15],單核苷酸多態性微陣列(single nucleotide polymorphism, SNP array)、短串聯重復序列(short tandem repeat, STR)可檢測pUPD及嵌合體[16-17],染色體微陣列分析(chromosome microarray analysis, CMA)可檢測拷貝數變異(copy number variation, CNV)重復或缺失的程度及性質,Sanger測序對CDKN1C基因進行突變分析等。印記中心DNA甲基化異常是BWS最常見的致病機制,因MS-MLPA可同時對IC1/IC2進行甲基化評估和CNV檢測,被推薦作為BWS的一線檢測方法[1],該方法可確診產前診斷中的大多數臨床病例。由于MS-MLPA對嵌合體、染色體平衡易位及印記中心基因變異等均無法檢出,MS-MLPA檢測結果陰性并不能排除BWS的診斷。甲基化評估和CNV陰性的患者應通過Sanger測序進行CDKN1C突變分析。由于嵌合體的存在,各種檢測方法均可能出現假陰性結果。Baker et al[14]的一項研究認為低水平嵌合體的甲基化在產前BWS診斷中并不常見,由于產前診斷的組織樣本來源受限,導致無法對其他組織樣本進行基因檢測予以確認。因此,BWS產前基因診斷檢測結果陰性仍不能排除BWS的診斷,產后應進一步結合臨床分析[18]。
1.4 鑒別診斷BWS是一種過度生長綜合征,與Simpson-Golabi-Behmel綜合征[19](Simpson-Golabi-Behmel syndrome, SGBS)、Costello綜合征[20]、Perlman綜合征[21]和Sotos綜合征[22]在臨床表型上有顯著重疊,臨床上應予以鑒別。現將常見的產前表型歸納如下,見表2。

表2 BWS與SGBS、Perlman綜合征和Sotos綜合征的產前超聲表現
1.4.1SGBS SGBS是一種罕見的X連鎖過度生長綜合征,呈X連鎖隱性遺傳,臨床上分為兩種類型:SGBSⅠ型和SGBSⅡ型。以SGBSⅠ型更常見,與位于Xp26上的GPC3基因突變有關。SGBSⅠ型的產前超聲表現為巨大兒、羊水過多、器官腫大、腎臟畸形、先天性膈疝和心臟畸形,臍膨出少見[21]。在產前篩查中可能發現母體血清AFP升高和胎兒頸項透明層增厚,但缺乏特異性[23]。SGBSⅡ型常表現為胎兒水腫和多發畸形,由位于Xp22上的PIGA基因突變引起,需要通過基因檢測來區分這兩種類型。產前超聲檢查發現胎兒過度生長、羊水過多及伴有其他系統或器官畸形,應考慮SGBS的鑒別,并應進行進一步的基因檢測,如CNV和全外顯子組測序(whole exome sequencing, WES),檢查母親是否具有輕度SGBS表型并進行基因驗證,有助于SGBS的診斷及提供遺傳咨詢。
1.4.2Costello綜合征 Costello綜合征由HRAS基因中的新發雜合突變引起的一種罕見疾病,呈常染色體顯性遺傳。產前超聲表現為胎兒頸項透明層增厚、羊水過多、巨大兒、巨頭畸形、手腕尺側偏斜、長骨縮短及胎兒心動過速等[20]。胎兒心律失常少見,對治療反應較好。Costello綜合征胎兒常表現為巨頭和體質量增加,而長度參數在正常范圍內,這可能與胎兒皮下水腫有關[24]。產前超聲檢查顯示胎兒頸項透明層增厚、巨大兒和一些特征性異常如疊指、長骨縮短、心肌病等應考慮Costello綜合征。通過WES或全基因組測序(whole genome sequencing, WGS)可識別出多數導致Costello綜合征的突變。
1.4.3Perlman綜合征 Perlman綜合征是一種罕見的常染色體隱性遺傳的先天性過度生長綜合征,由染色體2q37區域的DIS3L2基因的致病變異引起。產前超聲表現常見的有羊水過多、巨大兒、內臟腫大、腎腫大和胎兒腹水[21]。80%~100%的患兒可見腎臟腫大,因此,Perlman綜合征的產前診斷可基于腎臟腫大[25]。因DIS3L2也可導致IGF2的過度表達,與組織過度生長和腎母細胞瘤發展密切相關[26],基因檢測對Perlman綜合征與BWS的鑒別診斷至關重要。
1.4.4Sotos綜合征 Sotos綜合征是由位于染色體5q35上的NSD1基因單倍體劑量不足導致的過度生長伴智力障礙綜合征,呈常染色體顯性遺傳,95%的患者為NSD1基因新發變異的散發病例,5%為家族性遺傳病例。Sotos綜合征產前超聲表現可有輕度腦室擴大、頭圍或身長增大、胎兒頸項透明層增厚、羊水過多等[22],妊娠晚期可能發現胎兒腦或顱骨的異常,伴或不伴過度生長。妊娠期產前檢查顯示胎兒過度生長、巨頭畸形和羊水過多伴有其他異常,如腎臟異常、中樞神經系統異常、NT升高,應考慮鑒別Sotos綜合征。產前超聲檢查表現不具有特異性,胎兒MRI檢查和追訪父母的Sotos綜合征表型證據及對其他表型陽性家系成員的遺傳學檢查可協助診斷該病。
2 遺傳咨詢
2.1 復發風險評估BWS復發的風險取決于遺傳學分子亞型及其親本來源[1]。對于有陽性家族史者,即使先證者遺傳學檢查未發現異常,復發風險仍然較高。BWS患者中約15%是家族遺傳性病例,呈常染色體顯性遺傳,常見的有CDKN1C突變、染色體11p15.5異常。如果變異是母源性的,子代復發風險為50%[27]。原則上,所有染色體11p15 CNVs和平衡易位都有50%的復發風險。
2.2 對妊娠的影響在BWS妊娠中,孕婦發生妊娠期糖尿病、妊娠期高血壓、陰道流血的風險增加,先兆子癇發病往往更早更嚴重,嚴重者甚至進展為HELLP綜合征[7]。BWS胎兒早產發生率升高,巨大兒經陰道分娩可能會發生難產、新生兒窒息、臂叢神經損傷甚至新生兒死亡,在分娩方式的選擇上更傾向于剖宮產[28-29]。
2.3 ART與BWSART是指在體外對配子和胚胎進行一系列技術處理使不孕夫婦受孕的方法,包括體外受精-胚胎移植(invitrofertilization and embryo transfer, IVF-ET )、卵胞質內單精子注射(intracytoplasmic sperm injection, ICSI )和種植前遺傳學檢測(preimplantation genetic test, PGT)等。ART妊娠胎兒發生BWS的風險增加10倍,通過ART妊娠的BWS患兒90%以上可檢測出IC2的LOM[3]。印記基因DNA甲基化對環境極其敏感,因此,ART操作中任何步驟都有可能干擾印記位點DNA甲基化的形成從而對后代產生影響。迄今為止,有許多觀察結果表明ART與BWS之間存在關聯。Lazaraviciute et al[30]的Meta分析結果顯示,經ART受孕的兒童和自然受孕的兒童相比,發生印記障礙的風險增加。因大多數患者表觀基因型為IC1/IC2甲基化改變[3],Duffy et al[31]提議將ART納入BWS的診斷評分體系中,并指出了胚胎植入前階段對印記建立或維持的關鍵作用。目前,尚不清楚ART妊娠中BWS的高發是由于ART相關操作步驟或是不孕癥本身引起,還需要更多研究來進一步闡明ART、不孕癥與BWS之間的聯系[1]。通過ART妊娠的胎兒,產前檢查顯示羊水過多、巨舌、胎盤間質發育不良、腹壁缺陷等臨床表型時,應格外注意BWS的診斷。
2.4 圍產期及產后管理產前診斷確認胎兒為患胎時,應當充分告知孕婦及家屬,并由孕婦及家屬決定是否治療性流產或引產。對于產前診斷確診或懷疑為BWS的新生兒,應在產后幾天監測血糖水平,預防并及時治療新生兒低血糖;巨舌和腹壁缺陷可通過外科手術予以矯正;心臟病變予超聲心動圖監測,輕者常可自愈,重者需手術矯正;超聲監測BWS相關胚胎性腫瘤至7歲,腎母細胞瘤首選超聲監測,肝母細胞瘤常采用超聲聯合血清AFP水平篩查,但對AFP的早期篩查價值存在爭議[1]。
3 總結與展望
BWS作為一個兒科疾病,具有較大的臨床異質性和遺傳異質性,其診斷主要根據產后新生兒的表型結合基因檢測,產前診斷不易。隨著超聲檢測儀器及技術、介入性產前診斷技術、遺傳學檢測技術的快速發展,提升了產前診斷BWS的可行性和準確性。產科醫師尤其是產前診斷醫師,應該格外注意。血清學篩查陽性結果對BWS具有提示性作用。產前超聲顯示羊水過多、巨大兒、巨舌、腹部缺陷及腹內臟器腫大等特征常是考慮BWS的有效線索。絨毛膜穿刺及羊膜腔穿刺可直接獲取胎盤組織或胎兒細胞樣本進行基因檢測,產前基因檢測在BWS的明確診斷、產前咨詢和判斷預后等方面發揮著重要作用,但存在假陰性的風險。如果有陽性的分子檢測結果,即使臨床表型很少,也可以明確診斷,有陽性家族史者對產前診斷更有利。產前早期診斷BWS有利于優生優育,亦為圍產期管理、產后管理、腫瘤早期篩查及長期監測提供支持。

