慢性阻塞性肺疾病急性加重期合并肺動脈高壓的高危因素分析
涂友慧 胡先緯 尤青海
肺動脈高壓是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)進展過程中的重要病理生理特征,其形成機制與肺血管床減少、慢性缺氧及慢性氣道炎癥所致肺動脈收縮和血管重塑有關[1-2]。研究顯示肺動脈高壓在COPD患者中的發生率主要取決于疾病的嚴重程度,多數患者表現為中度增高,約1%~4%患者有嚴重肺動脈壓力增高[3-5]。雖然COPD患者肺動脈壓力增高趨勢較慢[6],但肺動脈壓力是影響COPD患者死亡率的重要負性調控因素。既往研究表明平均肺動脈壓力大于25 mmHg的COPD患者5年生存率僅36%[7-9]。早期識別及診治肺動脈高壓對改善COPD患者疾病預后具有重要意義。本研究通過回顧性分析合并肺動脈高壓的AECOPD患者的相關臨床特征,探索AECOPD合并肺動脈高壓的高危臨床因素。
資料與方法
一、納入和排除標準
回顧性連續納入安徽醫科大學第一附屬醫院2019年6月至2022年5月于呼吸與危重癥醫學科住院的AECOPD患者。研究方案經安徽醫科大學第一附屬醫院倫理委員會批準(PJ2023-05-41)。入選標準:年齡大于等于18歲。既往診斷慢阻肺明確(慢阻肺診斷標準及慢阻肺急性加重標準均符合2018年慢阻肺全球防治倡議)。臨床資料完整。排除標準:合并支氣管擴張、間質性肺疾病等其他慢性肺部疾病。合并肺動脈栓塞相關的肺動脈高壓。既往診斷由其他疾病(肺血管畸形、先天性心臟病、風濕性心臟病等)所致的肺動脈高壓。長期服用可導致肺動脈壓力增高或降低的藥物。
二、信息收集
通過使用東華電子病歷系統收集AECOPD患者的臨床基本信息及相關檢驗檢查數據,基本信息包括性別、年齡、身高、體重、吸煙指數、動脈血氣分析、血常規、肝腎功能、心肌酶譜、凝血指標、C-反應蛋白、腦鈉肽、超聲心動圖、肺功能參數、胸部CT等。參考2015年歐洲心臟協會/歐洲呼吸協會的肺動脈高壓診斷和治療標準。超聲心動圖檢測三尖瓣返流估測的右心室壓力(right ventricular systolic pressure,RVSP)大于等于40 mmHg考慮合并肺動脈高壓[10]。符合入院標準的AECOPD患者,根據其是否合并肺動脈高壓,分為AECOPD合并肺動脈高壓組和AECOPD不伴有肺動脈高壓組。
三、統計分析
采用SPSS 26.0軟件處理兩組間的相關臨床數據,非正態分布資料采用中位數描述,組間比較采用Mann-WhitneyU檢驗;分類資料比較采用卡方檢驗。單因素有意義的進一步采用多元Logistic回歸進一步分析比較。采用Spearman比較有意義的臨床高危因素與右心室壓力的相關性分析。以P值<0.05為差異有統計學意義。
結 果
一、一般資料比較
389例AECOPD患者參與評選,根據入選標準及排除標準,其中臨床數據(缺乏肺功能/心臟彩超/心肌酶譜/血氣分析等數據)不完整者228例,合并支氣管擴張者32例,合并間質性肺疾病者26例,服用安立生坦者(降低肺動脈壓力)3例,最終納入研究病例100例,其中男性91例,女性9例,100例入選患者中位年齡71.49歲。依據超聲心動圖RVSP超過40 mmHg考慮為合并肺動脈高壓并進行分組,其中AECOPD合并肺動脈高壓組54例,AECOPD不伴有肺動脈高壓組(AECOPD組)46例。利用PASS 15軟件計算,輸入兩組實際樣本量(54vs46),考慮本研究擬觀測的眾多變量組間差異,根據各指標變化值的實際臨床意義,設置效應大小(difference in means)為0.6 to 2 by 0.1,要達到0.05的檢驗水準,統計效能均可達0.84以上,基本滿足本研究樣本量需求。兩組患者間一般臨床資料(見表1)。
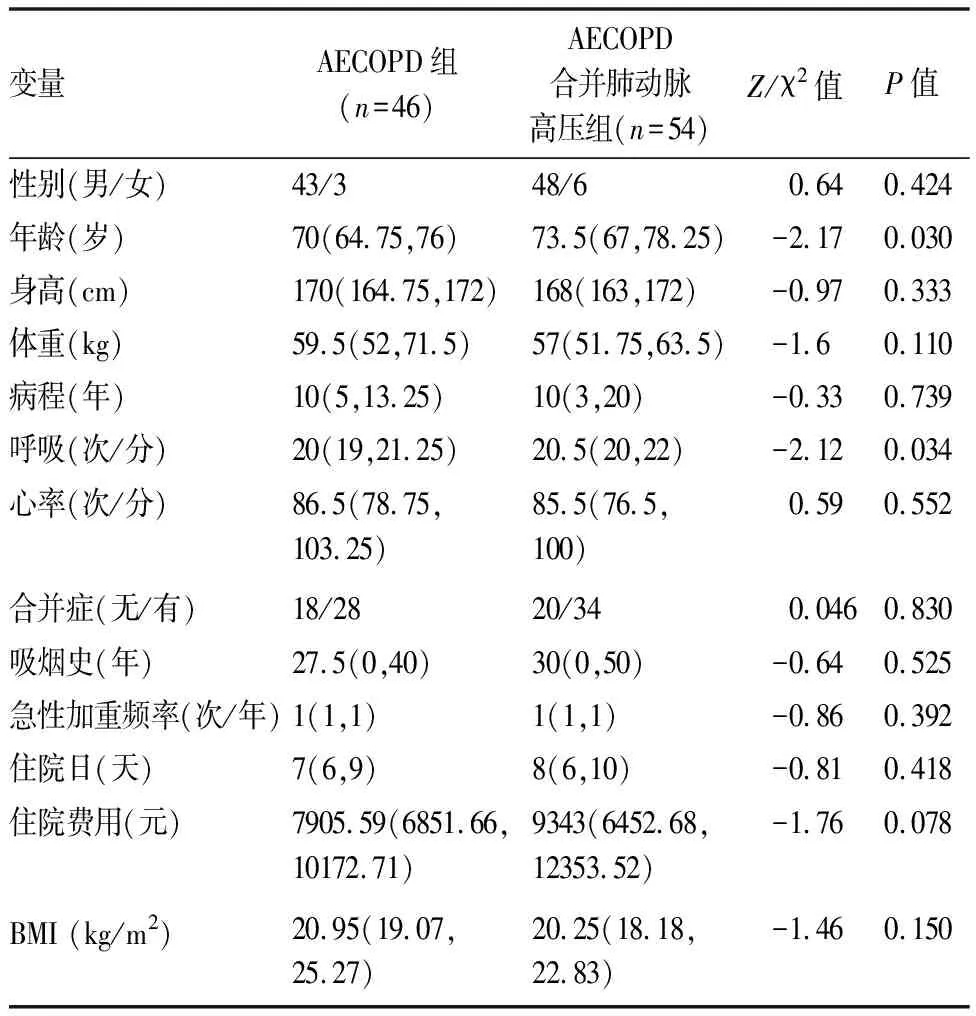
表1 兩組間臨床基本特征的組間比較[M(P25,P75)]
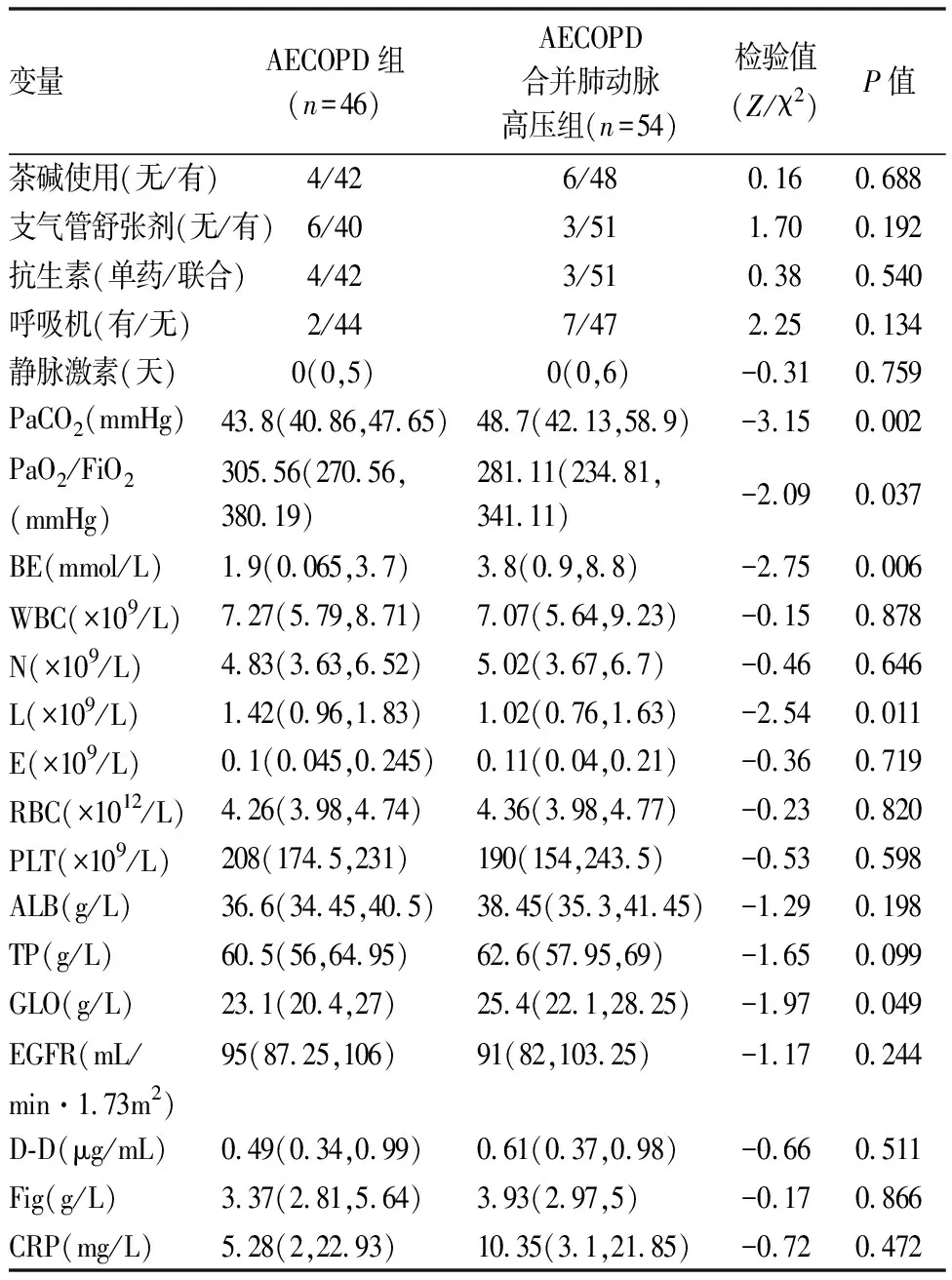
表2 兩組間治療藥物、血實驗室數據比較[M(P25,P75)]
二、臨床資料比較
AECOPD合并肺動脈高壓組年齡顯著高于AE-COPD組(73.5歲vs70歲,P=0.030)。AECOPD合并肺動脈高壓組患者入院時呼吸頻率、PaCO2、剩余堿及球蛋白顯著高于AECOPD組;AECOPD合并肺動脈高壓組患者氧合指數(PaO2/FiO2)、血淋巴細胞計數顯著低于AECOPD組(P均<0.05)。兩組患者的病程、吸煙史、BMI、心率、性別、CRP、凝血指標、平均住院時間、合并癥、靜脈使用激素情況、抗生素使用情況(單用或聯合用藥)、支氣管舒張劑的使用、呼吸支持(包括有創和無創機械通氣)、住院費用均無明顯統計學差異,具體結果(見表1,2)。同時,比較兩組患者的肺功能參數(FEV1% pred,FEV1/FVC,PEF,MEF75%,MEF50%,MEF25%)、心臟彩超指標(AO,LA,IVSD,LVD,SV,EF,FS,LVPWD) 和胸部CT軸向肺動脈主干內徑/升主動脈內徑比值,均未見明顯統計學差異(P均>0.05)。AECOPD合并肺動脈高壓組患者心臟彩超右心室壓力顯著高于AECOPD組(P<0.05),具體結果(見表3)。
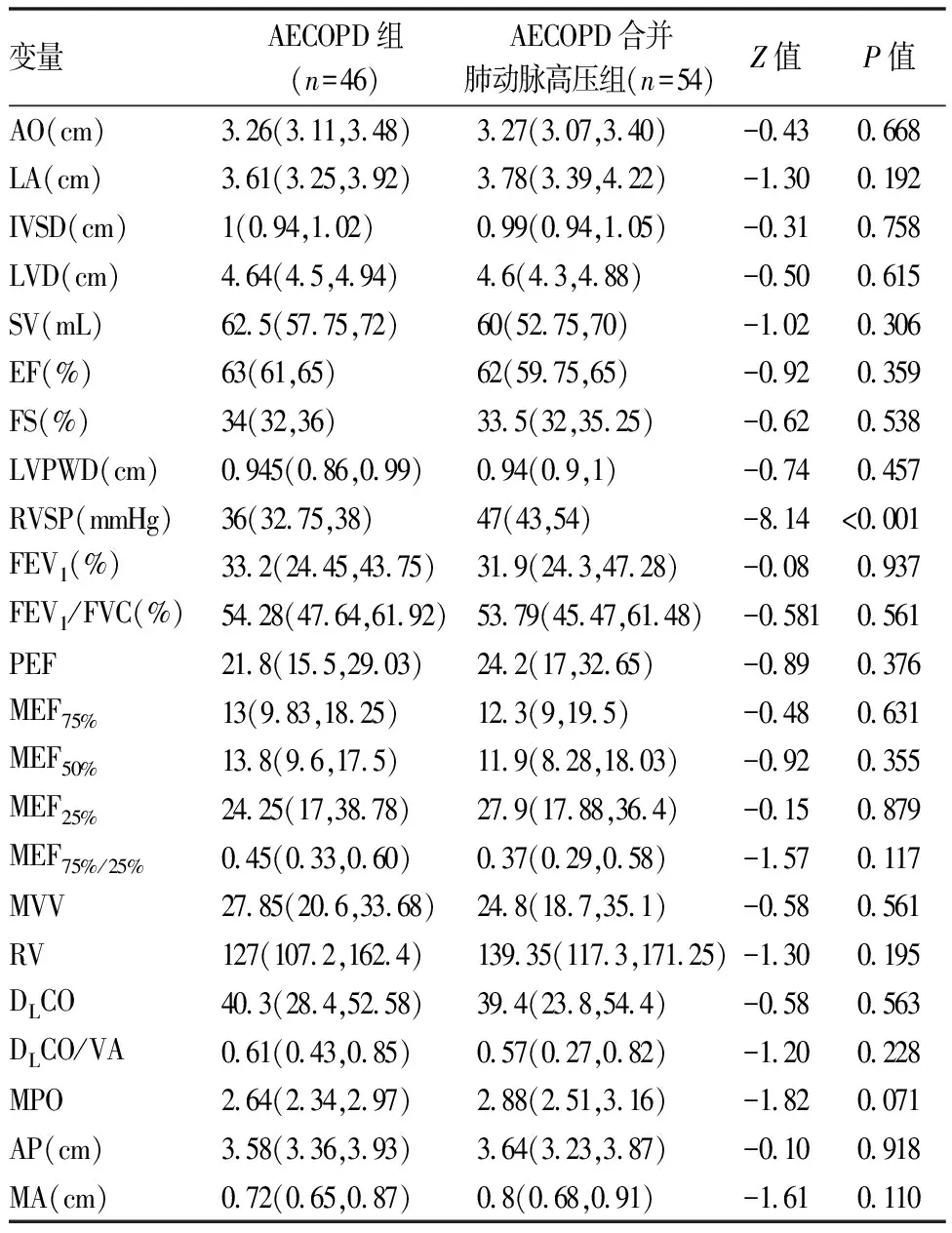
表3 兩組間心臟彩超、肺功能及胸部CT參數比較[M(P25,P75)]
三、Logistic回歸分析及相關性分析
通過組間比較提示年齡、入院時呼吸頻率、高PaCO2、高剩余堿、低氧合指數(PaO2/FiO2)、高球蛋白和低淋巴細胞計數在兩組間具有統計學意義。進一步采用多元Logistic回歸分析提示年齡及高PaCO2為AECOPD合并肺動脈高壓的高危因素(如表4)。
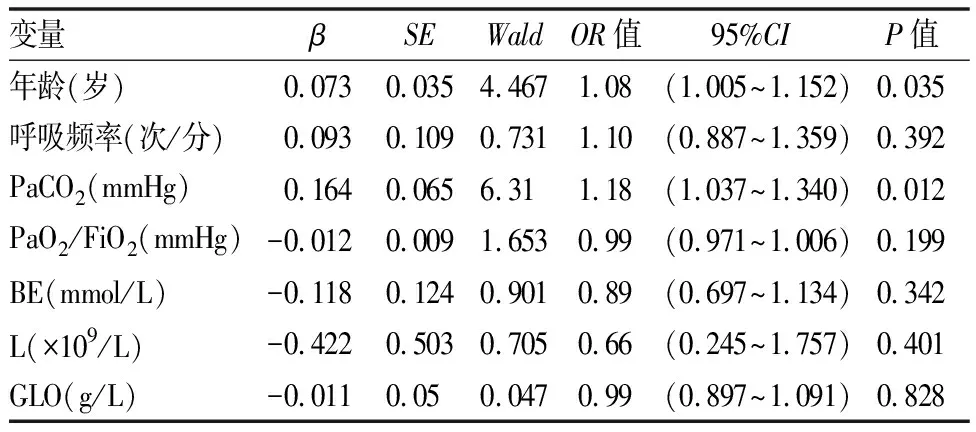
表4 AECOPD患者合并肺動脈高壓的臨床高危因素的Logistic回歸分析
為進一步分析AECOPD肺動脈壓力與臨床高危因素間的相關性,采用Spearman相關性分析比較有意義的臨床高危因素與右心室壓力的相關性。結果顯示PaCO2、入院時呼吸頻率、剩余堿與右心室壓力呈顯著正相關(P值<0.05),而氧合指數(PaO2/FiO2)、淋巴細胞與右心室壓力呈顯著負相關(P值<0.05),具體(見表5)。
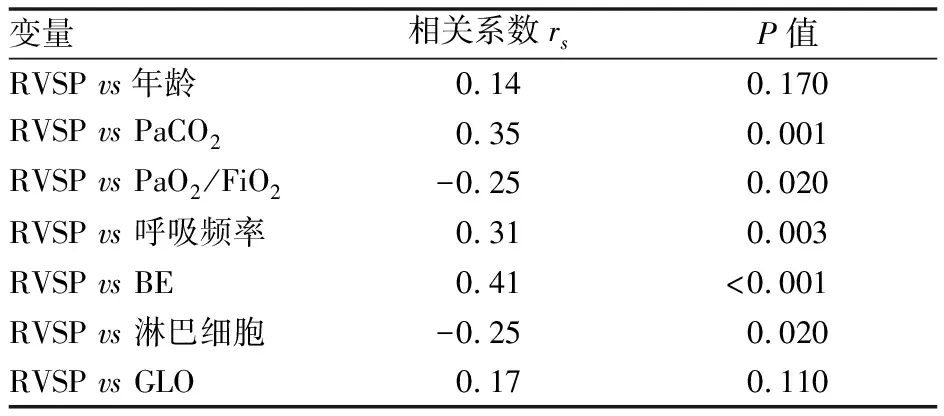
表5 AECOPD患者合并肺動脈高壓的臨床高危因素與右心室壓力的相關性分析
討 論
本研究通過回顧性研究分析發現AECOPD合并肺動脈高壓組患者入院時呼吸頻率、PaCO2、剩余堿及球蛋白顯著高于不伴有肺動脈高壓組,而氧合指數(PaO2/FiO2)、血淋巴細胞計數顯著低于不伴有肺動脈高壓組。采用多元Logistic回歸分析提示高齡及高PaCO2是AECOPD患者合并肺動脈高壓的獨立臨床高危因素。
COPD是肺部疾病低氧所致肺動脈高壓最常見的病因之一[11],研究顯示COPD相關肺動脈高壓的患病率在20%~91%[12-13],而有關AECOPD合并肺動脈高壓的患病率鮮有報道,本研究中AECOPD合并肺動脈高壓患病率為54%,顯著高于代靈靈等人報道的住院AECOPD患者肺動脈高壓患病率為21.5%[14],分析原因可能與兩者納入標準、排除標準以及人群分布特征不同等有關。年齡是AECOPD患者合并肺動脈高壓的易感因素,這可能與在生理狀態下,肺血管內皮細胞及肺血管平滑肌隨年齡的增加出現功能紊亂有關[15]。淋巴細胞是機體重要的炎癥及免疫細胞,氣道、肺實質和肺血管的慢性炎癥反應是慢阻肺的特征性改變,也是參與COPD發生發展的重要發病機制之一[16]。本研究中AECOPD合并肺動脈高壓組患者的血淋巴細胞計數顯著低于不伴有肺動脈高壓組,這與既往研究結果相一致[14]。分析可能與AECOPD患者機體炎癥細胞活化并消耗,激活下游的細胞炎癥因子分泌及基質金屬蛋白酶的合成,促進肺血管收縮及重塑有關[17]。球蛋白是一種具有免疫功能的血清蛋白,常在機體遭遇外來刺激時由肝臟代償性分泌產生。本研究中發現AECOPD合并肺動脈高壓組血球蛋白顯著高于不伴有肺動脈高壓組,這在既往相關研究中鮮有報道,分析原因可能與肺動脈高壓時繼發的右心功能不全、肝淤血、肝臟代償性分泌球蛋白增加有關,具體有待于進一步的臨床及分子研究報道。
肺通氣功能障礙是COPD早期病理生理改變,在疾病后期由于肺泡和毛細血管喪失、彌散面積減少,繼發出現肺換氣功能障礙,從而出現缺氧和CO2潴留,患者可出現不同程度的低氧血癥和高碳酸血癥[18-19]。本研究發現AECOPD合并肺動脈高壓組PaCO2、剩余堿顯著高于無肺動脈高壓組,而氧合指數(PaO2/FiO2)顯著減低,且相關性研究分析發現PaCO2、剩余堿與右心室壓力顯著正相關,氧合指數(PaO2/FiO2)與右心室壓力顯著負相關,與Liu等[20]研究發現高碳酸血癥及低氧血癥是導致慢性肺部疾病患者平均肺動脈壓力增高的獨立因素基本一致。分析與急性加重期COPD患者體內低氧血癥及高碳酸血癥進一步加重,繼發導致肺血管收縮和重塑、血管內皮細胞及血管平滑肌功能障礙,增加肺動脈壓力及右心負荷密切相關[2]。由此我們推測降低或消除高PaCO2可能是降低AECOPD患者合并肺動脈高壓的一種臨床治療策略。
綜上所述,本研究通過回顧性分析比較AECOPD伴和不伴有肺動脈高壓患者的臨床特征,結果發現高齡及高PaCO2可能是AECOPD合并肺動脈高壓的臨床高危因素。為臨床上醫務工作者早期發現并治療AECOPD患者合并肺動脈高壓提供一定的臨床依據及治療策略。然而,本研究為單中心回顧性研究,研究結論可能存在一定偏倚及局限性,有待于進一步的多中心及前瞻性臨床研究支持及驗證。

