貯藏前后煙草種子的轉錄組與多肽組分析
李元君,王國平,牛永志,鄭昀曄,張立猛
玉溪中煙種子有限責任公司,云南玉溪 653100
種子是最基本的農業生產資料,種子成熟時大量合成蛋白質、淀粉和脂類等貯藏化合物,為下一代植物生長提供物質基礎[1]。煙草種子粒徑小、繁殖系數高,但在繁種收獲后需經過貯藏階段才會投入使用[2]。大量研究表明,在貯藏過程中,種子時刻受到外界環境因素的影響,種子內部不斷進行新陳代謝活動,種子活力下降,因此,煙草種子貯藏環境的溫度、濕度及貯藏時間等關鍵因素的控制,貯藏后種子質量的優劣,對保障煙葉生產具有重要意義。
隨著研究的深入,對于種子貯藏研究已經從生理生化分析發展到了功能基因和蛋白的挖掘,已有研究表明種子貯藏過程中眾多基因或蛋白發生了變化,例如:ABI3[3]、ATHB25[4]等激素相關基因,OsALDH7[5]、PLDα1[6]等活性氧相關基因以及一些基因組修復[7]、種皮結構[8]等基因。此外,多肽是在生命過程起著極其重要作用的一類化合物[9],迄今在生物體內發現的多肽已達數萬種,其廣泛參與和調節機體內各系統、器官、組織和細胞的功能活動。研究也表明植物多肽參與受精授粉、根系發育、葉片發育等眾多生物過程[10-12]。王國平等[13]基于多肽組學分析了煙草種子萌動前后的蛋白與多肽變化,并篩選出一個能夠促進種子萌發的新型多肽。但目前對多肽的研究和認識遠遠不夠,對于種子成熟、貯藏相關的多肽研究還未見報道。
本研究通過轉錄組與多肽組手段,研究貯藏期間煙草種子內部基因和多肽的表達差異與功能注釋,挖掘調控種子貯藏活性的關鍵多肽,為指導種子貯藏提供理論依據和研究基礎。
1 材料與方法
1.1 試驗材料
供試材料煙草云煙105種子于2020年采收于西雙版納冬繁基地。
1.2 試驗方法
1.2.1 種子的貯藏
將種子置于溫度18℃,空氣相對濕度40%以下的條件貯藏[14]。10 d 后開始取樣,之后每隔2 周取樣,80 d 后,每隔4 周取樣,樣品種子進行發芽檢測。
1.2.2 種子發芽檢測
在培養皿中墊海綿和濾紙,加入自來水,每個培養皿均勻播入100 粒種子,加蓋。將培養品置于人工氣候室,在溫度25℃,每天光照12 h 的條件下發芽,發芽期間保持濾紙濕潤。從第4 d 起每天記錄發芽種子數(以露出子葉計為種子發芽),連續記錄14 d。每個處理3 個重復,統計發芽勢、發芽率。計算方法:發芽勢(%)=(第7 d 發芽種子數/供試種子數)×100%;發芽率(%)=(第14 d 發芽種子數/供試種子數)×100%[1]。
1.2.3 轉錄組檢測與分析
取貯藏前后的種子樣品,用振蕩研磨儀將種子樣品磨碎后,采用Trizol 法提取總RNA(Invitrogen,Carlsbad, CA, USA),使用試劑盒去除rRNA,然后通過帶有Oligo(dT)的磁珠富集具有polyA 尾巴的真核mRNA 后,用緩沖液把mRNA 打斷。以片段化的mRNA 為模版,隨機寡核苷酸為引物,合成cDNA。cDNA 經過末端修復、加A 尾并連接測序接頭,用AMPure XP beads 篩選200 bp 左右的cDNA,進行PCR擴增,最終獲得文庫。
為減少無效數據帶來的分析干擾,利用fastp[15]過濾掉(1)含adapter 的;(2)含(N)比例大于10%的;(3)全部都是A 堿基的以及(4)質量值Q≤20的堿基數占整條read 的50%以上的低質量數據,得到clean read。然后使用HISAT2[16]將整理好的數據和煙草參考基因組( https://solgenomics.net/organism/Nicotiana_tabacum/genome)進行比對,用RSEM[17]軟件作表達量分析,最后使用DESeq2[18]進行差異表達和基因富集分析。
1.2.4 多肽組檢測及分析
1.2.4.1 樣品制備
種子樣品研磨后加入裂解液(1%SDS, 8 mol/L urea, 1xProtease Inhibitor Cocktail(Roche Ltd.Basel,Swizerland)),振蕩研磨3*400 s,冰上裂解30 min。高速離心15 min(4℃, 15000 rpm),取上清。用10K超濾管(Millipore,Billerica)于4℃下8000 g離心30 min去除高分子量的蛋白,然后采用 C18 除鹽柱(MonoSpin C18, GL)對樣品進行除鹽并用真空濃縮儀抽干,于-80℃條件下保存待檢。
1.2.4.2 多肽定性定量及差異分析
樣品由配備在線納噴離子源的LC-MS/MS進行分析。得到的串聯質譜圖經過PEAKS Studio version X+(Bioinformatics Solutions Inc., Waterloo, Canada)分析后用PEAKS DB 搜索煙草基因組數據庫,設置None enzyme 即非酶切。搜庫參數碎片離子質量容許誤差:0.02 Da,母離子質量容許誤差:7 ppm,可變修飾:Oxidation (M) 15.99,Acetylation (Protein N-term)42.01。肽段卡值為:-10lgP≥20。根據搜庫結果對多肽進行定性定量分析。
同時,根據多肽定量結果,篩選出比較組間豐度發生顯著變化的多肽,差異分析閾值:差異倍數(Fold change,FC)的絕對值大于1.2 倍,P值<0.05,并要求特異性肽段Unique Peptides≥1。
1.2.4.3 生物學信息分析
由于多肽序列較短,且數據庫中對多肽的注釋較低,為完整了解多肽的生物學功能,使用Blast2GO[19]version 5 對鑒定出的所有多肽所屬的蛋白進行GO 和KEGG 注釋,以差異蛋白為測試集,全基因組編碼蛋白為背景,基于超幾何分布檢驗對差異基因進行GO和KEGG 代謝通路富集分析。
2 結果與分析
2.1 貯藏時間對種子發芽的影響
由圖1 可知,剛收獲的云煙105 種子發芽率達到90%以上,與優質種子發芽率95%以上的標準相比,仍然偏低。其發芽勢僅為65%,與優質種子發芽勢92%以上的標準相比,明顯偏低。在貯藏溫度18℃條件下,隨著貯藏時間的增加,種子發芽率略微升高,而發芽勢顯著升高,貯藏到大概200 d 以上的種子發芽勢已經達到90%以上,發芽率和發芽勢均趨于穩定。說明云煙105 種子剛收獲后活力較低,經過一段時間貯藏后活力增高。
2.2 貯藏前后種子的差異基因篩選及分析
分別對貯藏200 d 以上的種子(V6)和剛收獲的種子(V7)進行轉錄組測序,PCA 分析顯示兩組樣品間差異性較好,可用于后續分析(圖2)。設置差異基因篩選標準為FDR<0.05 且|log2FC|>1,共獲得45712個基因,264 個差異基因(圖3),其中有186 個基因上調表達、78 個基因下調表達。可以看出種子經過長期貯藏后,成熟更加充分并趨于穩定,相應的基因以下調表達為主。
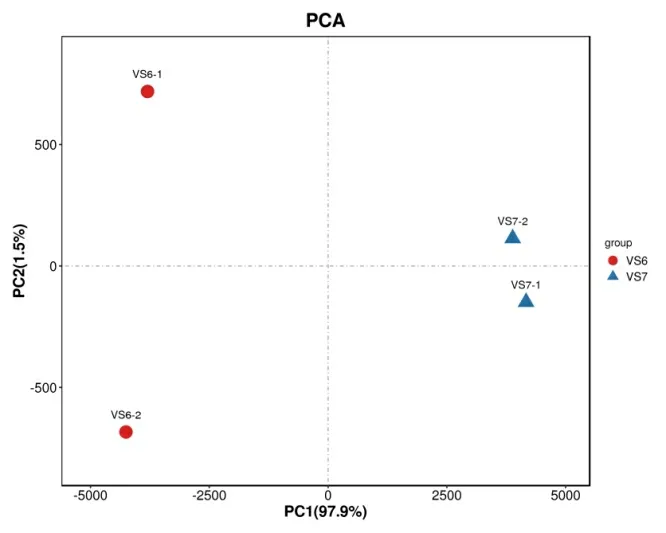
圖2 貯藏前后種子中基因成分分析PCA 圖Fig.2 PCA of differentially expressed genes in seeds before and after storage
2.3 貯藏前后種子差異基因的GO 和KEGG富集分析
對貯藏前后種子差異基因的GO 富集分析結果顯示,差異基因可以注釋到47 個GO 二級單元條目中,代謝過程(GO:0008152,50%)、細胞過程(GO:0009987,46.59%)、單生物過程(GO:0044699,45.83%);細胞組分(GO:0044464,28.03%)、細胞膜(GO:0016020,20.83%);催化活性(GO:0003824,49.62%)、結合(GO:0005488,39.77%)的差異基因數占總差異基因數百分比較高(圖4A)。分別在3 個ontology 中篩選Q 值最小的前20 個GO term(圖4B、C、D),可以看出差異基因主要富集在生物過程條目的硫酸鹽同化(GO:0000103)、脂肪酸代謝(GO:0006631)、脫落酸轉運(GO:0080168)、刺激應答(GO:0043207)、防御反應(GO:0006952)、單羧酸代謝過程(GO:0032787)、脂質代謝(GO:0006629)等過程;細胞組分條目的細胞連接(GO:0030054)、細胞膜(GO:0016020)、膜的固有成分(GO:0031224)等;分子功能條目中的硫氧還 蛋 白 活 性( GO:0004604 )、 鐵 離 子 結 合(GO:0005506)、氧化還原酶活性(GO:0016705)等。對貯藏前后種子差異基因進行KEGG 富集分析,篩選Q 值最小的前20 個途徑(圖4E),差異基因主要富集在次生代謝物的生物合成(Biosynthesis of secondary metabolites)、硫代謝(Sulfur metabolism)、脂肪酸延長(Fatty acid elongation)、氨基酸合成(Amino acid metabolism)、植物激素信號轉導( Plant hormone signal transduction)等。
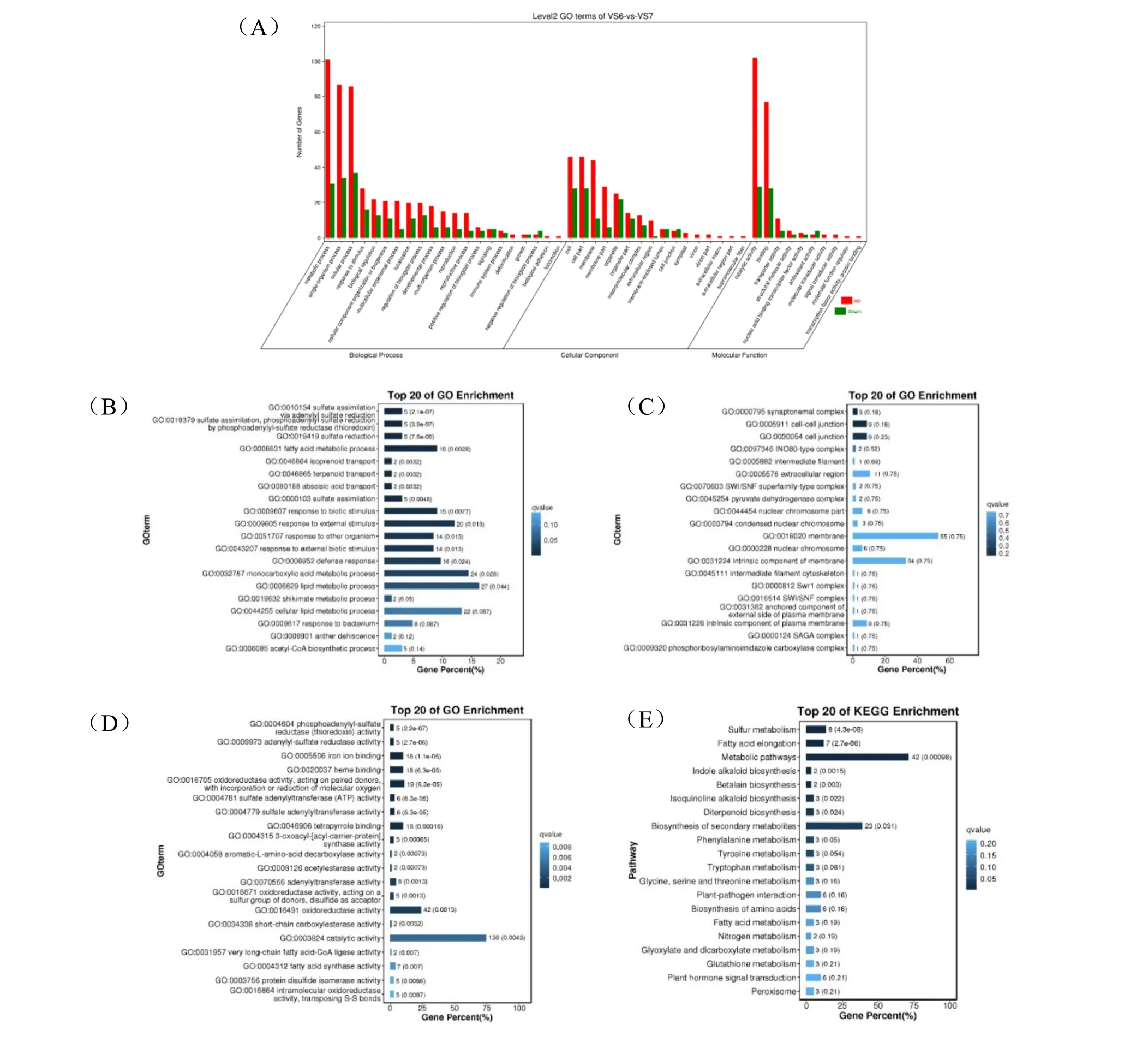
圖4 差異表達基因的GO 和KEGG 富集分析Fig.4 GO and KEGG enrichment analyses of differentially expressed genes
2.4 貯藏前后種子的多肽鑒定
分別對貯藏200 d 以上的種子(V6)和剛收獲的種子(V7)進行多肽的提取,并進行質譜鑒定。通過PCA 分析顯示兩組樣品間差異性較好,可用于后續分析(圖5)。對獲得的質譜圖與蛋白質數據庫進行比對分析(-10lgP≥20,FDR≤0.01),獲得匹配質譜圖數2589 個,共匹配到特異肽段1052 個,蛋白質數量385個。鑒定獲得的肽段主要集中在6~23 個氨基酸范圍內,占全部鑒定肽段的96%以上。最終在貯藏前后種子樣品中共篩選(P值<0.05)到256 個差異多肽,其中138 個多肽上調表達,118 個多肽下調表達(圖6A)。可以看出種子經過長期貯藏后,相應的多肽以下調表達為主,這與基因表達規律一致。
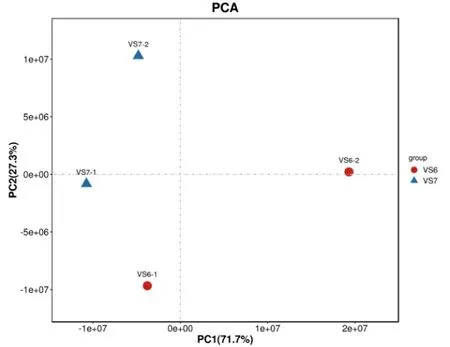
圖5 貯藏前后種子中多肽樣品成分分析PCA 圖Fig.5 PCA of differentially expressed peptides in seeds before and after storage
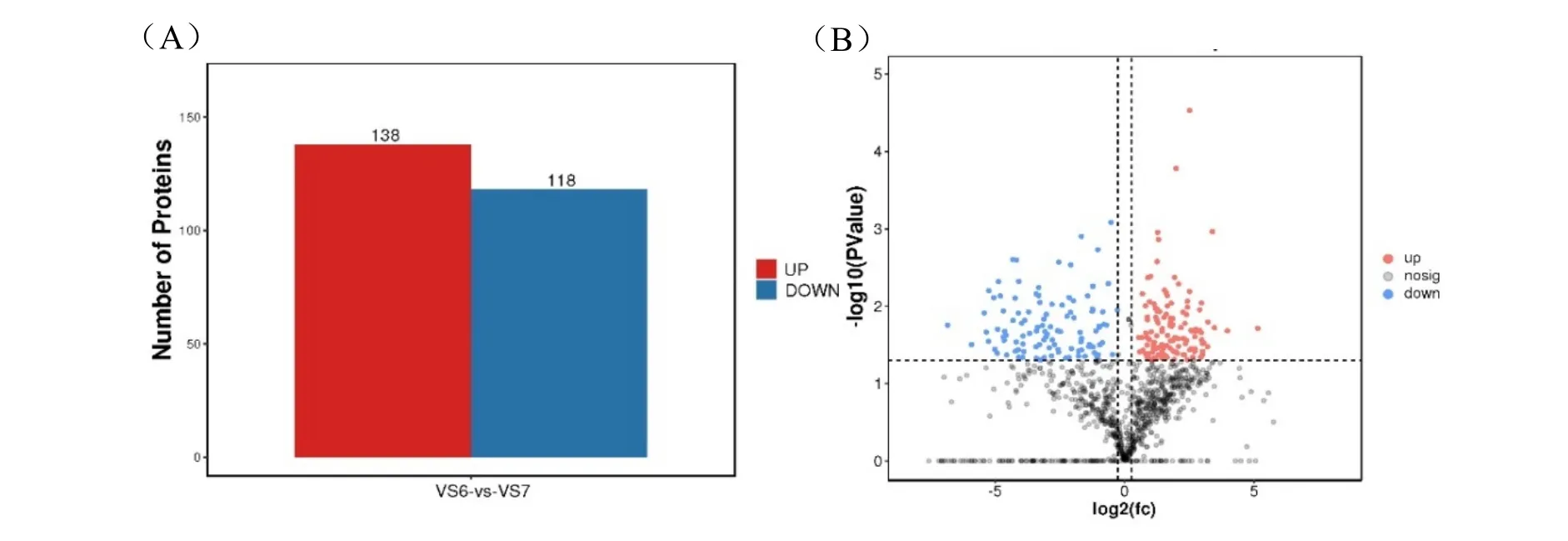
圖6 貯藏前后種子差異多肽Fig.6 Differentially expressed peptide in seeds before and after storage
2.5 貯藏前后種子差異多肽所屬蛋白的GO 和KEGG富集分析
貯藏前后種子樣品中共篩選256 個差異多肽,這些差異多肽共匹配到125 個蛋白。對這些蛋白進行GO 富集分析,結果顯示,共注釋到41 個GO 二級單元條目,其中差異多肽數占總差異多肽數百分較高分的條目分別是單生物過程(13.67%)、代謝過程(12.89%)、細胞過程(9.38%);細胞組分(8.98%)、細胞器(6.25%);催化活性(10.55%)、結合(9.77%)等(圖7A)。分別在3 個ontology中篩選Q 值最小的前20 個GO 條目,可以看出差異較大的多肽主要富集在生物過程條目的胚胎發育(GO:0009790)、種子發育(GO:0048316)、種子休眠的胚胎發育終止(GO:0009793)等;細胞組分條目的外膜(GO:0031975)、核膜(GO:0005635)、液泡(GO:005773)等;以及分子功能條目的氧化還原酶活性(GO:0016491 )、 過氧化物酶活性(GO:0051213)、裂解酶活性(GO:0016829)、脂質結合(GO:0008289)等(圖7B、C、D)。對貯藏前后種子差異多肽所屬蛋白進行KEGG 富集分析,篩選Q 值最小的前20 個途徑,可以看出差異多肽主要富集在脂肪酸代謝、過氧化酶體、α-亞麻酸代謝、乙醛酸和二羧酸代謝、碳代謝等通路(圖7E)。
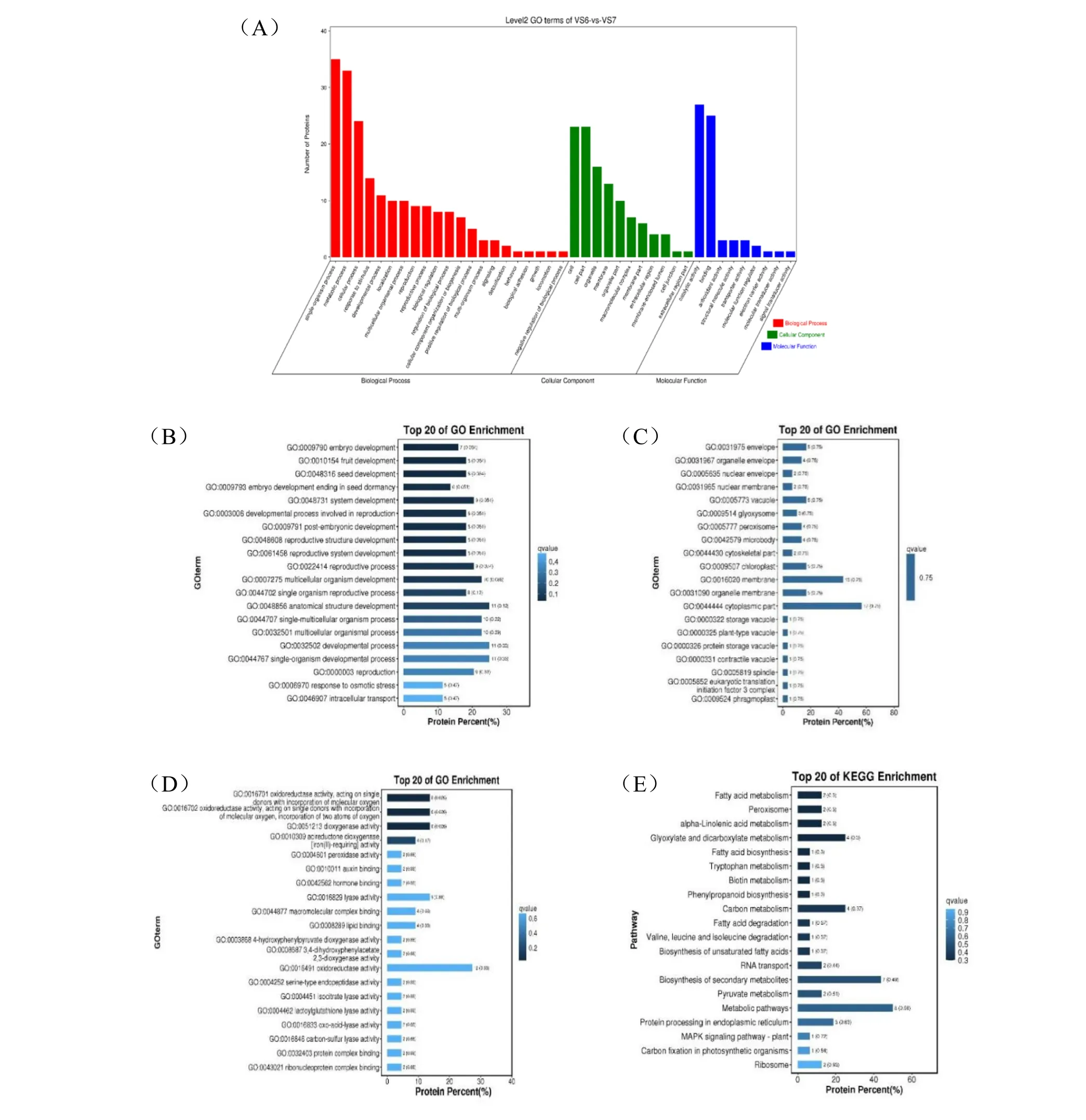
圖7 差異多肽所屬蛋白的GO 和KEGG 富集分析Fig.7 GO & KEGG enrichment analysis of differentially expressed peptide matched proteins
2.6 貯藏前后種子的轉錄組及多肽組交集分析
本研究在貯藏前后種子中共檢測到差異基因264個、差異多肽256 個,差異多肽匹配到的蛋白125。將差異基因和差異多肽所屬蛋白集合取交集,獲得1個交集基因,即Nitab4.5_0000072g0130(圖8)。該基因為預測的枯草菌素樣蛋白酶SBT1.3(Subtilisin-like protease SBT1.3),主要作用為蛋白水解,具有絲氨酸型內肽酶活性。
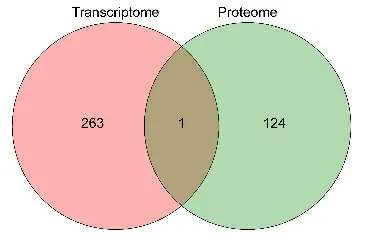
圖8 貯藏前后種子中差異表達基因和蛋白韋恩圖Fig.8 Venn diagram of differentially expressed genes and proteins in seeds before and after storage
2.7 目標多肽篩選
為了進一步篩選目標多肽,從獲得的256 個差異多肽所屬蛋白中繼續篩選具有信號肽、蛋白長度不超過250 個氨基酸的蛋白,定義為目標多肽[13]。最終獲得含信號肽的2 個多肽分子,且長度均不超過250 個氨基酸。其中Nitab4.5_0008018g0020,長度為142 個氨基酸,是類2S 富硫種子貯藏蛋白2(2S sulfur-rich seed storage protein 2-like),而另一個Nitab4.5_0002257g0090,長度為199 個氨基酸,則無注釋信息。這兩個多肽可能在種子成熟或貯藏過程起重要作用,后續可進一步驗證其功能。
3 討論
種子貯藏伴隨種子內部一系列生理生化活性指標的變化,如脂肪氧化酶活性、抗氧化酶活性和非酶類抗氧化劑的種類和含量[20]。隨著貯藏時間的延長,種子活力或種子壽命逐漸降低。本研究使用的試驗材料為煙草云煙105 的種子,剛收獲的云煙105 種子發芽率在90%以上,與優質種子發芽率95%以上的標準相比,仍然偏低,而發芽勢與優質種子發芽勢92%以上的標準相比,明顯偏低,經過200 多天貯藏后,種子的發芽率和發芽勢不斷提高到90%以上并趨于穩定,種子活力提高。這一現象與一般認為的種子貯藏規律相反,考慮可能與種子后熟有關。種子后熟指的是種子形態成熟后被收獲,并與母株脫離,但種子內部的生理生化過程仍然繼續進行,直到生理成熟。煙草種子的采收時間主要是根據果皮顏色判斷,果皮達到黃褐色為最佳成熟采收時間[21],而云煙105 的種子之所以活力還偏低,可能是未達到生理成熟導致。本研究的轉錄組和多肽組數據也表明,隨著種子的成熟,其基因和多肽主要以下調為主,說明種子代謝活躍度降低,成熟更加充分并趨于穩定。
本研究從轉錄組和多肽組層面解析種子貯藏前后的基因與多肽表達差異并進行GO 和KEGG 富集分析。差異基因和差異多肽主要富集到脂肪酸代謝、過氧化物酶代謝、脂質代謝、激素信號、防御反應等途徑。研究表明,煙草種子油含量較高,占到種子總量的33.6%~39.4%[22],種子成熟過程中油脂的代謝也相對活躍[23]。隨著種子的成熟穩定,對外界環境的抗性也逐漸增強,其中抗氧化酶活性起著重要作用[24]。此外,激素也是種子成熟、萌發的重要調控因子[25]。因此,本研究結果也充分說明了煙草種子貯藏過程中富集到的主要途徑與種子成熟穩定密切相關。本研究進一步篩選到 2 個目標多肽,其中Nitab4.5_0008018g0020是類2S 富硫種子貯藏蛋白2,與種子成熟過程的營養積累有關, 另一個Nitab4.5_0002257g0090則無注釋信息,有待進一步研究。此外,目前關于種子的后熟研究主要集中在赤霉素的合成、脫落酸的抑制、細胞分裂促進等分子機制研究[26],多肽對種子休眠的解除及后熟過程的調控等多肽組研究仍然空白,本研究篩選的目標多肽分子在種子后熟過程中是否具有調控作用還有待進一步研究。
4 結論
本研究對貯藏前后煙草種子的基因和多肽進行了篩選,差異基因和差異多肽主要富集到脂肪酸代謝、過氧化物酶代謝、脂質代謝、激素信號、防御反應等與種子成熟穩定密切相關的途徑。此外,本研究篩選到2 個與種子成熟及老化相關的目標多肽,為后續的深入研究奠定了基礎。

