茯苓皮總三萜大孔樹脂純化工藝及體外抗炎活性研究
呂婷婷,王妍妍,2,張 越,2,孟祥宇,丁衛健,彭代銀,2,王 雷,2,姚 亮,2,陳衛東,2,3
(1.安徽中醫藥大學藥學院,安徽 合肥 230012;2.省部共建安徽道地中藥材品質提升協同創新中心,安徽 合肥 230012;3.中藥飲片制造新技術安徽省重點實驗室,安徽 亳州 233500)
炎癥是炎癥因子共同作用的結果,當機體受到刺激因子侵襲時,免疫系統會發生一系列反應,產生血管充血擴張、毛細血管通透性增加的反應,以稀釋炎癥部位刺激因子水平,并伴隨紅、腫、熱、痛等不適癥狀[1-2]。現階段,非甾體抗炎藥多應用于炎癥性疾病,但同時也伴有不良反應,不利于疾病的有效治療[3-4]。許多天然藥物具有較好的抗炎作用[5-8],且作用溫和,毒性小,無不良反應[8]。因此,研究天然藥物中發揮抗炎作用的主要成分尤為重要。
茯苓Poriacocos(Schw.)Wolf為多孔菌科真菌的干燥菌核[9],其主要活性成分為茯苓多糖和三萜。茯苓皮為加工茯苓片、茯苓塊時削下的褐色茯苓表皮。茯苓皮中主要活性成分是三萜類成分,其中三萜類物質含量高于茯苓其他部位[10],具有利尿[11]、降血糖[12]、抗腫瘤[13]等藥理作用。課題組前期研究[14]發現,茯苓總三萜具有良好的抗炎作用,但茯苓皮中三萜成分的抗炎作用、三萜類化合物是否為治療炎癥的主要成分尚不明確。
茯苓皮三萜多見于粗提、萃取或分離單體成分的研究[15],存在富集三萜含量較少、制備工藝復雜等問題。因此,本研究以總三萜含量為指標,采用四因素三水平正交試驗優化HPD-100型大孔樹脂純化茯苓皮總三萜的工藝,并觀察茯苓皮總三萜純化前后對脂多糖(lipopolysaccharide,LPS)誘導的RAW 264.7細胞炎癥模型的抗炎作用。
1 材料
1.1 材料與試劑 茯苓皮由安徽省亳州市眾益堂中藥材銷售有限公司提供,經安徽中醫藥大學俞年軍教授鑒定為茯苓Poriacocos(Schw. )Wolf的外皮;香草醛(批號 210524Q)、冰醋酸(批號 20180810JN)、高氯酸(批號 20210613):上海潤捷化學試劑有限公司;水為超純水,其他試劑均為分析純;HPD-100型大孔吸附樹脂(批號 400-910-1997):金克隆(北京)生物技術有限公司;LPS(批號 S11060)、齊墩果酸(批號 B20954,含量≥98%):上海源葉生物科技有限公司;吲哚美辛腸溶片(批號 Y18M10C83262):山西省臨汾寶珠制藥有限公司;DMEM培養基(批號 ATBRC):山東思科捷生物技術有限公司;細胞計數試劑盒-8(cell count kit-8,CCK-8;批號 22082317):廣州賽國生物科技有限公司;胎牛血清(fetal bovine saline,FBS;批號 2177370):賽默飛生物制藥有限公司;一氧化氮(nitric oxide,NO)試劑盒(批號 A013-2-1):南京建成生物工程研究所;白細胞介素-6(interleukin-6,IL-6)試劑盒(批號 JL21070009)、白細胞介素-1β(interleukin-1β,IL-1β)試劑盒(批號 JL21070002)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)試劑盒(批號 JL21060011):武漢基因美科技有限公司。
1.2 儀器 紫外可見光光度計(型號 UV-1900):上海元析儀器有限公司;低溫冷卻液循環泵(型號 DLSB-10/20):鄭州長城科工貿有限公司;智能恒流泵(型號 BT1-200V-LCD):上海琪特分析儀器有限公司;循環水式多用真空泵[型號 SHZ-D(Ⅲ)]:鄭州市儀特儀器有限公司;集熱式恒溫加熱磁力攪拌器(型號 DF-101S):鞏義市予華儀器有限公司;酶標分析儀(型號 Rayto RT-6100):美國賽默飛世爾科技有限公司;CelMate二氧化碳培養箱(型號 CLM-170B-8-NF):益世科(上海)企業發展有限公司;立式壓力蒸汽滅菌器(型號 YXQ-LS-100SII):上海博訊實業有限公司醫療設備廠。
2 方法
2.1 茯苓皮總三萜提取工藝 按照文獻[16]的方法制備茯苓總三萜。稱取過40目篩的茯苓皮粉末50 g,置于圓底燒瓶中,加入1 L甲醇,于70 ℃水浴中回流6 h,提取2次,合并濾液,抽濾,60 ℃旋蒸至50~70 mL,轉移至蒸發皿中,于55 ℃烘箱烘干,得到粗提產物。粗提產物經乙酸乙酯萃取后得到乙酸乙酯部分。取適量茯苓皮總三萜粉末,甲醇復溶,配制成一定濃度的樣品溶液。
2.2 香草醛—高氯酸法測定總三萜含量
2.2.1 標準品溶液的制備 避光下精密稱取適量齊墩果酸粉末,甲醇溶解,得到0.1 mg/mL齊墩果酸對照品溶液。
2.2.2 檢測波長的選擇 取適量齊墩果酸標準品溶液,水浴揮干,加5%香草醛—冰醋酸溶液0.2 mL、高氯酸1.0 mL,60 ℃水浴15 min,冷卻后加入冰醋酸5.0 mL,混勻,于450~800 nm范圍內進行掃描,選擇有最大紫外吸收的波長為檢測波長。
2.2.3 標準曲線的制備及方法學考察 分別取0.3、0.4、0.5、0.6、0.7、0.8 mL的0.1 mg/mL齊墩果酸對照品溶液于試管中,按“2.2.2”項下顯色方法,在最大吸收波長下測定吸光度(optical density,OD)值,分析計算得回歸方程。經方法學考察儀器精密度、方法準確度、加樣回收率和樣品穩定性。
2.2.4 總三萜含量的測定 取茯苓皮總三萜粗提樣品溶液,采用“2.2.2”項下顯色方法,于最大吸收波長測定吸光度,代入標準曲線中計算三萜的百分含量。
2.3 茯苓皮總三萜純化樣品的制備 選用HPD-100型大孔樹脂,用無水乙醇浸泡24 h。濕法裝柱后用95%乙醇洗滌樹脂,洗滌至層析柱流出液加水[V(流出液):V(水)=1∶5]時沒有白色渾濁,再用蒸餾水洗至流出液澄清且無醇味,樹脂層面上保持2~5 mm液體,以免干柱,備用。稱取經過預處理好的HPD-100型大孔吸附樹脂,濕法裝柱,將120 mL茯苓皮總三萜粗提樣品溶液通過盛有大孔吸附樹脂的色譜柱,控制流速為1 mL/min。35%乙醇洗脫雜質,95%乙醇洗脫三萜類物質,收集洗脫液,于50 ℃烘箱烘干,即得茯苓皮總三萜純化樣品。
2.4 單因素與正交試驗設計 根據文獻[17]的純化工藝,以產物中總三萜含量為指標,采用“2.3”項下方法,考察上柱的大孔樹脂質量、上樣濃度、洗脫雜質容積、洗脫總三萜容積對純化效果的影響,每個因素下不同水平實驗重復3次。
根據正交試驗原理設計4因素3水平[L9(34)]實驗組合,見表1。根據純化產物的總三萜含量進行正交分析,確定純化茯苓皮總三萜的工藝。

表1 L9(34)正交試驗的因素水平表
2.5 純化工藝的重復性驗證 為驗證該純化工藝的穩定性,本研究重復5次平行純化茯苓皮總三萜,以考察本次工藝的重復性,確保每次純化所得茯苓皮總三萜純化產物的總三萜含量穩定。
2.6 富集總三萜方法比較 為比較醇提法、萃取法、大孔樹脂吸附方法對富集茯苓皮總三萜的影響,本研究采用醇提法獲取茯苓皮總三萜醇提物粉末、乙酸乙酯萃取獲取茯苓皮總三萜乙酸乙酯部分、經大孔樹脂純化工藝獲取總三萜純化產物粉末,采用香草醛—高氯酸法對其進行總三萜含量測定,以初步對比以上方法富集茯苓皮總三萜的效果。
2.7 體外抗炎活性的驗證
2.7.1 細胞培養及分組 將RAW 264.7細胞培養于DMEM培養基(含10% FBS及1%青霉素—鏈霉素混合液)中,置于37 ℃、5% CO2培養箱中培養。每日觀察細胞狀態,密度達80%~90%后傳代,用于后續實驗。將培養后的細胞分為空白組、模型組(LPS組)、陽性對照(吲哚美辛)組、茯苓皮總三萜粗提組、茯苓皮總三萜純化組。
2.7.2 CCK-8法測定藥物對細胞存活率的影響 取對數生長期的RAW 264.7細胞,用空白培養基稀釋混勻,制成細胞懸液,在37 ℃、5% CO2條件下孵育,至細胞貼壁生長至96孔板的80%左右時,吸棄上清,每孔加入藥液100 μL,孵育24 h后棄去藥液,避光環境下根據公式[V(空白培養基)∶V(CCK-8)=1∶10]配置CCK-8反應液,將其加入96孔板,置于37 ℃、5% CO2培養箱中孵育30 min,于酶標儀450 nm波長下檢測OD值。細胞存活率=(實驗組OD值-空白組OD值)/(對照組OD值-空白組OD值)×100%。
2.7.3 建立炎癥細胞模型與給藥 取對數期細胞,用空白培養基稀釋細胞,得細胞懸液,在37 ℃、5% CO2條件下孵育,細胞貼壁生長至96孔板的80%左右時,吸棄上清,每孔加入藥液100 μL,孵育24 h后棄去藥液,再加入1 μg/mL的LPS 100 μL于96孔板中,放置在37 ℃、5% CO2培養箱刺激12 h,以復制炎癥細胞模型。
2.7.4 NO釋放量與細胞炎癥遞質水平的測定 根據“3.3”項下操作方法,收集不同組分上清,按照NO、IL-1β、IL-6、TNF-α試劑盒說明書操作,測定NO釋放量和細胞炎癥遞質IL-1β、IL-6、TNF-α水平。
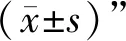
3 結果
3.1 總三萜的含量測定與方法學考察 本實驗采用香草醛—冰醋酸法測定產物的總三萜含量,該法被廣泛用于測定化合物中總三萜含量[18-20]。經顯色后掃描的最大OD值對應波長為546 nm(見圖1),齊墩果酸的標準曲線為y=11.18x-0.136 7(r=0.999 6),線性范圍為0.3~0.8 mg/mL。根據方法學考察結果,該法精密度良好,重復性高,且于反應后90 min內穩定可行,平均加標回收率為99.13%,以上結果均提示該法滿足樣品的分析要求。
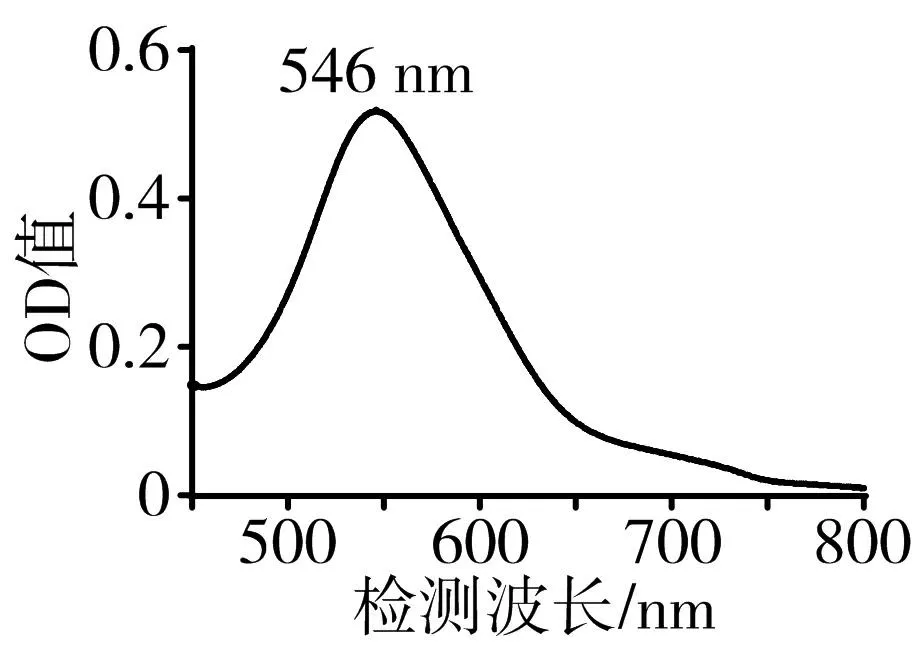
圖1 齊墩果酸的檢測波長和OD值關系
3.2 單因素實驗
3.2.1 上柱大孔樹脂質量對純化總三萜的影響 大孔吸附樹脂具有三維空間網狀結構,具備選擇性好、吸附效果良好且解吸附簡單、價格便宜等諸多優點[21]。如圖2所示,上柱大孔樹脂質量增加,純化后三萜的百分含量呈上升趨勢,因上柱25 g上柱大孔樹脂達上柱極限,故將上柱大孔樹脂質量考察上限定于25 g,且25 g大孔樹脂與20 g大孔樹脂純化后所得產物總三萜含量相近,故20 g大孔樹脂符合資源的合理應用。
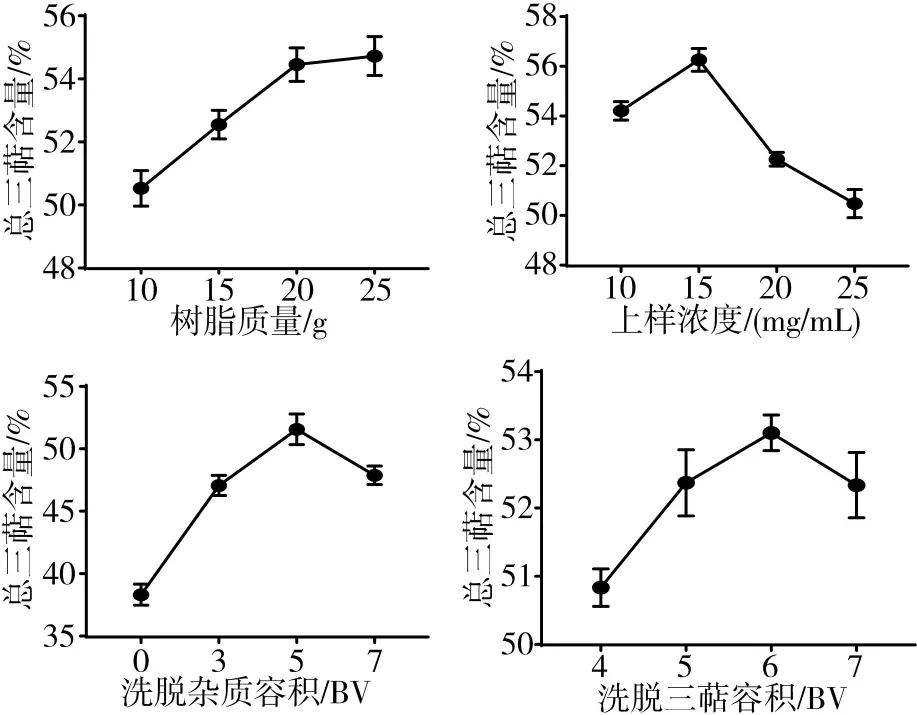
圖2 上柱大孔樹脂質量、上樣濃度、洗脫雜質容積、洗脫三萜容積對純化茯苓皮總三萜的影響
3.2.2 上樣濃度對純化總三萜的影響 上樣濃度增加時,供試液在15 mg/mL濃度時純化效果最佳,濃度過高可能導致樹脂吸附三萜成分呈過飽和狀態,吸附不充分進而導致純化后三萜含量下降,不利于樣品的有效利用。見圖2。
3.2.3 洗脫雜質容積對純化總三萜的影響 洗脫雜質容積增大,得到的純化物總三萜含量增加,尤其是洗脫雜質容積為0~5 BV時。但過度洗脫雜質可能會導致部分三萜損失,進而導致純化產物總三萜含量下降。見圖2。
3.2.4 洗脫三萜容積對純化總三萜的影響 隨著洗脫三萜容積的增加,純化物總三萜含量呈上升趨勢。但過度洗脫可能會導致部分未完全洗去的雜質流出,從而影響純化效果。見圖2。
3.3 正交試驗 茯苓皮總三萜純化效果的影響因素按影響程度(全距)大小依次是洗脫雜質容積、上樣濃度、洗脫三萜容積、上柱大孔樹脂質量。改進后茯苓皮總三萜純化工藝為上柱大孔樹脂質量20 g,上樣濃度15 mg/mL,35%乙醇洗脫雜質容積5 BV,95%乙醇洗脫三萜容積4 BV,所得純化物總三萜含量為70.36%。見表2、表3、表4。
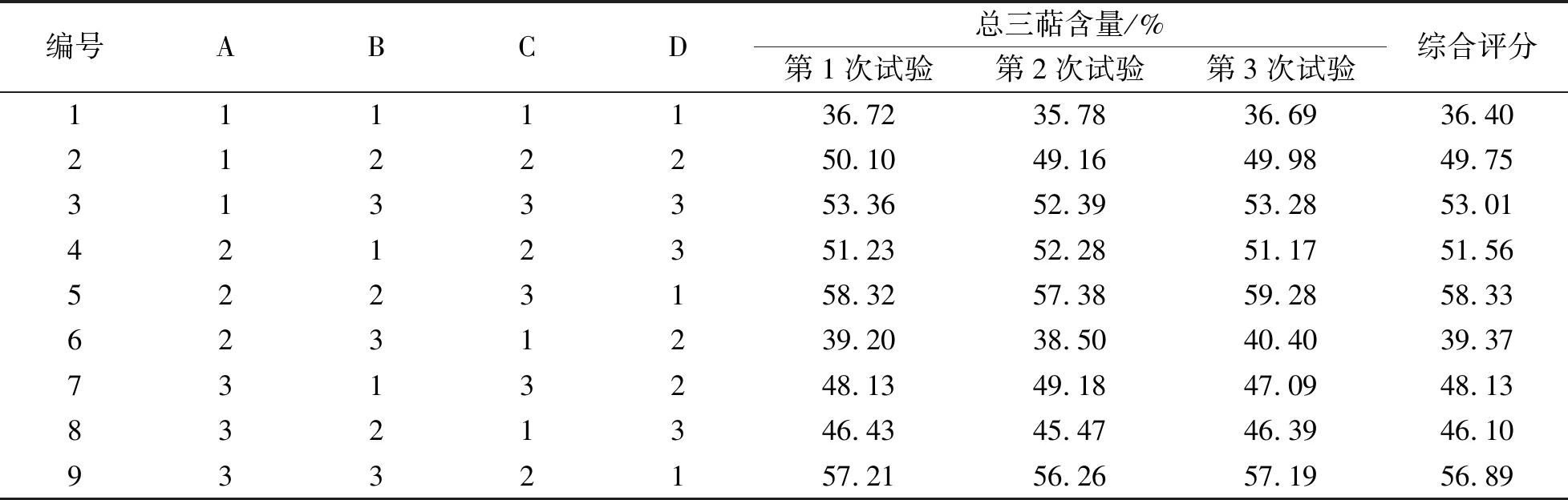
表2 L9(34)正交試驗原始數據
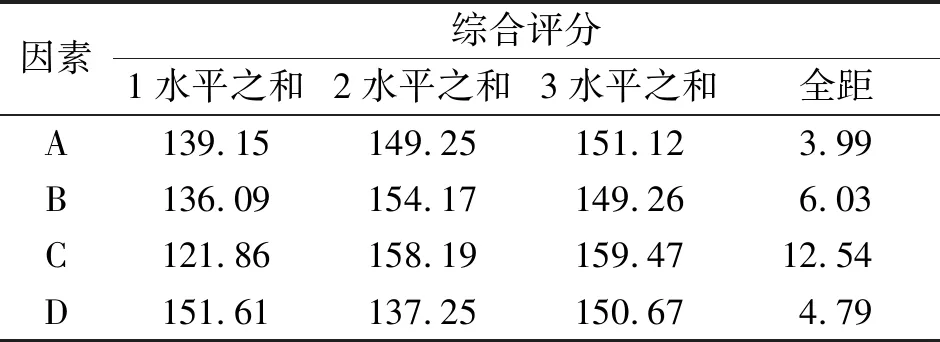
表3 正交試驗結果的描述性統計
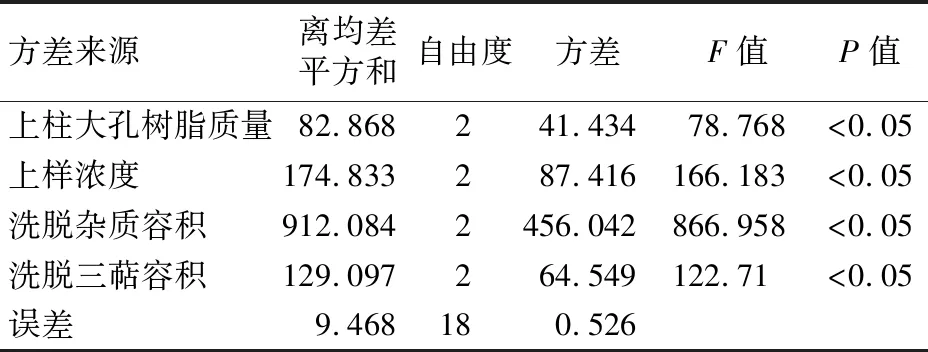
表4 正交試驗方差分析結果
3.4 重復性驗證 經重復該工藝純化得到5份不同批次的茯苓皮總三萜純化產物,經“2.2.2”項下顯色方法測定純化后總三萜含量,分別為70.36%、71.39%、67.83%、69.07%、66.19%,RSD為2.97%,提示該法重復性較好,純化產物總三萜含量穩定。
3.5 富集總三萜方法比較 經對醇提法、萃取法、大孔樹脂吸附法獲取的茯苓皮總三萜進行含量測定,其含量分別為29.97%、45.84%、70.36%,提示萃取法在一定程度上可富集茯苓皮中的總三萜成分,其中大孔樹脂吸附法富集總三萜成分最佳。
3.6 體外抗炎活性驗證實驗
3.6.1 茯苓皮總三萜對細胞存活率的影響 CCK-8檢測結果如圖3所示,各分組的細胞活力與空白組比較,差異均無統計學意義(P>0.05),提示各分組濃度均無明顯的細胞毒性,故分組給藥濃度為50、150、250 μg/mL。
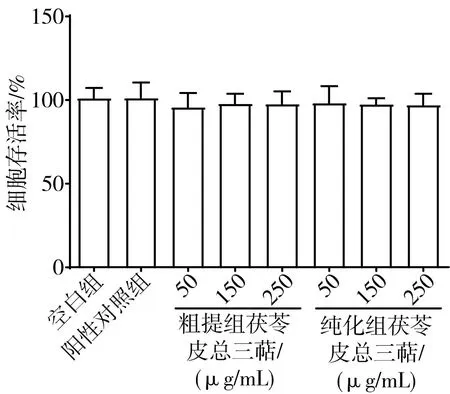
圖3 茯苓皮總三萜對RAW 264.7細胞存活率的影響
3.6.2 茯苓皮總三萜對細胞NO釋放量的影響 與空白組比較,模型組RAW 264.7細胞中NO濃度顯著增加(P<0.05)。與模型組比較,各給藥組RAW 264.7細胞中NO濃度均顯著降低(P<0.05)或呈降低趨勢(P>0.05),其中茯苓皮總三萜純化組降低NO水平的效應呈現劑量依賴性。見圖4。
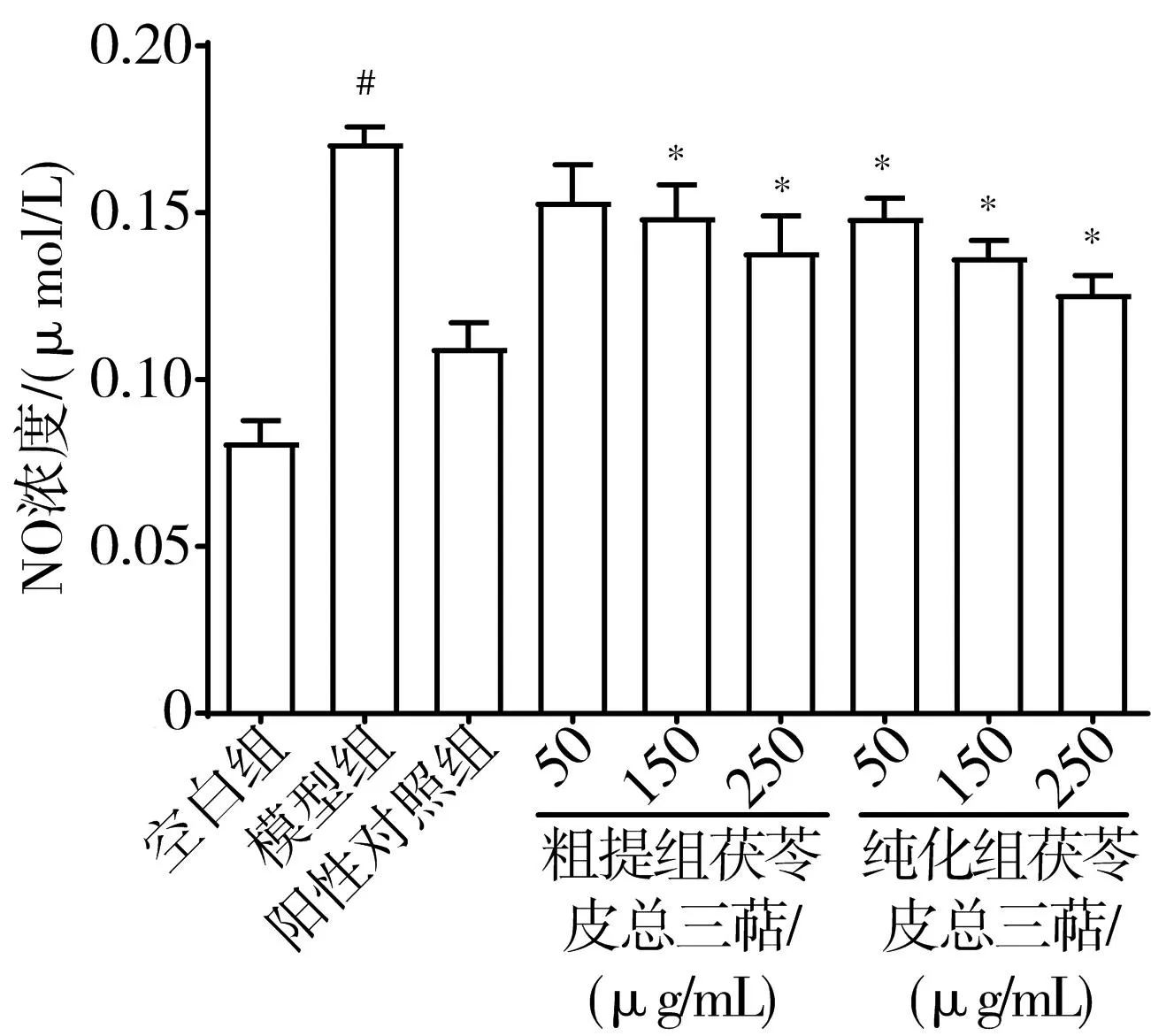
注:與空白組比較,#P<0.05;與模型組比較,*P<0.05
3.6.3 茯苓皮總三萜對RAW 264.7細胞內TNF-α、IL-1β和IL-6水平的影響 與空白組比較,模型組RAW 264.7細胞內TNF-α、IL-1β、IL-6水平顯著增加(P<0.05);與模型組比較,各給藥組RAW 264.7細胞內TNF-α、IL-1β、IL-6水平顯著降低(P<0.05)。見圖5。
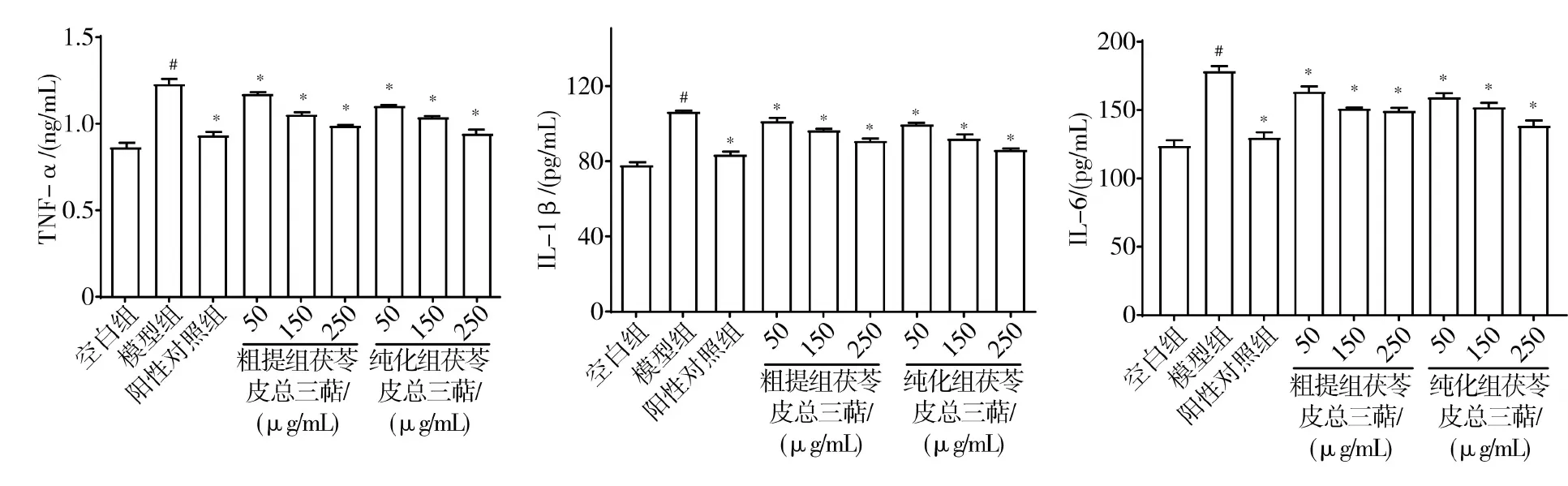
注:與空白組比較,#P<0.05;與模型組比較,*P<0.05
4 討論
萜類物質為許多中藥的主要活性成分,但存在提取含量低、種類復雜、不易分離等問題。本研究對醇提法、有機溶劑萃取法、大孔樹脂純化法提取茯苓皮中萜類物質進行了初步對比。結果表明,醇提法獲得總三萜成分的百分含量為29.97%,經有機溶劑乙酸乙酯萃取后其總三萜百分含量富集至45.84%,經大孔樹脂純化后總三萜含量可達70.36%。由此可見,大孔樹脂純化茯苓皮總三萜是一個切實可行的方法。
本研究以富含該成分較多的茯苓皮為研究對象進行提取純化,建立一種HPD-100型大孔樹脂純化茯苓皮總三萜的工藝,并通過體外實驗對比其純化前后的抗炎活性。在單因素實驗基礎上,即上樣樹脂質量、上柱大孔濃度、洗脫雜質容積、洗脫三萜容積均對純化茯苓皮總三萜的含量有一定影響,以純化后總三萜含量為指標,建立4因素3水平正交表,經正交實驗獲取純化茯苓皮總三萜的最佳純化條件。根據文獻[17],改進后的純化工藝為上柱樹脂質量20 g,上樣濃度15 mg/mL,35%乙醇洗脫雜質容積5 BV,95%乙醇洗脫三萜容積4 BV,茯苓皮總三萜純化效果影響因素按影響程度大小排序依次是洗脫雜質容積、上樣濃度、洗脫三萜容積、上柱大孔樹脂質量,得到化合物總三萜含量為70.36%,較粗提制備的三萜含量提高40%,并且經重復性實驗驗證該工藝純化總三萜含量較穩定。
LPS誘導的RAW 264.7細胞急性炎癥模型具有操作簡易、模型穩定、快速經濟等特點[22]。炎癥遞質NO參與炎癥反應,調節NO水平可能是發揮抗炎作用的重要途徑[23-26]。Bao等[27]依據三萜單體化合物抑制NO含量水平,篩選出發揮較好抗炎作用的單體成分,并依據其母核、官能團結構的差異,探討其發揮抗炎效果的構效關系。此外,也有許多研究[2,23,28]報道,以調節NO釋放量為參考,考察天然藥物的抗炎作用。
炎癥反應發生時,炎癥細胞可釋放出致炎因子,其生物標志物為IL-1β、IL-6和TNF-α等[29-31],是研究藥物抗炎作用的常用指標[23]。本研究通過建立細胞炎癥模型,測定細胞釋放的NO含量與炎癥因子水平,觀察粗提與純化的茯苓皮三萜抗炎作用。結果表明,粗提與純化的茯苓皮三萜能有效降低RAW 264.7細胞內NO含量與炎癥因子水平,純化后產物的抑制作用更明顯,這提示茯苓皮總三萜是發揮抗炎作用的主要藥效成分。

