基于Nrf2/RAGE/NF-κB信號通路探究丙泊酚對帕金森病大鼠認知障礙的影響*
高青 秦燕 任曉亮 宋瓊遠
(濟南市中西醫結合醫院麻醉科,山東 濟南271100)
帕金森病(Parkinson′s Disease,PD)主要發生于中老年人,臨床表現為動作遲緩、身體僵硬等運動障礙及認知功能障礙,其病理改變是腦黑質致密區多巴胺能神經元缺失、凋亡;研究認為PD致病機制與免疫炎性、氧化應激等有關[1-2]。核因子E2相關因子2(nuclear factor E2-related factor 2,Nrf2)通路是抗氧化應激通路,通過激活下游HO-1的表達,緩解PD大鼠神經功能損傷[3-4]。糖基化終末產物受體/核因子-κB(RAGE/NF-κB)信號通路參與中樞神經系統疾病的病理過程,通過參與調節神經炎癥、神經變性和記憶障礙等,在阿爾茨海默病、PD等疾病中發揮重要作用[5-6]。丙泊酚(Propofol)是一種靜脈麻醉藥,可抑制PD小鼠黑質炎癥反應與神經元凋亡,改善PD小鼠行為[7-8]。本研究觀察丙泊酚對PD認知功能障礙的影響,及對Nrf2與RAGE/NF-κB信號通路的影響,探討其作用機制。
1 材料與方法
1.1 實驗動物 60只6~8周齡SPF級雄性SD大鼠,體質量(200±20)g,購自武漢大學動物實驗中心,生產許可證:SCXK(鄂)2019-0004。本實驗經我院動物倫理委員會批準(批準號:2105-26)。
1.2 試劑 Propofol(D126608)、1-甲基4-苯基-1,2,3,6-四氫吡啶(MPTP)(M0896)購自Sigma公司,蘇木素伊紅(HE)染色試劑盒(C0105S)、過氧化氫酶(CAT)檢測試劑盒(S0051)、丙二醛脂質氧化(MDA)檢測試劑盒(S0131S)、超氧化物歧化酶(SOD)檢測試劑盒(S0060)購自Beyotime生物,大鼠TNF-α(ab100785)及IL-1β(ab100768)檢測試劑盒、Nrf2一抗(ab31163)、HO-1一抗(ab13243)、Alexa Fluor?488標記山羊抗兔IgG(ab150081)購自Abcam公司,兔抗鼠酪氨酸羥化酶(TH)(K26528)、RAGE(K23958)、p-NF-κB p65(K21411)、NF-κB p65(YT746)抗體購自北京百奧萊博。
1.3 研究方法
1.3.1 PD模型制備及實驗分組 根據參考文獻[9]制備PD大鼠模型,給予模型組大鼠腹腔注射30 mg/kg的MPTP,對照組注射等量生理鹽水,給藥7 d后造模完成。按照隨機數字表法將大鼠分為對照組(Control組)、模型組(PD組)、丙泊酚低劑量治療組(Propofol-L組)、丙泊酚高劑量治療組(Propofol-H組),每組15只大鼠。Propofol-L組與Propofol-H組分別使用25、50 mg/kg丙泊酚腹腔注射給藥[7],Control組與PD組給予腹腔注射等量的生理鹽水,1次/d,連續7 d。
1.3.2 Morris水迷宮實驗與Y迷宮實驗 Morris水迷宮實驗:水溫控制在22 ℃左右,周圍光線昏暗,第1至5天為訓練期,每天于固定時間將大鼠放入水中,記錄大鼠到達平臺的時間,即為逃避潛伏期,若120 s內未找到平臺,則人為引導其至平臺上停留20 s。第6天是空間探索實驗,移走平臺,讓每只大鼠放入后自由游泳120 s,記錄穿越平臺次數和滯留平臺時間。Y迷宮實驗:Y迷宮有三個等長的木臂構成,各臂之間夾角相等,將大鼠從三臂交叉中心位置放入,記錄大鼠在3個臂中自由活動5 min的自發交替率及進臂次數,自發交替率=總正確交替次數/三個臂的總穿梭次數×100%。
1.3.3 HE染色觀察腦黑質區病理變化 取5只大鼠,斷頭處死后,取腦組織,分離右側黑質,4%多聚甲醛固定,制成石蠟切片后,使用HE染色液染色,顯微鏡下觀察病理學變化。
1.3.4 腦黑質區氧化應激因子、炎癥因子水平檢測 另取5只大鼠,處死取腦組織黑質,一部分制成10%的組織勻漿,離心后取上清,采用試劑盒分別檢測腦黑質區MDA、CAT、SOD及TNF-α、IL-1β水平。另一部分組織-20 ℃凍存,用于Western blot。
1.3.5 免疫熒光染色檢測腦黑質區TH表達 取5只大鼠處死后,取腦黑質區冰凍后切片,加入10%羊血清封閉后,加入TH一抗,4 ℃孵育過夜,Alexa Fluor?488標記的羊抗兔IgG抗體,37 ℃孵育30 min,DAPI復染細胞核,抗熒光淬滅劑封片,熒光顯微鏡觀察并拍照。
1.3.6 Western blot檢測大鼠腦黑質區RAGE、p-NF-κB p65、Nrf2、HO-1蛋白表達 取冰凍的腦組織,提取組織總蛋白,經電泳轉膜、封閉后,加入兔抗鼠RAGE、p-NF-κB p65、Nrf2、HO-1稀釋液,4 ℃孵育過夜,再加二抗稀釋液,ECL試劑盒進行發光顯色,以β-actin為內參,分析蛋白表達。
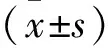
2 結果
2.1 丙泊酚對PD大鼠認知功能障礙的影響 Morris水迷宮實驗結果顯示,與Control組比較,PD組大鼠逃避潛伏期增加,目標象限滯留時間百分比以及穿過目標象限的次數明顯減少(P<0.05);與PD組比較,Propofol-L組及Propofol-H組大鼠逃避潛伏期減少,目標象限滯留時間百分比以及穿過目標象限的次數明顯增加(P<0.05),而4組大鼠游泳速度比較差異無統計學意義(P>0.05),見圖1、表1。Y迷宮實驗結果顯示,與Control組比較,PD組自發交替率減少(P<0.05);與PD組比較,Propofol-L組及Propofol-H組大鼠自發交替率增加,且呈Propofol劑量依賴性,4組之間總進臂次數比較差異無統計學意義(P>0.05)。見表1。

表1 4組大鼠水迷宮與Y迷宮實驗結果比較

圖1 4組大鼠逃避潛伏期
2.2 丙泊酚對PD大鼠腦組織病理變化的影響 Control組神經元形態正常,細胞排列緊密,細胞核居中,無細胞壞死與炎性細胞浸潤;PD組細胞結構模糊,排列散亂,有細胞缺失、壞死;Propofol-L組及Propofol-H組神經元數量相較于PD組有所增加,細胞排列相對整齊,細胞形態趨于正常,且Propofol-H組較Propofol-L組神經元數量增加,細胞損傷改善明顯。見圖2。

圖2 HE染色觀察丙泊酚對PD大鼠腦組織病理變化的影響(400×)
2.3 丙泊酚對PD大鼠腦黑質區TH表達的影響 免疫熒光染色結果顯示,Control組綠色熒光細胞較多,綠色熒光增強,PD組TH陽性細胞減少,綠色熒光減弱,Propofol-L組與Propofol-H組細胞綠色熒光較PD組增強,TH陽性細胞增多,且Propofol-H組高于Propofol-L組,見圖3。與Control組比較,PD組大鼠腦黑質區TH陽性細胞率降低(P<0.05);與PD組比較,Propofol-L組及Propofol-H組大鼠腦黑質區TH陽性細胞率升高,且呈Propofol劑量依賴性(P<0.05)。見圖4。

圖3 免疫熒光染色觀察丙泊酚對PD大鼠腦黑質區TH表達的影響(200×)

圖4 4組大鼠腦黑區TH陽性細胞率
2.4 丙泊酚對PD大鼠腦黑質區MDA、CAT、SOD的影響 與Control組比較,PD組MDA活性顯著增加,CAT、SOD活性顯著降低(P<0.05);與PD組比較,Propofol-L組與Propofol-H組MDA活性顯著降低,CAT、SOD活性顯著升高,且呈Propofol劑量依賴性(P<0.05)。見表2。

表2 丙泊酚對PD大鼠腦黑質區CAT、MDA、SOD的影響
2.5 丙泊酚對PD大鼠腦黑質區TNF-α、IL-1β水平的影響 與Control組比較,PD組大鼠腦黑質區TNF-α、IL-1β水平顯著升高(P<0.05);與PD組比較,Propofol-L組與Propofol-H組大鼠腦黑質區TNF-α、IL-1β水平顯著降低,且呈Propofol劑量依賴性(P<0.05)。見表3。

表3 丙泊酚對PD大鼠腦黑質區TNF-α、IL-1β水平的影響
2.6 丙泊酚對PD大鼠腦黑質區RAGE、p-NF-κB p65、Nrf2、HO-1蛋白表達的影響 與Control組比較,PD組RAGE、p-NF-κB p65表達水平顯著升高,Nrf2、HO-1表達水平顯著降低(P<0.05);與PD組比較,Propofol-L組與Propofol-H組RAGE、p-NF-κB p65表達水平顯著降低,Nrf2、HO-1表達水平顯著升高,且呈Propofol劑量依賴性(P<0.05)。見圖5。

圖5 Western blot檢測大鼠腦黑質區RAGE、p-NF-κB p65、Nrf2、HO-1蛋白表達
3 討論
PD患者發生認知障礙的概率是10%~80%,目前對PD的治療藥物有左旋多巴,多巴胺激動劑等抗震顫麻痹藥,但是這些藥只能緩解癥狀,不能根治PD,且會加劇幻覺,因此尋找有效治療藥物具有重要意義[10-11]。研究顯示,PD的認知障礙與內側黑質的病變密切相關,表現為黑質多巴胺能神經元變性、凋亡[12]。TH是多巴胺合成的限速酶,在PD黑質中顯著減少,與PD的發生發展密切相關,是多巴胺能神經元標志物[13-14]。本研究結果顯示,使用25、50 mg/kg的丙泊酚治療PD大鼠后,腦黑質TH水平升高,表明丙泊酚可有效減少巴胺能神經元丟失,丙泊酚還可改善PD大鼠的認知功能障礙,減輕腦組織病理損傷。宋俊杰等[15]研究顯示,丙泊酚通過抑制α-突觸核蛋白表達保護PD小鼠多巴胺能神經元,本研究與此結果一致,表明丙泊酚對PD大鼠具有神經保護作用。
PD的發生與氧化應激有關,PD患者體內自由基清除功能減弱,黑質神經元凋亡增多[16]。Nrf2是抗氧化轉錄因子,可激活下游HO-1表達,阻止氧化應激,發揮神經保護作用[17-18]。研究顯示,PD腦黑質存在機體氧化(MDA等升高)與抗氧化(CAT、SOD等降低)之間的失衡,激活Nrf2信號通路,可增加腦組織CAT、SOD活性,降低MDA及炎癥因子水平,改善PD大鼠腦組織氧化應激、炎癥損傷狀態[19-20]。本研究結果顯示,使用25、50 mg/kg的丙泊酚治療PD大鼠后,大鼠腦黑質區MDA活性顯著降低,CAT、SOD活性及Nrf2、HO-1蛋白表達水平顯著升高,且呈藥物劑量依賴性,提示丙泊酚可能通過激活Nrf2信號通路發揮抗氧化作用,保護PD大鼠認知障礙與腦損傷。
PD的發生發展與腦組織炎癥反應有關,TNF-α、IL-1β為NF-κB通路的下游因子,在PD患者和動物模型的黑質區均檢測到大量促炎因子的釋放[21]。在MPTP誘導的PD小鼠腦內,存在NF-κB通路活化,抑制TLR4/NF-κB信號通路,可緩解多巴胺能神經元的炎癥損傷[22]。RAGE是一種膜結合受體,其水平升高可致認知能力下降和血腦屏障通透性受損,RAGE與配體結合后可激活NF-κB信號通路,參與神經炎癥、神經變性等中樞神經系統病理過程[23]。研究顯示,姜黃素可通過抑制RAGE/NF-κB通路激活,抑制小膠質細胞反應,減輕魚藤酮誘導的多巴胺能神經細胞損傷[24-25]。本研究顯示,丙泊酚可減輕PD大鼠腦黑質區炎癥損傷,且使用25、50 mg/kg的丙泊酚治療PD大鼠后,RAGE、p-NF-κB p65表達水平顯著降低,且呈劑量依賴性,提示丙泊酚可能通過抑制RAGE/NF-κB信號通路有關。
4 結論
丙泊酚可改善PD大鼠認知障礙,其機制可能與可通過激活Nrf2信號通路與抑制RAGE/NF-κB信號通路有關。

