蛋白酶水解漢麻分離蛋白產物結構及功能特性比較
朱秀清,王源,朱穎*,安月欣,黃雨洋,孫冰玉,夏曉雨,2
1(哈爾濱商業大學 食品工程學院,黑龍江省普通高校食品科學與工程重點實驗室, 黑龍江省谷物食品與谷物資源綜合加工重點實驗室,黑龍江 哈爾濱,150028) 2(黑龍江省農業科學院大豆研究所,黑龍江 哈爾濱,150086)
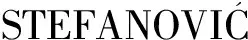
漢麻蛋白作為新興植物蛋白資源之一,漢麻蛋白和多肽的功能特性及生物活性逐漸成為研究熱點,目前關于漢麻蛋白肽抗氧化活性、降血壓活性、降血糖活性、抑菌性、抗神經炎活性等方面已有相關研究[9-11]報道。YIN等[12]發現胰蛋白酶水解漢麻分離蛋白(hemp protein isolate,HPI)后,水解物的溶解度顯著提高,持水性和持油性顯著降低。TANG等[13]研究不同蛋白酶處理不同時間后HPI水解物的DPPH自由基清除能力與Fe2+螯合能力與它們的可溶性肽含量及表面疏水性呈相關性。TEH等[14]探討甲胎蛋白酶、HT蛋白水解物濃縮液、免疫球蛋白G降解酶、獼猴桃蛋白酶和生姜蛋白酶處理HPI后水解物的抗氧化活性及血管緊張素(angiotensin converting enzyme,ACE)抑制活性均有所增加。綜上,針對漢麻蛋白肽的研究主要集中于生物活性方面,而對于不同蛋白酶酶解所得漢麻蛋白水解物的結構、功能特性方面的研究較少。
本文中以HPI為原料,研究不同蛋白酶(木瓜蛋白酶、風味蛋白酶、胃蛋白酶、胰蛋白酶、中性蛋白酶、堿性蛋白酶)的酶解程度、酶解產物結構(二級結構、三級結構、粒徑分布、Zeta電位)、界面性質(泡沫性質、乳化能力)以及抗氧化活性的變化,為HPI及其水解產物在食品領域中的應用提供理論依據。
1 材料與方法
1.1 材料與試劑
漢麻籽,廣西巴馬;木瓜蛋白酶(800 000 U/g)、風味蛋白酶(30 000 U/g)、胃蛋白酶(10 000 U/g)、胰蛋白酶(250 000 U/g)、中性蛋白酶(50 000 U/g)、堿性蛋白酶(200 000 U/g),Solarbio科技有限公司;所有分析用試劑均為國產分析純。
1.2 儀器與設備
BS224S型分析天平,賽多利斯科學有限公司;HH-S4型恒溫水浴鍋,鞏義市予華儀器有限公司;PCE-E3000型恒溫振蕩器,蘇州凱特爾儀器設備有限公司;Marvin 3000型馬爾文激光粒度儀,英國馬爾文儀器有限公司;TG16-WS型離心機,湘儀實驗室儀器開發有限公司;XHF-DY型高速分散機、722E型分光光度計,上海圣科儀器設備有限公司;pH-20型pH計,杭州杰源儀器科技有限公司;Lambda365型紫外光譜儀、Spectrum Two型紅外光譜儀,美國鉑金埃爾默股份有限公司。
1.3 實驗方法
1.3.1 漢麻分離蛋白的制備
漢麻分離蛋白的制備參考朱秀清等[15]的方法。將脫脂漢麻籽與蒸餾水以1∶20(g∶mL)的比例混合,調節pH值為9.0,振蕩浸提3 h后4 000 r/min離心20 min,保留上清液,調節上清液pH值至4.7,靜置2 h 后4 000 r/min離心20 min,收集沉淀,溶于水后調節pH值至7.0,冷凍干燥后得到HPI,保存備用。
1.3.2 漢麻分離蛋白水解物的制備
漢麻分離蛋白水解物(hemp protein hydrolysate,HPH)的制備參照TANG等[13]的方法并稍作修改。配制質量濃度為50 g/L的HPI溶液,在90 ℃下水浴15 min,降溫至反應溫度,按表1中的條件調節pH值、加入蛋白酶反應。反應完成后,沸水浴滅酶10 min,冷卻后8 000 r/min離心10 min,保留上清液,分別制得木瓜蛋白酶水解物(hemp protein hydrolysate-papain,HPH-PA)、風味蛋白酶水解物(hemp protein hydrolysate-flavor,HPH-F)、胃蛋白酶水解物(hemp protein hydrolysate-pepsin,HPH-P)、胰蛋白酶水解物(hemp protein hydrolysate-trypsin,HPH-T)、中性蛋白酶水解物(hemp protein hydrolysate-neutral,HPH-N)、堿性蛋白酶水解物(hemp protein hydrolysate-alkaline,HPH-A)樣品,保存備用。

表1 六種蛋白酶的酶解條件Table 1 Enzymolysis conditions of six kinds of proteases
1.3.3 水解度的測定
采用甲醛滴定法測定水解度(degree of hydrolysis,DH)[16]。取10 mL HPH與60 mL蒸餾水,混勻后用NaOH溶液滴定至pH值為8.2;向溶液中加入10 mL中性甲醛,用NaOH溶液繼續滴定,當pH值為9.2時停止,記錄NaOH消耗的體積為V。空白實驗中,記錄NaOH消耗的體積為V0。水解度的計算如公式(1)所示:
(1)
式中:C為NaOH溶液濃度,mol/L;V為消耗NaOH溶液的體積,mL;V0為空白消耗NaOH溶液體積,mL;M為樣品中總氮質量,g。
1.3.4 可溶性肽含量的測定
采用TCA-雙縮脲法測定水解物的肽含量[17]。取5 mL HPH與5 mL的0.4 mol/L的TCA溶液混合均勻,以4 000 r/min的轉速離心10 min,吸取上清液1 mL與雙縮脲試劑4 mL混合均勻,靜置10 min,測定其在540 nm處的吸光值。依據標準曲線計算TCA-可溶性肽含量。
1.3.5 十二烷基硫酸鈉-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide,SDS-PAGE)凝膠電泳
采用的濃縮膠和分離膠的濃度分別為5%和20%,將樣品與上樣緩沖液以4∶1的比例混合后沸水浴煮沸5 min,每孔上樣量為20 μL。電泳結束后,用染色液染色30 min,然后用脫色液脫色直至條帶清晰無背景色。
1.3.6 粒徑分布、Zeta電位、PDI值的測定
參考AI等[18]的方法用馬爾文激光粒度儀對HPI及6種HPH的粒徑、Zeta電位、PDI(polymer dispersity index)值進行測定。配制樣品質量濃度3 mg/mL的溶液,用0.45 μm濾膜過濾除去不溶物,放入反應皿內對上述指標進行測定。
1.3.7 傅里葉紅外光譜分析
取凍干后的樣品適量,用傅里葉紅外光譜儀進行4 000~400 cm-1波段掃描,每個樣品進行3次平行實驗。
1.3.8 紫外可見光譜分析
取適量樣品配制成質量濃度為2 mg/mL的溶液,測定溶液在190~400 nm紫外吸收光譜。
1.3.9 溶解度的測定
稱取10 mg樣品于10 mL水中,于室溫下攪拌30 min,10 000 r/min離心10 min后采用考馬斯亮藍法測定上清液中蛋白含量。溶解度的計算如公式(2)所示:

(2)
1.3.10 起泡性與泡沫穩定性的測定
取15 mL樣品置于量筒中,記錄此時體積V0,在高速分散器中8 000 r/min處理1 min后立即轉移至量筒中,記錄此時的體積V1及靜置30 min后的體積V2,樣品的起泡性(foaming characteristic,FC)和泡沫穩定性(foaming stability,FS)的計算如公式(3)、公式(4)所示:
(3)
(4)
1.3.11 乳化活性與乳化穩定性的測定
參考WANG等[19]的方法并稍作修改進行樣品的乳化活性及乳化穩定性的測定。樣品與大豆油按體積比3∶1加入到離心管中,在高速分散器中10 000 r/min處理2 min,立即在離心管底部吸取20 μL乳狀液,加入到5 mL 0.1%的SDS溶液中,以0.1%的SDS溶液作為空白樣品,在500 nm的波長下測定其吸光值。樣品乳化活性(emulsifying activity,EAI)的計算如公式(5)所示:
(5)
式中:T為2.303;N為稀釋倍數,250;C為乳化液未形成前蛋白質溶液的質量濃度,g/mL;φ為油相體積分數;A0為0 min時吸光值。
將制成的乳狀液靜置30 min后,以上述同樣方法進行樣品乳化穩定性的測定。樣品乳化穩定性(emulsion stability,ESI)的計算如公式(6)所示:
(6)
式中:A30為30 min時吸光值;t為30 min。
1.4 數據處理與分析
所有實驗重復3次,采用Excel軟件對數據進行統計分析,結果取平均值,采用SPSS 26進行顯著性分析并用Origin 2019軟件進行繪圖。
2 結果與分析
2.1 不同蛋白酶水解HPI水解度、可溶性肽含量對比
由圖1可知,DH及肽含量受蛋白酶類型的影響較大,HPH-A具有最高的DH(24.7±0.46)%,HPH-PA次之,為(24.4±0.34)%;HPH-A的肽含量最高,為(13.43±0.26) mg/mL,HPH-PA的肽含量為(12.96±0.23) mg/mL。由于堿性蛋白酶是一種深度內切酶[20],具有廣泛的特異性,而木瓜蛋白酶可以水解蛋白質或多肽中精氨酸、賴氨酸的羧基端,SHEN等[21]的研究指出HPI中谷氨酸、精氨酸和天冬氨酸含量高,而脫殼后HPI中含有更多的精氨酸、組氨酸,因此,堿性蛋白酶、木瓜蛋白酶可更有效地將HPI分解為可溶性的小分子肽或氨基酸,具有更高的水解度。

圖1 不同蛋白酶水解HPI水解度、可溶性肽含量比較Fig.1 Hydrolysis degree and soluble peptide content of HPI hydrolyzed by different proteases注:不同小寫字母表示差異顯著(P<0.05),下同。
2.2 SDS-PAGE凝膠電泳
為了表征不同蛋白酶處理后的水解物組成,對其進行SDS-PAGE凝膠電泳分析。由圖2可以看出分子質量約為48 kDa的麻仁球蛋白、35 kDa左右的酸性亞基(acidic subunits,AS)、20 kDa左右的堿性亞基(basic subunits,BS)和10~15 kDa的白蛋白為HPI的主要組成部分[21],水解后發現4條蛋白帶的強度變弱或部分消失,并出現分子質量<17 kDa的小分子組分,其中HPH-PA、HPH-F、HPH-P具有更多的小分子肽。胃蛋白酶的水解效果最好,出現的均為小于17 kDa的小分子肽。TANG等[13]的研究結果表明在很低的pH環境下,所有的蛋白質可能被解離,球形結構展開。HPH-A的電泳圖上也并未出現麻仁球蛋白的條帶,證明堿性蛋白酶對麻仁球蛋白具有很好的水解能力。
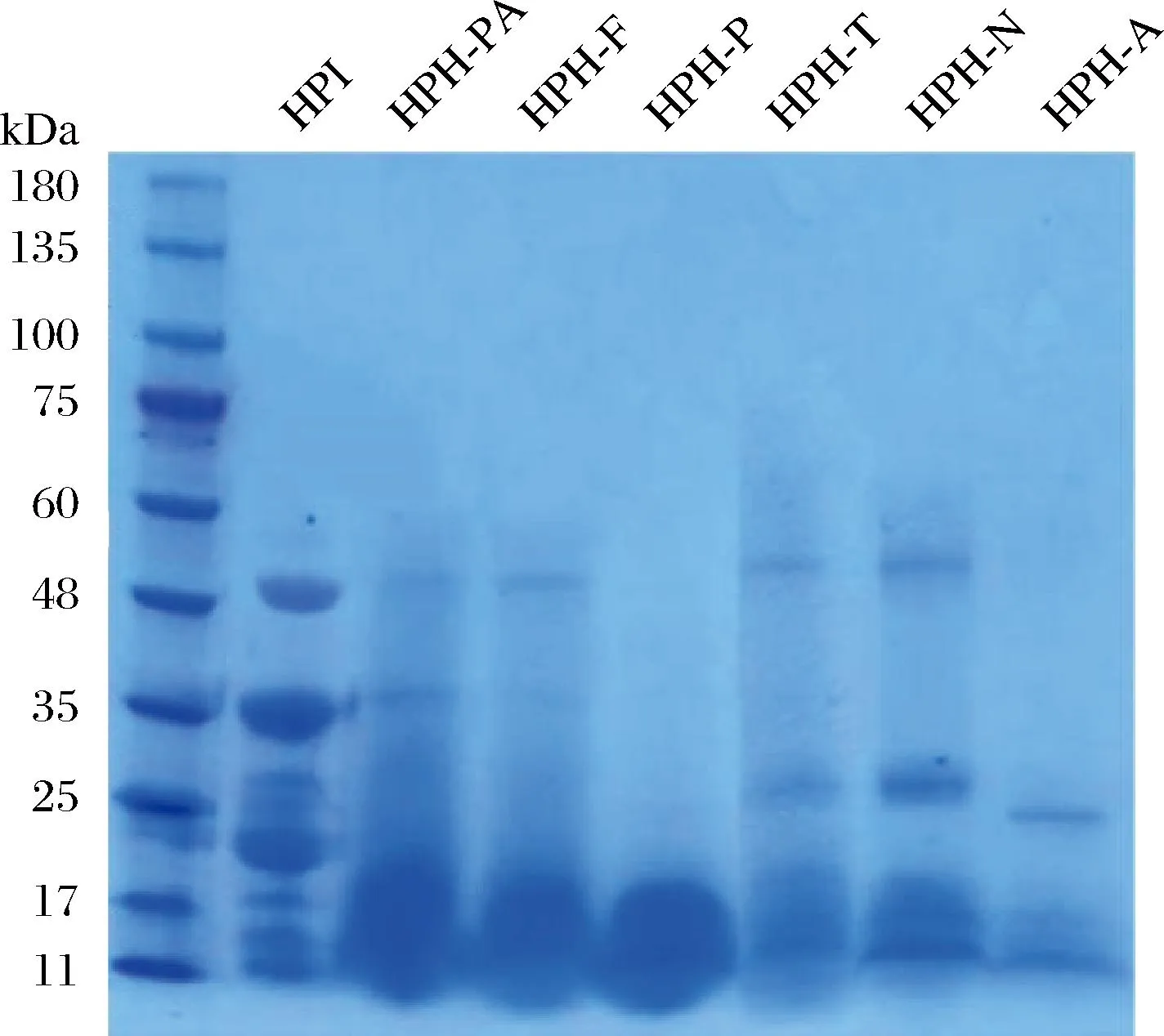
圖2 HPI及不同蛋白酶水解物的電泳圖Fig.2 Electrophoretic map of HPI and different protease hydrolysates
2.3 不同蛋白酶水解HPI粒徑、PDI值對比
圖3-a表明水解對HPI粒徑分布的影響。水解后HPH粒徑體積分布與HPI相比均有所降低,HPH-A的平均粒徑最小,這是由于堿性蛋白酶可以將HPI水解成更多的短肽或氨基酸,這一結果與前文HPH-A具有較高的水解度一致。由圖3-b可以看出,所有水解物的PDI值較HPI均呈現減小的趨勢,可以說明蛋白酶水解提高了水解物的分散性[18],其中HPH-P和HPH-A在水中的分散性低于其他水解物,HPH-N的PDI值最大。這是由于中性蛋白酶的水解位點為亮氨酸、苯丙氨酸、酪氨酸等疏水氨基酸的肽鍵[22],酶水解后會產生具有相同末端的氨基酸或帶有相同電荷的肽段[23],會暴露出更多疏水性氨基酸,導致水解物在水中的分散性弱于其他水解物。
2.4 不同蛋白酶水解HPI Zeta電位值對比
由圖4可知,各水解物的Zeta電位值較HPI有所增加,這是由于水解過程可以暴露出掩埋在蛋白質分子內部的氨基和羧基,使其數量增加[16],從而提高水解物的Zeta電位值。HPH-A、HPH-PA較高的Zeta電位絕對值表明在水解過程中可以產生更多的氨基和羧基,從而增加了HPI的表面電荷;同時,Zeta電位絕對值升高導致分子內和分子間的靜電排斥作用增大,可以促進蛋白質結構的展開,破壞現有的蛋白質聚集體或阻止聚集體的進一步形成,從而提高樣品在溶液中的穩定性。
2.5 不同蛋白酶水解HPI二級結構對比
3 500~3 000 cm-1的特征吸收峰主要與多肽骨架上的氫鍵有關,氫鍵可以維持蛋白質二級結構的穩定性[5],不同蛋白酶水解產物的峰強度和峰寬較HPI降低,說明蛋白酶水解會破壞蛋白質分子間的氫鍵,從而改變蛋白結構的穩定性。由圖5-a可以看出HPI在2 924 cm-1處的峰與不對稱CH2伸展有關,這通常發生在蛋白質的脂肪側鏈中[24],不同HPI水解物的—CH2譜帶均由2 924 cm-1移動到2 932 cm-1,且峰強度明顯減弱。這些結果表明,蛋白酶水解改變了HPI的脂肪側鏈,破壞了HPI的疏水區。
a-不同蛋白酶水解物的粒徑分布;b-不同蛋白酶水解物的PDI值圖3 不同蛋白酶水解HPI粒徑分布及PDI值比較Fig.3 Particle size distribution and PDI value of HPI hydrolyzed by different proteases
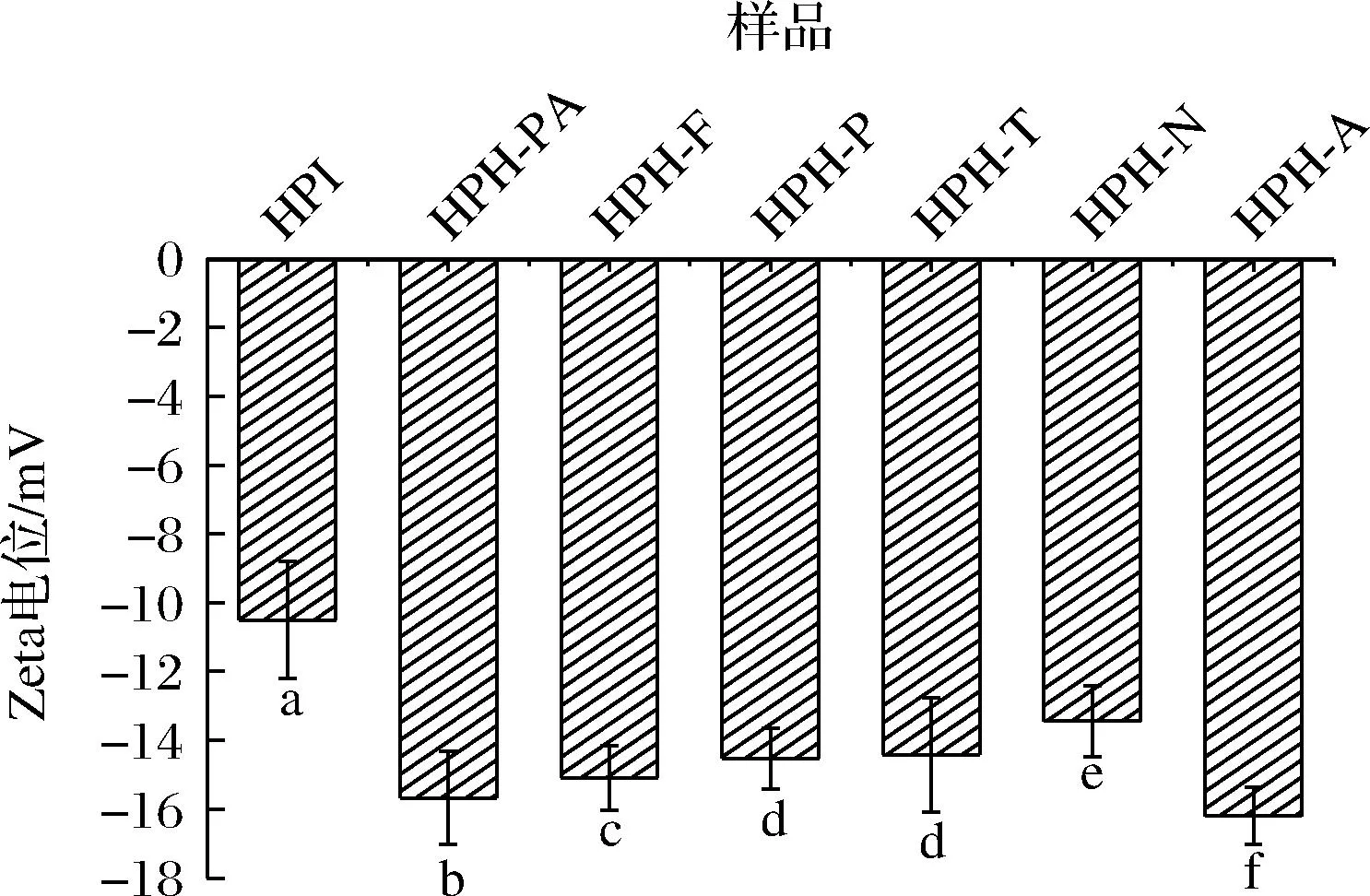
圖4 不同蛋白酶水解HPI Zeta電位值比較Fig.4 Zeta potentials of HPI hydrolyzed by different proteases
由圖5-b可以看出,酶水解對HPI的二級結構有影響,不同蛋白酶水解產物的二級結構不同。與HPI相比,HPH的α-螺旋變化不明顯,β-轉角、無規卷曲比例增加,β-折疊比例降低,表明蛋白酶酶解會使蛋白質的有序結構變得無序,分子結構變得更加松散。劉瑾[25]的研究表明,β-折疊比例的降低說明HPH的疏水性降低,溶解性增加,有利于提高水解物在水中的分散性;水解物的β-轉角含量升高表明它們具有更加靈活的二級結構。總之,酶水解會使蛋白結構變得更加松散,具有更靈活的二級結構,提高蛋白溶解度。

a-不同蛋白酶水解HPI的傅里葉變換紅外光譜; b-不同蛋白酶水解HPI的二級結構組成圖5 不同蛋白酶水解HPI傅里葉變換紅外光譜及 二級結構組成比較Fig.5 Fourier transform infrared spectroscopy and secondary structure of HPI hydrolyzed by different proteases
2.6 不同蛋白酶水解HPI三級結構對比
由圖6可以看出,所有HPH熒光發射光譜的λmax出現在272~274 nm,較HPI發生了紅移,同時,這些水解物的最大熒光強度也有所增加。對紫外吸收光譜進行二階導數得到的光譜可以用于分析紫外區域復雜的蛋白譜圖遷移信息,經計算得到HPI、HPH-PA、HPH-F、HPH-P、HPH-T、HPH-N、HPH-A的r值分別為1.354、2.295、1.915、1.953、1.991、2.151、2.217。所有HPH的r值增大,表明蛋白酶水解打開了HPI的三級結構,暴露了芳香氨基酸及內部的親水基團,導致其紅移[26]。
2.7 不同蛋白酶水解HPI溶解度對比
HPI在中性條件下溶解性差,蛋白酶水解會破壞其分子空間結構,一些包埋在蛋白質分子內部的親水性區域暴露出來,提高漢麻蛋白的溶解性。由圖7可知,HPH-P的溶解度最好,這可能是由于胃蛋白酶水解能進一步將原本因疏水而易絮凝沉淀的蛋白分解成更小分子肽段,使其溶解于水中,進而提高了水解產物的溶解性。同時,多肽鏈分子質量減小、肽段增多,增大了親水性基團與水的接觸,從而達到提高溶解度的目的,這也與研究發現蛋白酶水解后金蘋果螺水解物的溶解度有所提高的趨勢一致[27]。
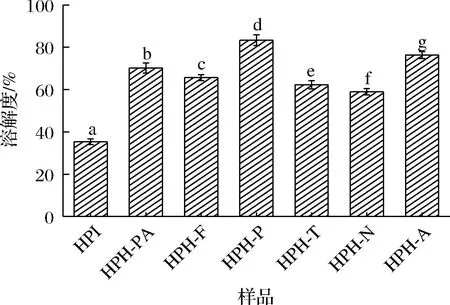
圖7 不同蛋白酶水解HPI溶解度比較Fig.7 Solubility of HPI hydrolyzed by different proteases
2.8 不同蛋白酶水解HPI界面性質對比
由圖8-a可知,蛋白酶處理可以提高HPI的起泡性,這可能是由于小分子肽能夠降低溶液黏度與表面張力,更好地增加蛋白質表面凈電荷數目,增加多肽鏈的交聯和片層的黏度,從而提高了起泡性。其中,HPH-PA、HPH-A的FC較高,這可能是由于水解物表面帶有更多的電荷所導致的,這也與前文Zeta電位的結論一致。蛋白酶處理后HPI的泡沫穩定性有所提升,這也與PUTRA等[27]指出的低分子質量肽的數量越多,水解物的起泡穩定性越好一致。
由圖8-b可以看出,蛋白酶處理后HPH的乳化活性及乳化穩定性較HPI均有所降低。水解過程中蛋白質分子部分展開,更多的親水基團暴露出來,使蛋白質在油-水界面重排,改善了疏水-親水平衡,從而降低乳液的乳化活性,而中性蛋白酶特定的水解位點使水解物具有更多的疏水基團,從而具有相對好的乳化能力。蛋白酶水解使HPI分子肽鏈逐漸縮短,產生的小肽失去了與水和非水相相互作用的能力,難以形成良好的界面膜,不能有效地防止油滴的聚集。有研究表明較高的表面疏水性和較大的多肽顆粒有助于提高蛋白質水解物的乳化能力[28],因此水解后小分子肽含量的增加會導致水解物乳化性變差。

a-不同蛋白酶水解HPI起泡能力比較; b-不同蛋白酶水解HPI乳化能力比較圖8 不同蛋白酶水解HPI界面性質比較Fig.8 Interface property of HPI hydrolyzed by different proteases
3 結論與討論
HPI在6種蛋白酶(木瓜蛋白酶、風味蛋白酶、胃蛋白酶、胰蛋白酶、中性蛋白酶、堿性蛋白酶)作用下進行水解,可以顯著改善HPI的結構及理化性質。不同蛋白酶水解物結構和性質差異較大,這種差異可歸因于單個酶的切割模式,水解物的功能特性更多依賴于蛋白酶的類型而不是水解度。水解會產生更多的小分子肽,使蛋白質的有序結構變得無序,使內部的親水基團暴露出來,分散性提高。其中HPH-A具有良好的水解度、肽含量,HPH-N的乳化性最好,HPH-PA的泡沫性質最好,HPH-P的溶解度最好。漢麻分離蛋白被不同蛋白酶水解后結構及功能特性的變化,為后續研究漢麻蛋白及其水解物的在食品中的應用及其生物活性奠定了理論基礎。

