添加非肉蛋白對肌原纖維蛋白性質及乳化特性的影響
黃春陽,馬晶晶,楊靜,李超,3,徐為民,王道營,鄒燁*,羅章*
1(西藏農牧學院 食品科學學院,西藏 林芝,860000)2(江蘇省農業科學院農產品加工研究所,江蘇 南京,210014) 3(南京雨潤食品股份有限公司,江蘇 南京,210000)
隨著全球人口的增長,糧食安全已經成為不容忽視的挑戰。肉蛋白的攝入繼續增加,會加劇環境污染和健康相關問題。并且在肉制品的加工和貯藏過程中,肌原纖維蛋白(myofibrillar protein,MP)容易受到外界環境影響,如冷凍、加熱等,在這些外部條件的影響下,MP的溶解度、乳化特性減弱,肉制品的品質也會受到影響[1]。根據肉類蛋白的溶解性進行分類,可大致分為肌漿蛋白、MP和肌質蛋白三大類[2]。MP主要存在于動物肌肉中,由肌球蛋白、肌動蛋白、原肌球蛋白等蛋白構成。
有研究認為,在肉制品生產過程中,MP有一部分將被用于脂肪的乳化以減少脂肪和水分的流失,這就造成了MP的不足,以及后續加工形成MP網絡結構的不穩定性。MP的乳化性會影響肉制品的質構、保水性等,對加工過程中水分和油脂的保持起重要作用。研究表明,在肉制品加工中,添加非肉蛋白一方面在降低成本的同時能保證產品質量,提高經濟效益,另一方面添加非肉蛋白可以改變肉制品中MP的乳化性,肉制品的品質也會受到影響[3]。因此,本研究以豬肉MP為研究對象,分別添加不同種類的非肉蛋白,研究非肉蛋白對MP乳化性、流變特性以及熱力學特性的影響,旨在為非肉蛋白改善肉制品品質提供理論指導。
1 材料與方法
1.1 材料與試劑
純種丹麥系長白豬里脊肉(宰后48 h,豬齡6個月)與豬肥膘,南京孝陵衛菜市場;血球蛋白(spray-dried blood cells,SBC)、大豆分離蛋白(soybean protein isolate,SPI)、蛋清蛋白(egg white protein,EWP)、豬血漿蛋白(porcine plasma protein,PPP),秦皇島金海食品有限公司;其余各試劑均為分析純,南京建成生物工程研究所有限公司;豬肉剔除表面結締組織和筋膜后待用。
1.2 儀器與設備
Direct-Q3uv超純水機,美國Millipore公司;FL-4600熒光分光光度計,日本日立高新技術公司;UV-6100紫外分光光度計,上海美普達儀器有限公司;T-25數顯勻漿機,德國IKA公司;ZEN3600納米激光粒度儀,英國馬爾文儀器公司;Q20差示掃描量熱儀,美國TA儀器公司;UncenMR臺式冷凍離心機,英國Hero Lab公司;MCR02流變儀,德國安東帕公司。
1.3 實驗方法
1.3.1 肌原纖維蛋白的提取
參考ZHOU等[4]的方法,稱取10 g生肉,剁成肉泥,添加4倍體積預冷的提取緩沖溶液A(0.1 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L EGTA,6.1 mmol/L Na2HPO4·12H2O,3.9 mmol/L NaH2PO4·2H2O,pH 7.0),在冰浴條件下10 000 r/min勻漿60 s,勻漿過后離心(4 ℃、2 000×g、15 min),收集沉淀,重復2次。將沉淀用8倍體積、pH值為6.25的緩沖溶液B(0.1 mol/L NaCl,1 mmol/L NaN3)冰浴勻漿后離心(條件同上),取沉淀重復該操作2次,最后一次離心前需對均質液進行過濾除去雜質。上述獲得的沉淀溶于緩沖溶液C(0.6 mol/L NaCl,15 mmol/L PIPES,pH值6.25),雙縮脲法測定其蛋白濃度[5],以牛血清白蛋白作為標準蛋白。
1.3.2 MP-非肉蛋白混合體系的制備
用緩沖液C將MP溶液質量濃度調整為40 mg/mL,分別加入質量分數為4%的非肉蛋白,對照組不添加非肉蛋白。使用高速勻漿機在冰浴條件下均質3次(10 000 r/min),每次20 s,后置冷凍離心機中低速離心5 min(500 r/min),去除蛋白溶液中的氣泡,貯存在0~4 ℃環境中。
1.3.3 復合蛋白組分分析
參考YOUSSEF等[6]的方法,使用12%(體積分數)分離凝膠和5%(體積分數)濃縮凝膠,上樣量為20 μL。使用Coomassie Brilliant Blue G-250對凝膠進行染色,通過脫色液(質量分數為10%的醋酸,質量分數為40%的乙醇)對凝膠進行脫色直到背景清晰。圖像采用Quantity One軟件進行掃描和分析。
1.3.4 復合蛋白熒光光譜的測定
調節蛋白質量濃度為0.5 mg/mL,內源性熒光光譜參數設定:激發波長設定為280 nm,光譜掃描范圍設定為300~500 nm,狹縫寬度設定為5.0 nm,掃描5次,掃描速率設定為1 200 nm/min,將緩沖液C設為空白對照組。
1.3.5 復合蛋白粒徑的測定
參照HU等[7]的方法并作適當修改。向不同非肉蛋白處理的蛋白復合液中添加緩沖液C,使最終蛋白液質量濃度為0.5 mg/mL,分散介質的折射率設定為1.361,蛋白質的折射率為1.472。連續檢驗3次后進行數據采集,采集3次。
1.3.6 復合蛋白靜態流變的測定
參考GUO等[8]的實驗方法并進行修改,使用錐形傳感器(間隙0.105 mm,C50~1,直徑為35 mm,角度2°)和測量板蓋(MPC35,222-1549)進行剪切應力/剪切速率旋轉斜坡測試。在25 ℃條件下,待測樣品放于流變儀放置板平衡10 min。剪切速率設定為1 s~500 s~1 s,測量不同處理下MP溶液的流變性能,測定3次。曲線上行部分為剪切速率從0.1 s~1 s增大到500 s~1 s,曲線下行部分為500 s~1 s降低到0.1 s~1 s。將上行曲線和下行曲線結合進行判斷蛋白溶液觸變性的依據。
1.3.7 復合蛋白變性溫度的測定
取復合蛋白的凍干樣品0.5 g至干凈的坩堝內并密封。差示掃描量熱儀主要參數設定,溫度設定:20~80 ℃,升溫速率:10 ℃/min,測得最大變性溫度,以空坩堝為空白對照。
1.3.8 復合蛋白表面疏水性的測定
參照樓宵瑋等[9]的實驗方法,樣品制備,不同處理下的復合蛋白溶液,取1 mL質量濃度為5 mg/mL的MP溶液與溴酚藍溶液(取0.2 mL,1 mg/mL)混勻,在25 ℃下振蕩反應10 min,隨后離心(4 ℃,5 000 r/min,10 min),取上清液,稀釋10倍,放于595 nm波長處,測定其吸光值,用溴酚藍結合量反應蛋白質表面疏水性能,以緩沖液C作為空白對照。表面疏水性按公式(1)計算得到:
(1)
式中:A0,空白對照吸光度;A1,樣品吸光度。
1.3.9 復合蛋白總巰基的測定
參考GAO等[10]的實驗方法,用緩沖液C配制5 mg/mL的混合蛋白溶液。首先向0.5 mL蛋白質溶液中添加5.0 mL 0.2 mol/L Tris-HCl緩沖液(含有8 mol/L尿素、10 mmol/L EDTA和2% SDS,pH值8.0),然后將混合物與100 μL Ellman試劑混合,在40 ℃下靜置25 min。于412 nm處測定其吸光度值,總巰基的含量利用分子吸光系數13 600 L/(mol·cm)計算,如公式(2)所示:
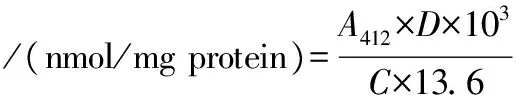
(2)
式中:A412表示樣品溶液在412 nm處的吸光值;D為稀釋倍數;C為蛋白樣品的質量濃度(mg/mL)。
1.3.10 乳化活性及乳化穩定性的測定
MP的乳化活性(emulsifying activity index,EAI)和乳化穩定性(emulsifying stability index,ESI)的測定參考SHEN等[11]所描述的方法并稍加修改。將10 mg/mL的MP溶液與大豆油4∶1(g∶mL)在一個直徑40 mm的長玻璃筒內混合,利用碎冰對玻璃筒進行降溫,用Ultraturrax T25高速分散器均質2次(10 000 r/min),每次均質30 s,間隔30 s,得到MP乳液。然后,迅速在玻璃筒底部取0.05 mL的新鮮乳液加入到5 mL的SDS溶液(20 mmol/L Na2HPO4/NaH2PO4,0.6 mol/L NaCl,pH值7.0)中,旋渦震蕩30 s。讀取500 nm處的吸光值A。乳化活性的計算如公式(3)所示:
(3)
式中:A為500 nm處測定的吸光值;N為樣品稀釋倍數;c為測定復合蛋白液濃度,g/mL;Φ為乳液中大豆油的體積分數,%。
樣品處理10 min后,測定玻璃筒底部的乳液在500 nm處的吸光值A10。乳化穩定性的計算如公式(4)所示:
(4)
式中:t為時間間隔,10 min;A10為10 min后500 nm處的吸光度值。
1.4 數據處理
采用SPSS 24.0軟件(IBM公司)進行方差分析,應用Origin 8.5軟件(Origin Lab公司)繪制圖表,數據以平均值±標準差表示,采用Tukey檢驗用于多重比較,P<0.05表示差異顯著。
2 結果與分析
2.1 復合蛋白組分分析
SDS-PAGE是近些年來用于分離蛋白質及其組分的主要方法,根據不同分子質量的情況,可推測出在凝膠形成過程中各組分所起到的作用。MP分子質量分別為:肌球蛋白重鏈(myosin heavy chain,MHC)約為200~220 kDa,原肌球蛋白約為38 kDa[12]。肌球蛋白是肉制品維持良好加工特性(乳化性、凝膠性、保水性和質構特性等)的重要保障[13]。肌球蛋白的亞基結合成親水螺旋桿(尾部)和疏水球形頭部。從圖1可以看出,SBC和PPP組樣品中肌球蛋白重鏈的條帶強度增強明顯,可能是非肉蛋白與肉蛋白交聯導致MHC含量提高[14]。SPI和EWP添加組肌球蛋白重鏈含量變化不明顯,說明非肉蛋白僅有少部分交聯。添加非肉蛋白后原肌球蛋白含量也均有增多,說明非肉蛋白可以引起活性氨基酸殘基及蛋白質構象發生變化,促進后續加工過程中MP的凝膠化作用[15]。
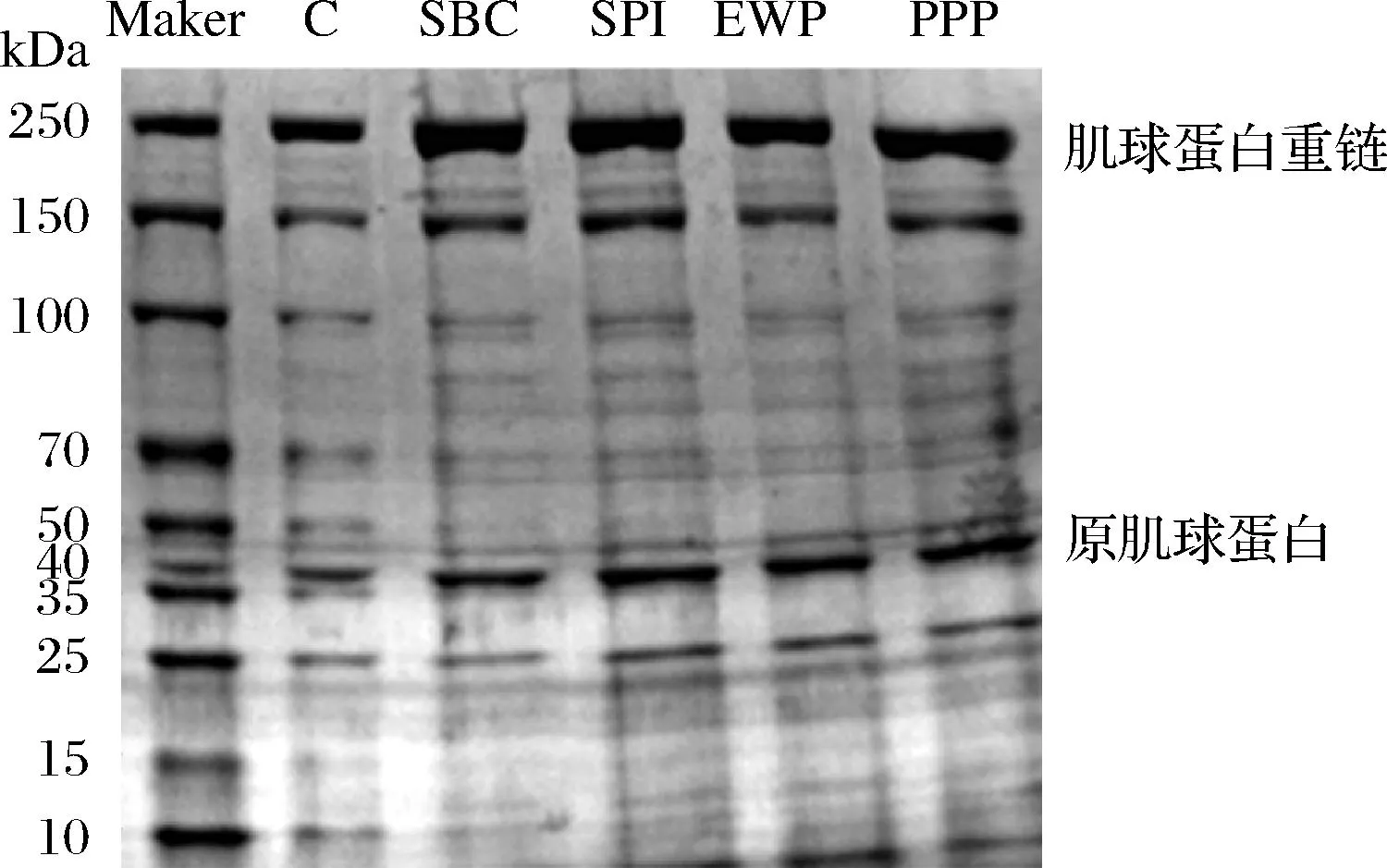
圖1 不同非肉蛋白處理對MP組分的影響Fig.1 Effect of different non-meat protein treatments on MP fractions
2.2 熒光光譜分析
熒光光譜可以測定蛋白質中能夠產生熒光的氨基酸殘基含量,從而判斷蛋白質構象的變化趨勢。由圖2可知,在330~340 nm處的熒光強度最高,EWP和PPP添加組熒光強度顯著提高,原因是分子間作用力遭到破壞,暴露出色氨酸殘基,從而使熒光強度上升。SBC添加組隨熒光強度顯著降低,可能是SBC促進了MP結構展開[16]。SPI添加幾乎沒有改變MP熒光強度,所有非肉蛋白處理最大發射波長均略微紅移,這可能是由于蛋白質分子間作用力發生了熒光猝滅作用[17]。通過測量色氨酸的熒光猝滅作用也可對疏水基團暴露進行經驗評估[18],構象轉變導致色氨酸殘基暴露從而影響色氨酸的熒光發射[19]。結果表明添加不同非肉蛋白可以改變MP分子的高級構象[20]。
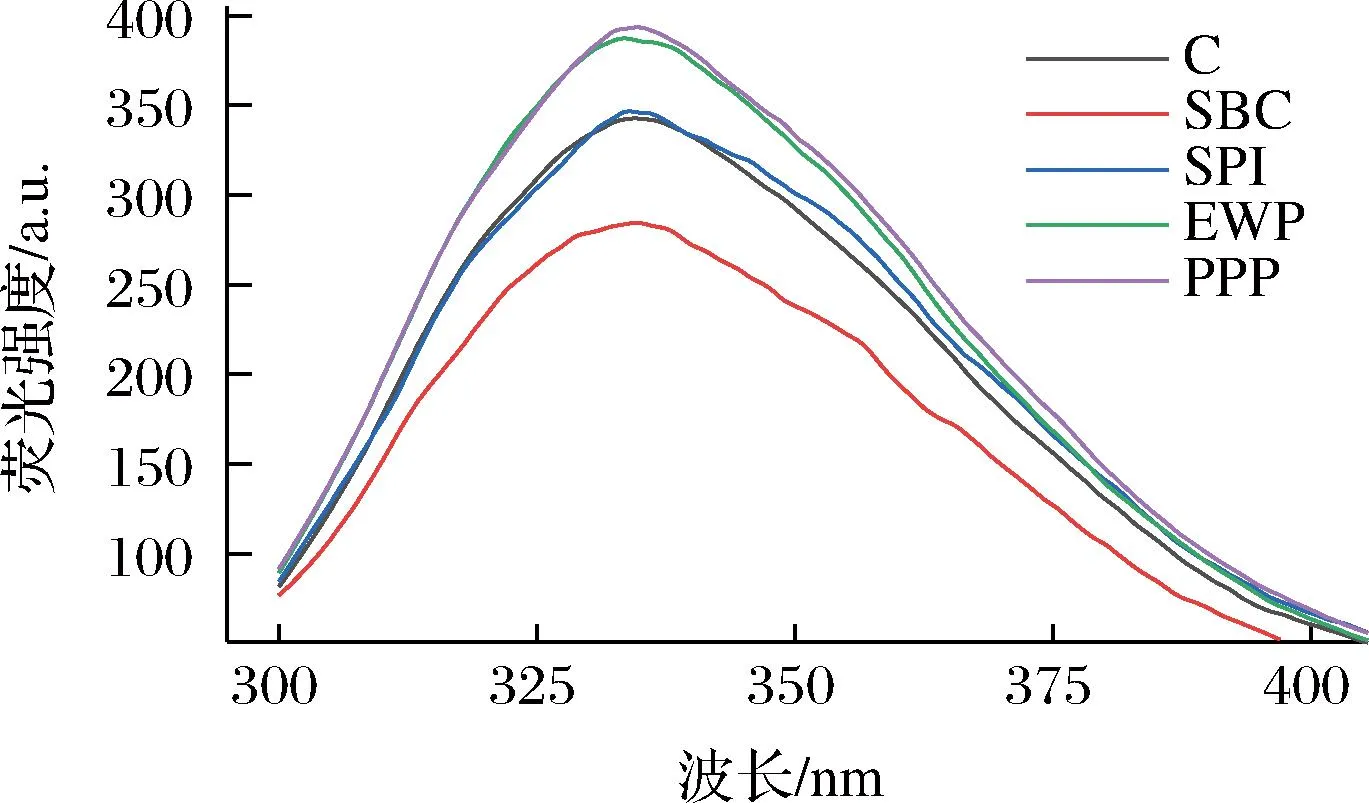
圖2 不同非肉蛋白處理對MP熒光光譜的影響Fig.2 Effect of different non-meat protein treatments on MP fluorescence spectra
2.3 非肉蛋白添加對蛋白粒徑的影響
蛋白微觀聚集狀態和其相互之間的靜電效應決定了蛋白質顆粒大小的變化。如圖3所示,非肉蛋白處理組粒徑均顯著大于對照組,這可能是由于離子鍵作用增強,使靜電斥力降低,蛋白分子間相互靠近,從而形成更大粒徑。與對照組相比,SBC、SPI、EWP、PPP組平均粒徑分別增大74.10%、72.02%、59.58%、111.19%,由于蛋白結構的展開,促進了蛋白之間的聚集,導致其分子粒徑增大[16]。其中PPP粒徑增加最顯著,這能在一定程度上解釋PPP與MP相互作用形成聚集體。非肉蛋白引起粒徑增大也可能是由于靜電相互作用,或者分子內/間的交聯等所導致的蛋白質分子聚集[21]。
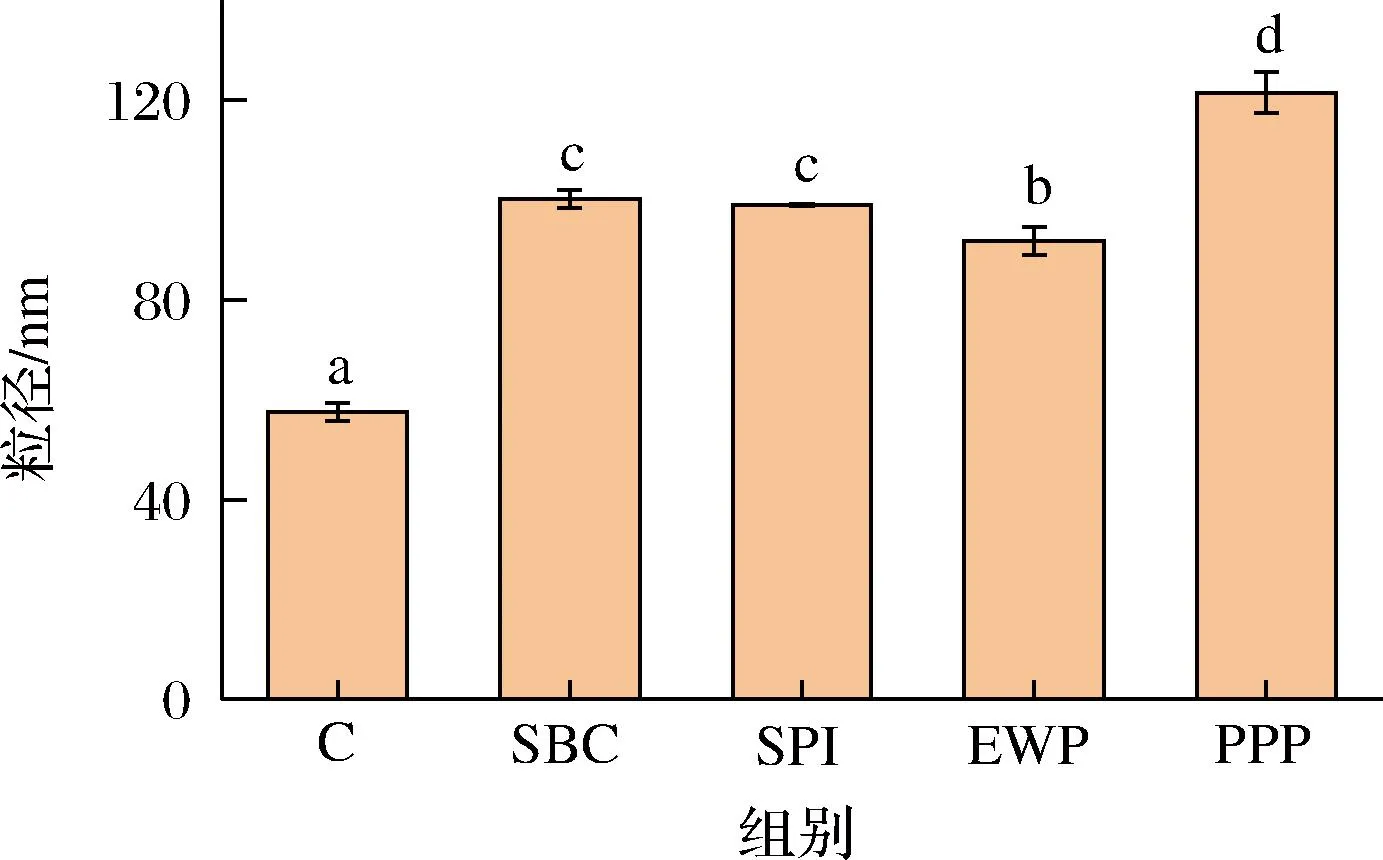
圖3 不同非肉蛋白添加對肌原纖維蛋白平均粒徑的影響Fig.3 Effect of different non-meat protein additions on mean size of myofibrillar proteins注:不同小寫字母表示差異顯著(P<0.05)(下同)。
2.4 非肉蛋白添加對靜態流變的影響
在食品工業中,靜態流變一般用于大分子溶液在外力作用下運動狀態的表征。不同種類非肉蛋白對MP溶液表觀黏度的影響曲線如圖4所示,實驗中,增加剪切應力,表觀黏度都呈現下降趨勢。這是因為蛋白分子間的次級鍵被破壞,即使在剪切速率非常低的條件下,表觀黏度也會急劇降低[22]。當剪切應力達到一定值后,表觀黏度會呈現穩定狀態,并不會因為剪切速度的增加而改變。相比于對照組,添加非肉蛋白后MP的表觀黏度均顯著提高,表明非肉蛋白使MP的抗剪切能力和剪切稀化程度得到增強,其中添加了SBC和PPP組相比于其他最為顯著,由于SBC與MP交聯最為充分,液體流動方向運動的阻礙液隨之增加。PPP的溶解度較高,在處理過程中能夠和更多的蛋白分子結合,蛋白分子間交聯纏結現象明顯,更易形成聚集體,使混合體系的黏度高于其他組,添加SPI的表觀黏度也有所提高。在中性條件下EWP帶有負電荷,存在大量排斥力,不利于蛋白質相互作用發展,因此混合蛋白體系黏度較其他3種非肉蛋白低。
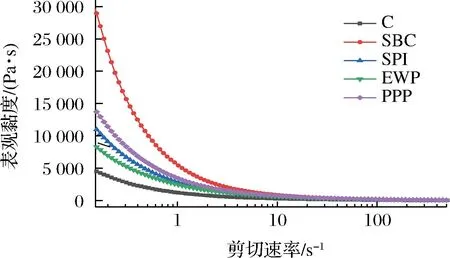
圖4 非肉蛋白添加對MP溶液黏度的影響Fig.4 Effect of non-meat protein addition on the viscosity of MP solutions
如圖5所示,在不同處理條件下,在剪切應力與剪切速率之間的流動曲線形成了滯后環。在剪切應力逐漸增強條件下,蛋白溶液體系內部結構被破壞,減小剪切應力,蛋白溶液體系結構要恢復至初始水平,由于蛋白溶液恢復速率遠低于被破壞速率,就會產生滯后環。滯后環面積大小通常與示樣品的觸變性正相關,結構被破壞后恢復速率越慢[23-24]。EWP和PPP添加組觸變環面積增加最顯著,原因是蛋白混合體系交聯作用相對復雜,分子間氫鍵作用由于受到剪切力作用,被破壞程度相對較大,導致其結構不易恢復,滯后環面積增大。SPI本身結構相對穩定,所以SPI相對于其他3種非肉蛋白添加組觸變環面積小。
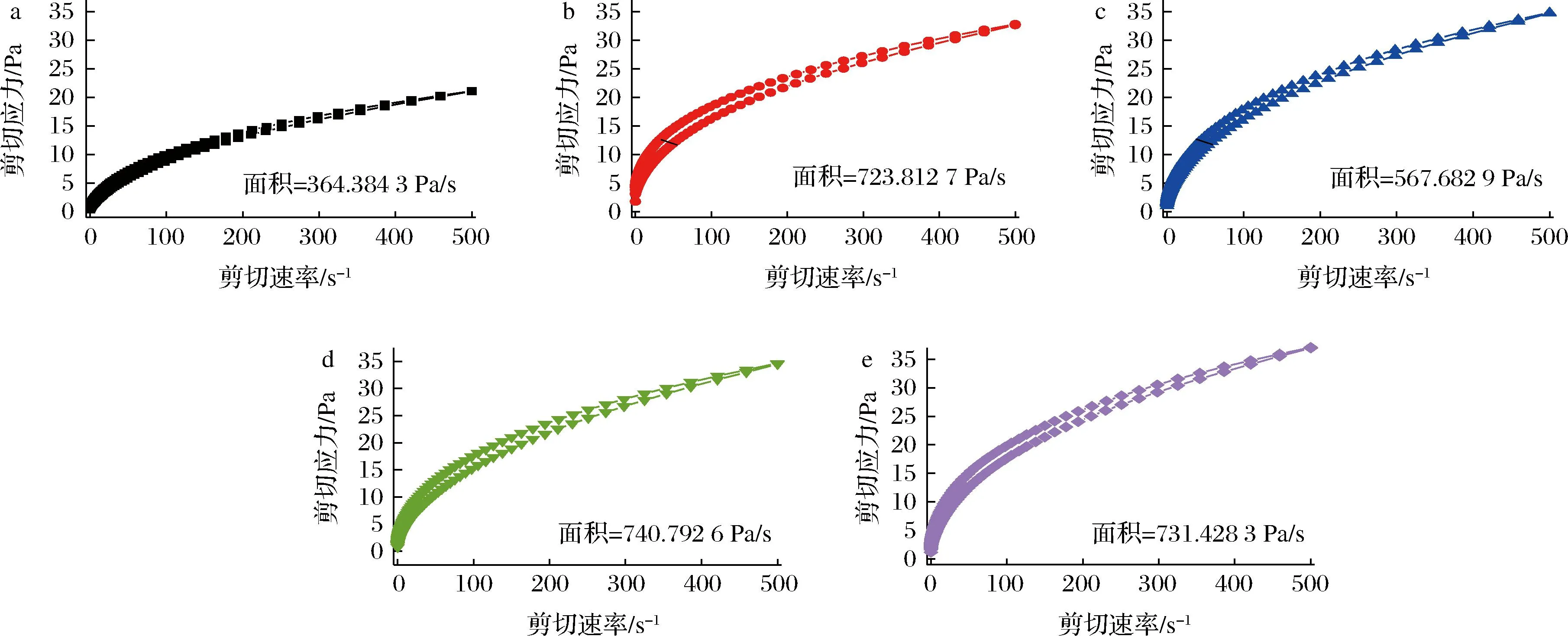
a-C;b-SBC;c-SPI;d-EWP;e-PPP圖5 混合蛋白體系的觸變性Fig.5 Thixotropy of mixed protein systems
2.5 非肉蛋白添加對蛋白熱穩定性的影響
差示掃描量熱法(differential scanning calorimetry,DSC)表明蛋白質結構破壞過程中熱焓值變化趨勢。非肉蛋白對MP熱穩定性的影響見圖6和表1。不同非肉蛋白處理的都只有一個特征峰,并且發現除SPI添加組,其他非肉蛋白處理均可以降低熱變性溫度。與不添加非肉蛋白組相比,添加SPI峰值溫度下降了0.28 ℃,因為SPI分子對溫度更加敏感。各蛋白復合MP的變性溫度與對照組相比,EWP和SBC復合的MP變性溫度分別位移至59.89、59.82 ℃。PPP提高MP熱穩定性的效果最明顯,綜合本文其他指標分析得出PPP與MP交聯最好,可在一定程度上緩解高溫對蛋白結構的破壞。蛋白質熱穩定性的提高,可能是由于非肉蛋白的參與,增強了蛋白質之間的相互作用。
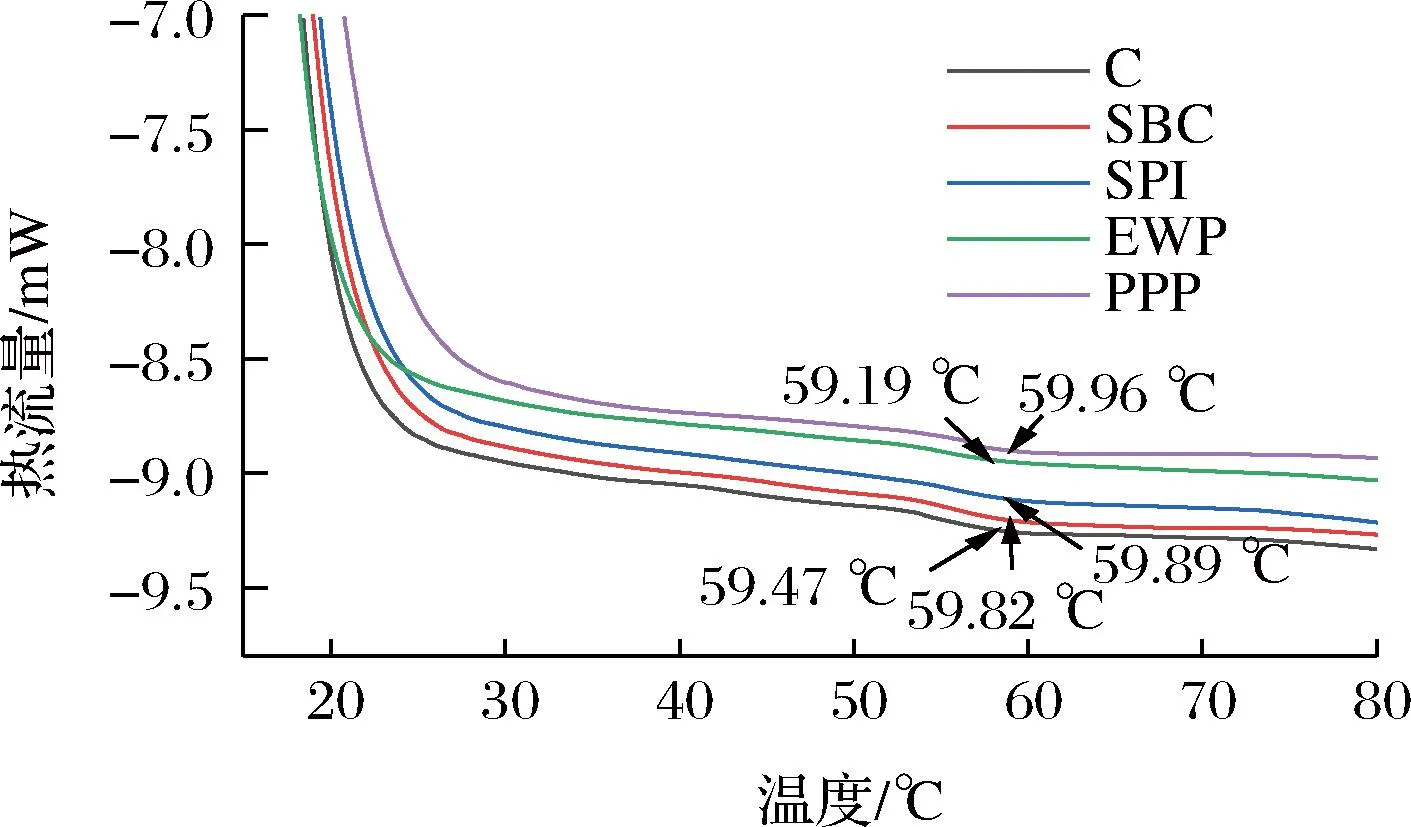
圖6 不同非肉蛋白處理對MP熱穩定性的影響Fig.6 Effect of different non-meat protein treatments on thermal stability of MP
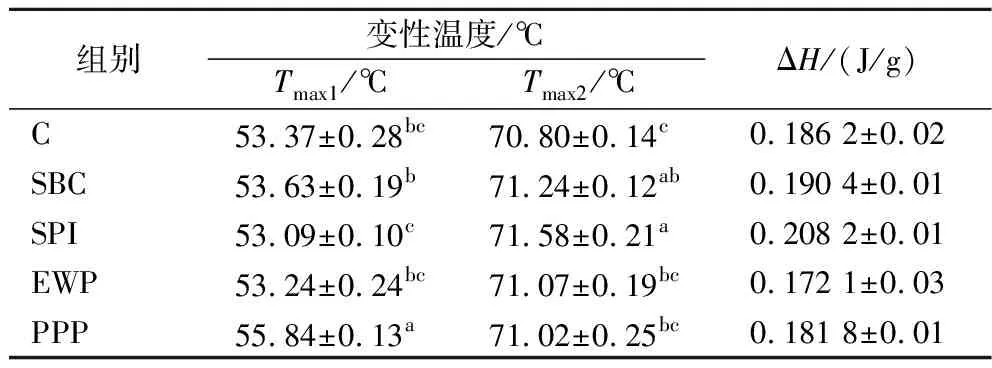
表1 非肉蛋白對MP的起始熱變性溫度及焓值(ΔH)的影響Table 1 Effects of non-meat protein on the initial thermal denaturation temperature and enthalpy value (ΔH) of MP
2.6 非肉蛋白添加對肌原纖維蛋白疏水性的影響
蛋白疏水性是評定蛋白質暴露程度的一項重要指標,蛋白質都含有非極性氨基酸側鏈和極性氨基酸側鏈,它們分別分布在蛋白質分子的內部的疏水環境和外部的親水環境中,因此蛋白質具有很強的兩親性。有研究表明,表面疏水性越強的蛋白質,其水溶液的溶解度越低[25-26]。疏水作用通過共價鍵的方式存在于配位體之間,是維持蛋白構象穩定性和功能性的重要因素。如圖7所示,與對照組相比,除EWP外其他復合凝膠疏水性均有所提高,其中SPI組和PPP組顯著提高。由于蛋白分子間的相互交聯作用,使其內部苯丙氨酸殘基、色氨酸等疏水性氨基酸殘基暴露,疏水性位點增多。另外SPI中的大豆球蛋白堿性多肽間具有疏水相互作用。SBC添加對混合蛋白溶液疏水性影響不顯著,EWP添加使混合蛋白溶液疏水性顯著降低可能是由于蛋白相互作用導致MP構象變化,具有親水性的肌球蛋白頭部暴露出來[19]。綜上,蛋白質顆粒之間疏水相互作用是肌原纖維蛋白顆粒纖維狀結構形的主要驅動力。此外本研究還發現,乳化能力與疏水性顯著性相關。
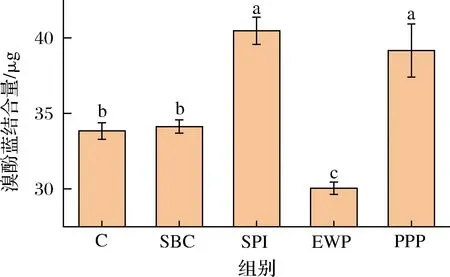
圖7 不同非肉蛋白處理對表面疏水性的影響Fig.7 Effect of different non-meat protein treatments on surface hydrophobicity
2.7 總巰基
MP主要組成成分肌球蛋白和肌動蛋白中均含有巰基且不含二硫鍵,其中肌球蛋白中巰基含量較高[27],巰基不穩定,易遭受羥自由基攻擊,易形成二硫鍵使蛋白質發生交聯聚合反應。如圖8所示,(P<0.05)。未經過非肉蛋白處理的肌原纖維蛋白巰基含量為63.22 mmol/mg蛋白,添加PPP后含量上升至66.49 mmol/mg蛋白,上升了5.17%。根據上文疏水性分析結果可知,PPP使得MP疏水性增加,導致其不易接觸溶液中的羥自由基從而減少了巰基向二硫鍵的轉化。相較于對照組,SBC添加組總巰基含量顯著下降,表明添加SBC使MP巰基被氧化生成二硫鍵,這是MP氧化聚集的主要途徑。EWP含有巰基,所以添加EWP可一定程度上提高混合蛋白溶液中總巰基含量。此外SPI巰基含量在一定程度上抑制了巰基的損失,但效果并不顯著(P>0.05)。
2.8 乳化活性及乳化穩定性的測定
乳化肉制品的質量和口感受肉中蛋白質的乳化性質影響。由圖9可知,添加非肉蛋白的EAI均顯著高于對照組,表明乳化能力和蛋白分子的數量呈現顯著正相關性[28]。蛋白質間的相互作用能夠影響其乳化性,PPP組的溶解度較高,能參與乳化的蛋白分子數量也較多,導致其乳化能力也高于其他組。SBC添加組乳化活性顯著提高,可能是由于添加了SBC后,在脂肪滴表面形成了蛋白膜,有效降低了溶液體系的表面張力。MP中的肌球蛋白和肌動球蛋白被證明具有良好的乳化能力,可以維持乳液的穩定性[29-30]。SPI和EWP添加組EAI提高主要與肌球蛋白和肌動球蛋白增多有關,與上文蛋白組分分析結果一致。
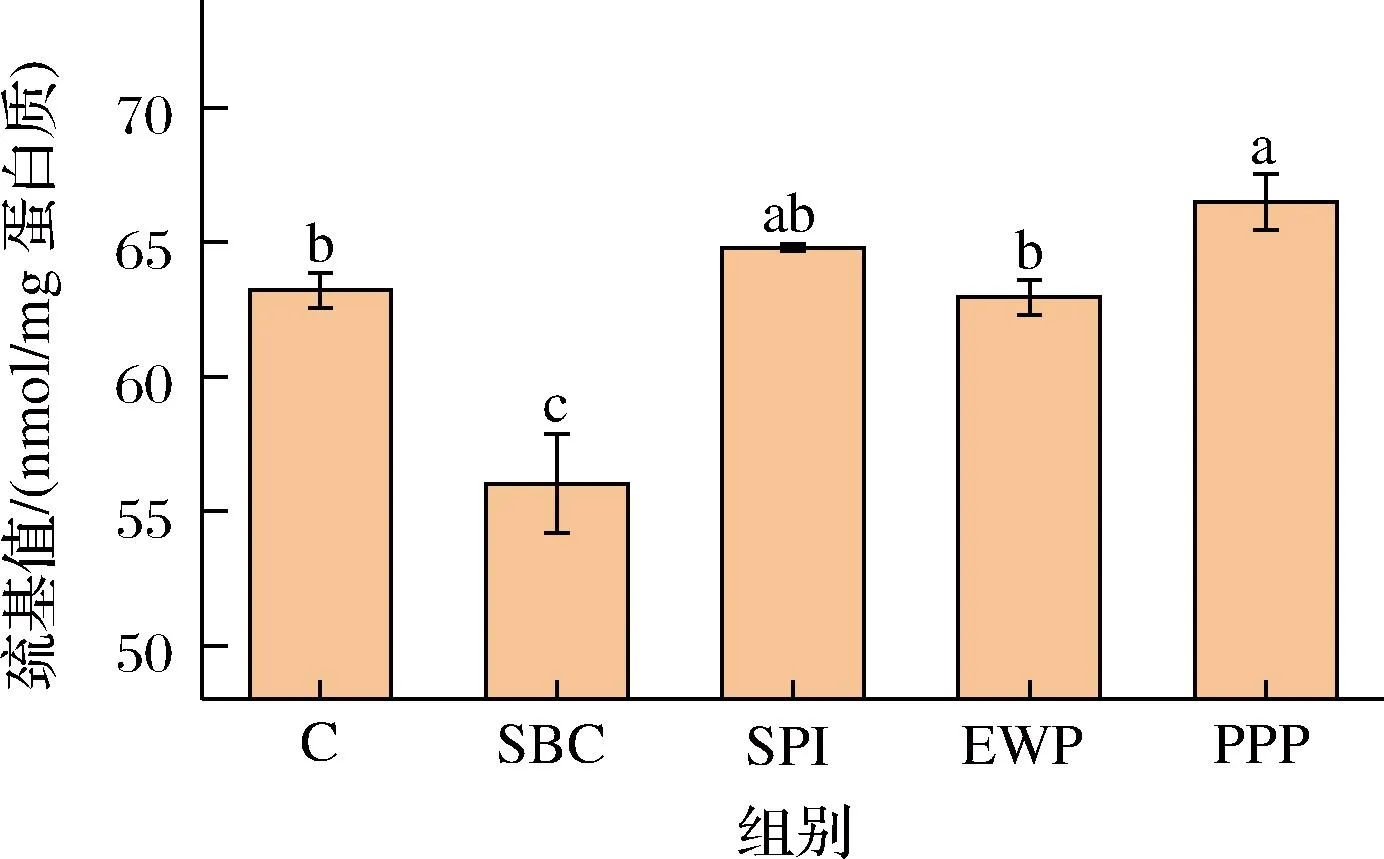
圖8 不同非肉蛋白添加對肌原纖維蛋白巰基含量的影響Fig.8 Effect of different non-meat protein additions on thiol content of myofibrillar proteins
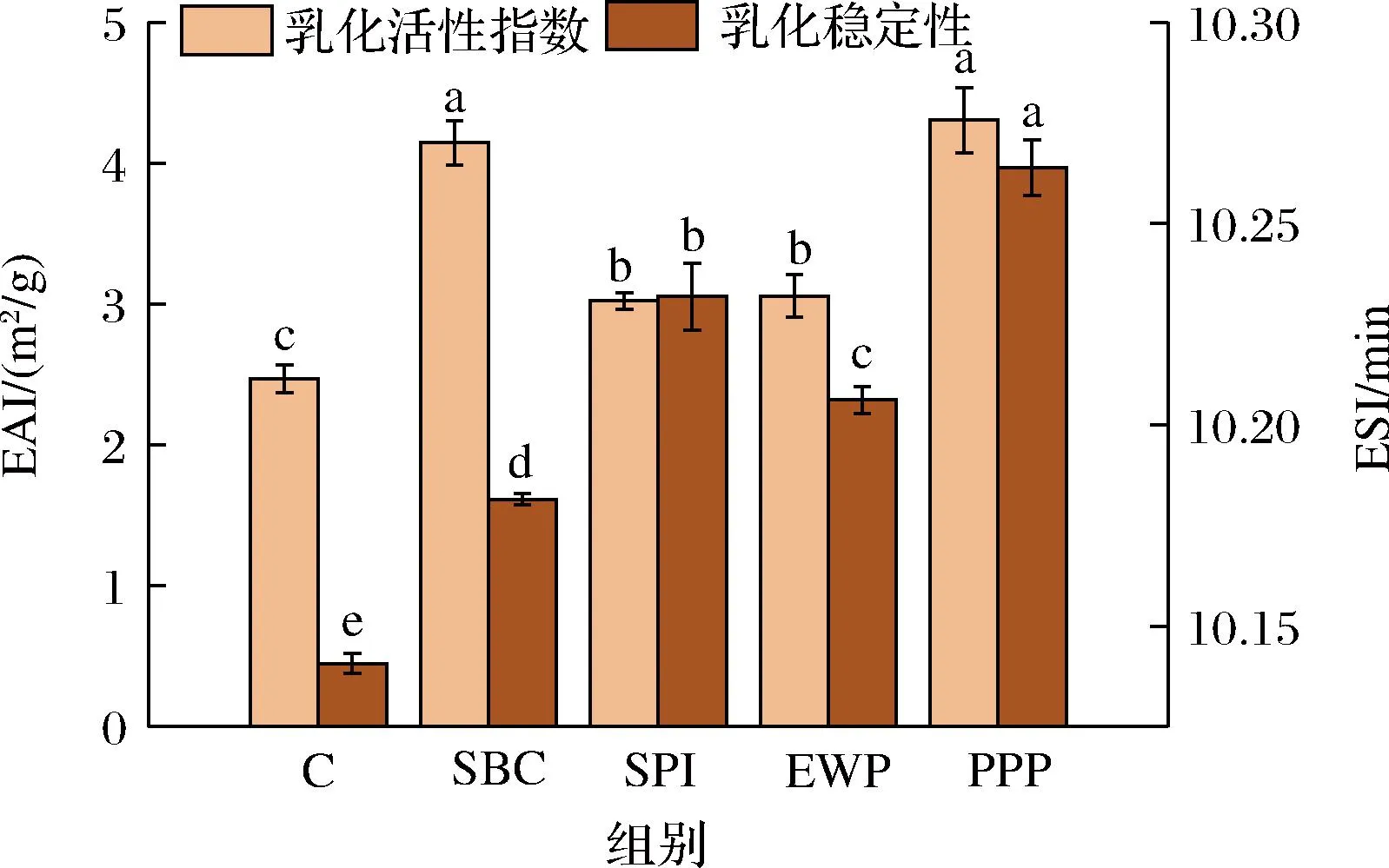
圖9 不同非肉蛋白處理對MP乳化性的影響Fig.9 Effect of different non-meat protein treatments on EAI of MP
ESI反應了肉制品加工過程中蛋白質維持乳液體系穩定的能力[31]。由圖9可知,空白MP乳液的ESI值為10.14。表明添加非肉蛋白能夠顯著提升豬肉MP乳液的穩定性,并在添加PPP時ESI指數相對較高且穩定。分析結果表明,乳化穩定性指數和樣品黏度呈現顯著正相關性。利用Stokes理論分析黏度與ESI指數的關系,相同濃度下,PPP乳狀液的相分離的速率最慢,黏度反而最大,因此其ESI指數最高,經過測定,對照樣品的黏度相比于其他組是最低的,這也導致了其乳狀液ESI指數低于其他組。有學者研究表明,乳化活性的明顯區別和蛋白種類密切相關[32]。因此,蛋白質的特異性差異,也可能導致本研究中不同非肉蛋白處理的MP乳化活性有明顯區別的原因。
3 結論
分析結果表明SBC和PPP均能增加肌球蛋白重鏈含量,EWP、PPP可顯著提高復合蛋白熒光強度。此外PPP與MP的交聯最好,提高了復合蛋白的熱穩定性,對其乳化特性也有積極影響。非肉蛋白復配均對MP表觀黏度、乳化活性、乳化穩定性有促進作用,其中EWP和PPP處理后觸變環面積分別增加了103.30%、100.70%。與對照組相比,SBC、SPI、EWP、PPP組平均粒徑分別增大74.10%、72.02%、59.58%、111.19%。除EWP外其他復合凝膠疏水性均有所提高,其中SPI組和PPP組分別提高了19.61%、15.70%。總巰基實驗結果顯示,SBC添加組總巰基顯著下降。該研究結果表明幾種非肉蛋白,尤其是PPP能改善MP的性質,在肉制品加工中具有廣闊的應用前景。

