珠江河網密刺苦草種群衰退的表觀性狀特征指示



DOI:10.15928/j.1674-3075.202205100159
收稿日期:2022-05-10""""" 修回日期:2022-09-16
基金項目:中國水產科學研究院中央級公益性科研院所基本科研業務費專項資金(2022SJ-XT3,2018-SJ-ZH06);國家自然科學基金(31500434)。
作者簡介:李毅,1997年生,女,碩士研究生,研究方向為漁業發展。E-mail: leeyi101@163.com
通信作者:曾艷藝,1983年生,女,博士,碩導,研究方向為漁業環境保護與修復。E-mail: yanyizeng84@prfri.ac.cn
摘要:探討珠江河網密刺苦草現存種群衰退特征及其主要影響因素,可為珠江河網水草床種群復建,珠江河網水生態功能和漁業資源持續利用和發展提供基礎依據。于2017-2019年對珠江河網水草床及其中外海(S3)、小塘(S5)和欖核(S8)的密刺苦草開展調查,利用冗余分析(RDA)和主成分分析(PCA)等。多元統計方法分析密刺苦草的株高、株重、葉片指標等參數與環境因子關系,并結合2019年該區域密刺苦草種群急劇衰退情況探討其衰退前的表觀性狀特征指示意義。結果顯示,珠江河網密刺苦草衰退前一年度種群表觀性狀時空分布特征差異明顯,S3和S8站位密刺苦草株高、株重等在2月、8月至12月期間呈現先增加后下降的趨勢,而S5站位密刺苦草上述指標持續增加;12月,不同站位密刺苦草種群出現生長特征分化,S5站位密刺苦草進入花果期,而S3和S8站位密刺苦草則開始衰退。RDA結果顯示,密刺苦草株高主要受水深、沉積物中粒徑組分及沉積物總磷含量等影響,株重主要受沉積物總磷含量影響,不同站位群叢受到不同環境因子的影響制約。PCA結果顯示,密刺苦草的9種表觀性狀可表征其克隆生長力、有性繁殖力和多年生長力,并決定其種群維持策略:一種以S5站位為代表,種群越冬期保持持續生長力,并進行有性繁殖資源分配,能適應環境變化,種群在次年得以維持和延續;另一種以S3和S8為代表,種群在越冬期生長力減弱,無有性繁殖資源分配,未能有效應對不利環境條件,最終導致兩站位種群在次年急劇退化甚至消失。
關鍵詞:密刺苦草;表觀性狀;有性繁殖;種群恢復;珠江河網
中圖分類號:Q145.1;Q948.11""""""" 文獻標志碼:A""""""" 文章編號:1674-3075(2024)04-0155-10
苦草屬植物(Vallisneria)是許多湖泊、溪流等淡水水域常見的沉水植物類群,在穩定水域生態系統結構、控制沉積物再懸浮、固定氮磷營養鹽、提供水生動物棲息和繁育場所等方面發揮重要作用(Willby et al,2000;Hamberg et al,2017;Goldberg et al,2018;Liu et al,2020),但隨著全球氣候變化、富營養化、水壩建設及其他人類活動影響,加之水質下降、水位節律改變等因素疊加脅迫,致使全球范圍的苦草種群呈現不同程度的衰退趨勢(Fischer amp; Claflin,1995;Capers, 2003;Goldberg et al,2018;Tibby et al,2020)。
珠江河網是國家粵港澳大灣區建設的重要水域航運樞紐,同時也是與下游河口和南海營養物質輸送交換、魚類洄游的通道,是眾多水生生物棲息繁衍的固有生境,承載著重要的生態服務功能(Liu et al, 2019;Shen et al,2022)。由沉水植物形成的水草床生境是珠江河網許多水生生物的庇護、棲息、繁育場所,直接或間接為水生動物提供食物來源(Zeng et al,2018;曾艷藝等,2018)。珠江河網水草床中占據優勢的沉水植物種類為密刺苦草(V. denseserrulata),也是我國記載的3種苦草屬植物之一,與苦草(V. natans)和刺苦草(V. spinulosa)相比,密刺苦草為多年生常綠植物,其地上部分可越冬,主要分布于我國廣東、廣西等水域(顏素珠,1983;Zhou et al,2016;付文龍等,2019)。20世紀80年代以前,密刺苦草生長茂盛、繁殖力強,是珠江河網許多河涌、溝渠中優勢水生植被(顏素珠等,1988),近年來隨著珠江河網水草床的急劇衰退,密刺枯草也面臨種群消失的風險(Du et al,2007;曾艷藝等,2020),但關于珠江河網苦草急劇衰退現狀及原因尚未得到足夠的關注。珠江河網受不規則半日潮影響,水草床分布區域水位呈不規則日節律波動,同時不同江段水環境特征差異較大(賈慧娟等,2019),探明珠江河網苦草生長特征及其影響因素對區域水草床保護和修復極其重要且緊迫。
本文以珠江河網優勢沉水植物密刺苦草為主要研究對象,分析該種群在不同江段不同月份的表觀性狀特征及其與環境因子的關系,并從種群表觀性狀特征差異角度探討其在不同江段的維持策略,旨在為當地優勢沉水植物種群復建、區域水草床保護和恢復,維持水生態服務功能,支持粵港澳大灣區建設和國家生態文明建設提供科學依據。
1"" 材料與方法
1.1"" 采樣時間和站位布設
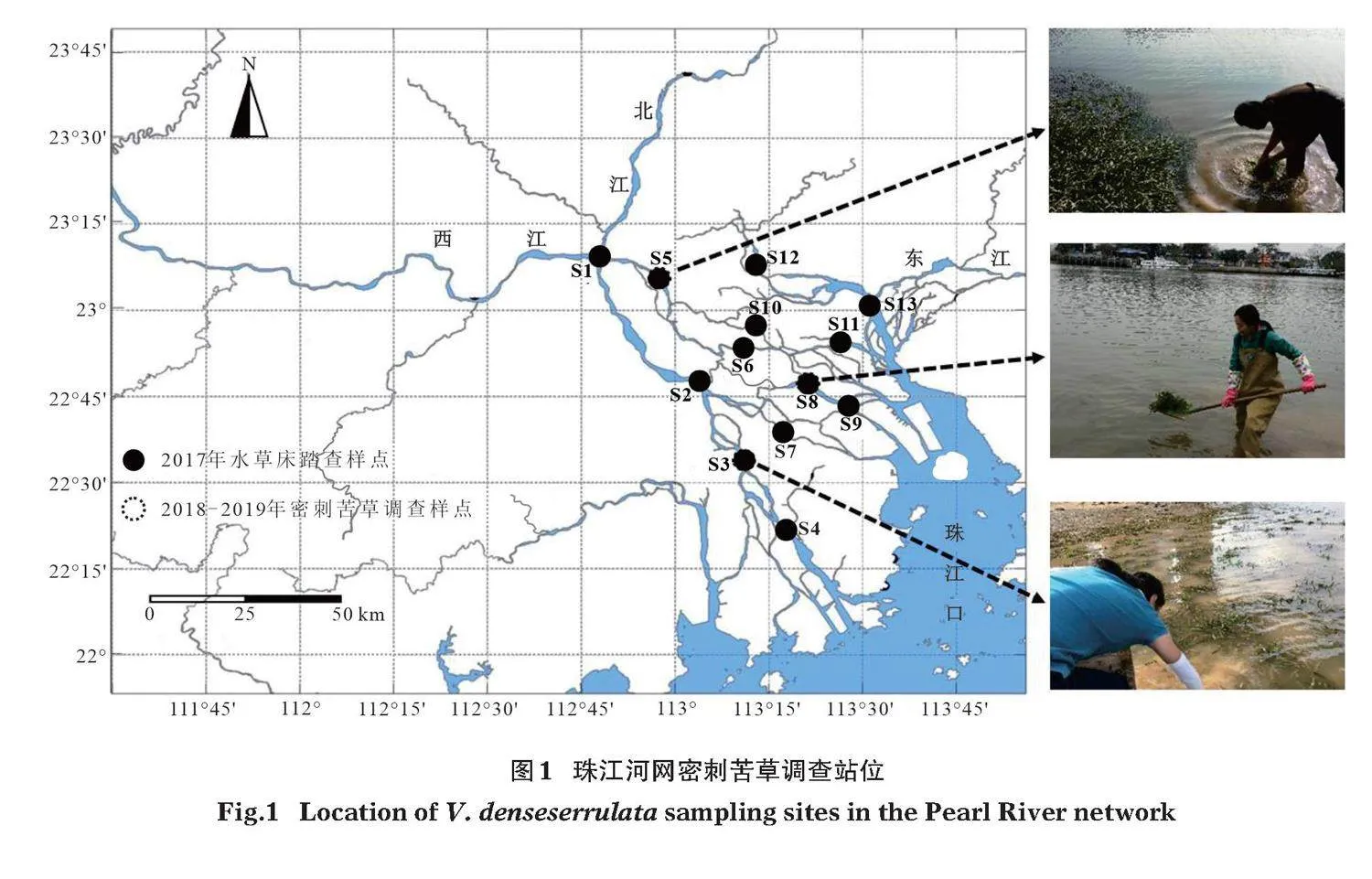
在前期對珠江河網調查研究基礎上(Zeng et al,2018;賈慧娟等,2019),避開珠江禁漁期(每年的3月1日至6月30日),于2017年2、8和12月在珠江下游河網布設13個樣點進行水草床分布情況調查(圖1,表1)。通過走訪當地漁民,確定最可能存在水草的區域范圍,并且在各站位退潮時段(2"h內)進行踏查,較深水域以漁船結合水下采草器調查等方式,記錄各站位上下1"km范圍內水草床分布情況,有水草床分布的則測量記錄水草床覆蓋面積,并采集鑒定沉水植物種類。2018年于上述3次調查月份進一步對2017年調查中發現密刺苦草種群分布的站位江段(S3、S5和S8)開展種群表觀性狀特征調查。于2019年再次對上述3個站位密刺苦草種群覆蓋面積進行跟蹤監測。
1.2"" 密刺苦草采集及表觀性狀參數測定方法
對各站位不同調查時期的密刺苦草以不同群叢表示,對每個群叢采樣調查時,從淺到深的分布區域按傾斜N字型均勻采集4個樣方,每個樣方隨機選取10株,每次調查每個站位共選取40株密刺苦草完整植株,去掉枯葉,測量并記錄了單株株重、株高、葉片數、葉寬、葉厚、單株葉片總長度等外觀形態指標。由于12月份不同站位群叢存在明顯的生長期特征差異,本次調查增加群叢植株的生長階段分化情況(營養生長期、有性繁殖期)、莖指標(莖直徑、莖高、莖色澤)等指標測量記錄。
指標測定時,對于連枝植株,從匍匐莖中間剪斷后進行參數測量。其中,株重(PW)為單株植株所有地下、地上部分的總濕重(g);株高(PH)為單株植株地上莖底端至整株中完整葉片最長端的距離(cm);葉片數(LN)為各植株的現存葉片總數;葉寬(LW)為單株植株中葉片最寬處寬度;葉厚(LT)為單株植株中附著物最多的葉片的厚度(mm);單株葉片總長(LL)是將單株的所有葉片的長度加和(cm)。生長階段指標為定性指標,區分營養生長期和有性繁殖期,莖指標涉及多年生和一年生密刺苦草性狀差異,莖高為存活葉片最底端至莖最遠端距離(mm);莖直徑為莖部最寬范圍直徑(mm),莖色澤由淺至深定性判斷區分為白色、淺黃色、褐色3個等級。其中,株重利用0.01"g天平稱量;株高、葉片長度和葉寬利用普通直尺測量,葉厚、莖直徑、莖高利用數顯游標卡尺測量。
1.3"" 環境因子分析
每次調查時現場利用YSI(Aqua Troll 400, 美國)測定水溫(Tem)、pH、溶解氧(DO)、水深(Dep),利用便攜式流速儀(WX-LJ20A)測定該站位最大流速(Vel),利用塞氏盤測定透明度(Trs),同時采集水樣固定后帶回實驗室,利用流動注射分析儀(SKARLAR, 荷蘭)分析水體總氮(TNw)、總磷(TPw);采集密刺苦草群叢的表層沉積物,剔除其中水草根部及其他大塊碎屑,裝入封口袋,帶回實驗室冷凍干燥后進行粒徑組分及總有機質(TOMs)、總氮(TNs)、總磷(TPs)含量分析。
1.4"" 數據統計分析
采用ANOVA分析不同站位不同時期密刺苦草表觀性狀指標均值差異。對2018年3個站位3次調查中水溫等14項環境因子以及密刺苦草株高、株重、葉片數、葉厚、葉寬和葉總長等6項表觀性狀指標數據矩陣先進行Spearman兩兩相關分析,根據顯著相關關系從中篩選出主要性狀指標及主要相關的環境因子矩陣進一步進行RDA分析,以探討密刺苦草種群性狀特征與環境因子的關系。對3個站位12月群叢的株高、株重、葉片數、葉寬、分枝數、莖高、莖直徑、莖色澤和生長階段分化情況9個表觀性狀指標矩陣進行PCA分析,探討密刺苦草種群整體衰退前表觀性狀空間差異特征。相關統計分析和作圖主要通過SPSS16.0、Canoco 5和JMP軟件完成。
2"" 結果與分析
2.1"" 2017年珠江河網水草床分布情況
2017年對珠江河網13個站位的調查結果顯示,僅S2、S3、S5和S8 4個站位江段有水草床分布,且后3個站位江段均有密刺苦草種群分布(表1)。其中,S5站位江段密刺苦草分布于江段內灣淺灘,S3和S8站位群叢則分布于長直江段沿岸帶淺灘。
2.2"" 2018年密刺苦草種群分布區域環境特征
2018年S3、S5和S8 3個站位江段水體、底質環境指標如表2,相同調查時期下,各站位水溫、溶解氧、pH、水體總氮及總磷差異不大;但S5站位的水深及透明度都略高于其他站位,而流速則相反;S8站位沉積物總氮、總磷含量高于S3與S5站位;S3與S8站位沉積物以中砂和細砂含量為主,且2站位的3種級別粒徑組分含量相近,而S5站位沉積物以中砂和粗砂組分為主,細砂組分僅占8.1%。
2.3"" 2018年密刺苦草種群表觀性狀參數變化特征
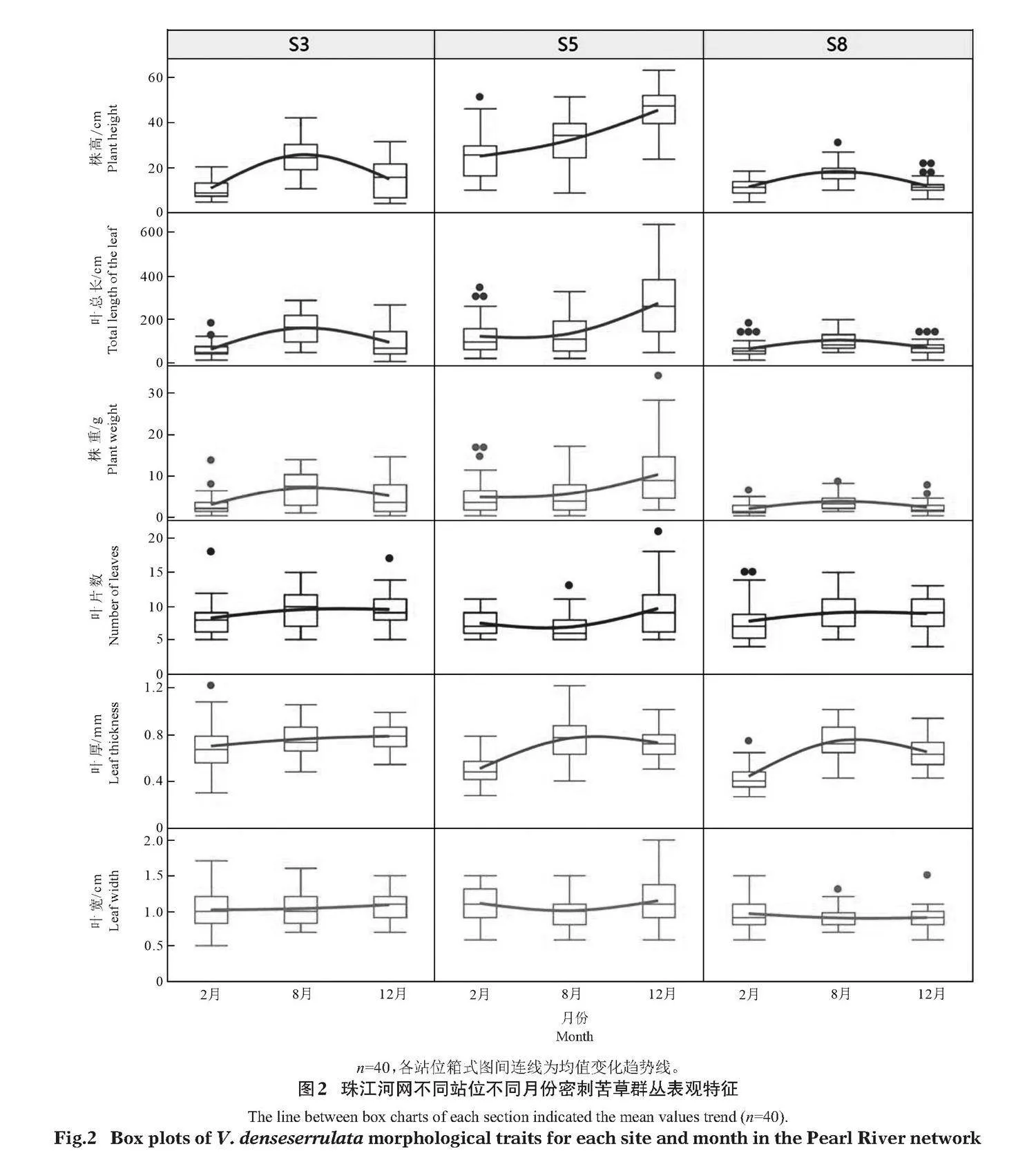
不同站位不同時期密刺苦草群叢的各表觀性狀特征時空差異如圖2所示,葉片數均值基本保持在7~9片;葉寬、葉厚均值分別為0.9~1.1"cm、0.41~0.78"mm;株重、葉總長和株高在不同站位的不同調查時期差異極顯著(Plt;0.01)。其中,S3和S8站位密刺苦草株重、葉總長和株高在2、8和12月期間呈現先增加后下降的趨勢,而S5站位密刺苦草上述指標持續增加。此外,不同站位密刺苦草生長特征在12月份出現分化,S5站位密刺苦草進入了花果期,而S3和S8站位密刺苦草該時期則開始衰退(圖3)。
2.4"" 2018年密刺苦草種群與環境因子之間關系特征
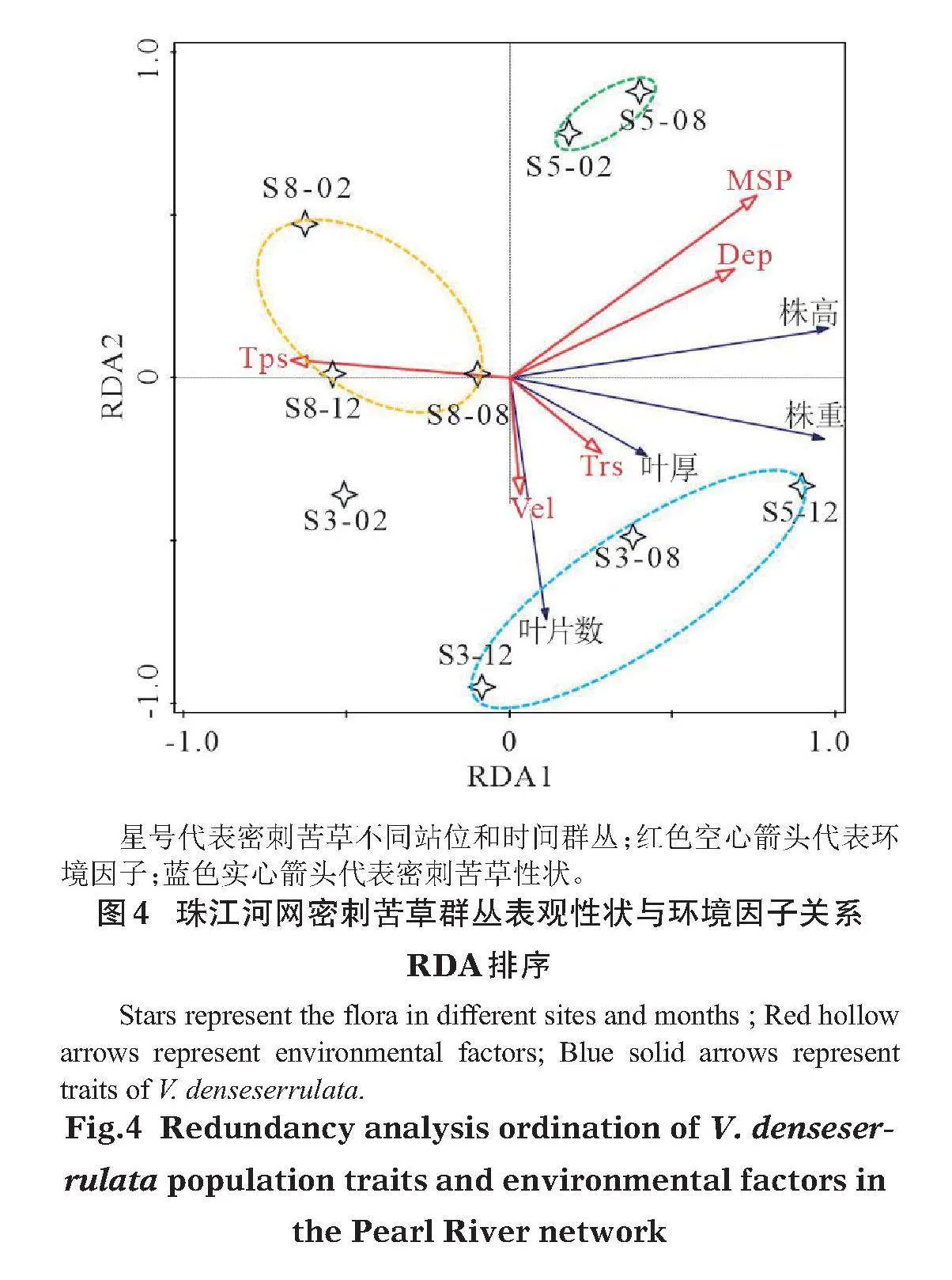
從Spearman相關分析結果中篩選出株高、株重、葉厚和葉片數4個性狀與水深、透明度、流速、沉積物中粒徑組分及沉積物總磷含量5個環境指標具有顯著相關性(Plt;0.05)。進一步對9個密刺苦草群叢的4個性狀指標與5個環境因子矩陣進行RDA分析,結果表明前2排序軸對方差解釋率達94%,環境因子軸與密刺苦草性狀軸之間的相關系數分別為0.99和0.84,置換檢驗P值為0.008, RDA結果能較好地反映密刺苦草種群與環境因子間的相關關系。圖4排序結果顯示,水深(Dep)、沉積物中粒徑組分(MSP)與第1排序軸呈顯著的正相關關系(P分別為0.024和0.041);而沉積物總磷(TPs)與第1排序軸呈顯著的負相關關系(P= 0.010);透明度(Trs)與第1排序軸雖呈正相關,但相關性不顯著(P=0.063);雖然流速(Vel)與第2排序軸呈顯著負相關關系,但第2排序軸在對方差解釋貢獻率較小,由此可認為珠江河網流速差異對苦草種群的影響不大。整體而言,水深、沉積物中粒徑組分及沉積物總磷含量是影響密刺苦草株高的主要因子;沉積物總磷是影響株重的主要因子。
珠江河網密刺苦草不同群叢大致分為3類,一類為S5站位2月和8月群叢,這一類與沉積物中粒徑組分及水深呈正相關關系,但與流速呈負相關關系;第2類為S3站位8月群叢及其他兩站位12月群叢,該類與水體透明度及流速呈正相關關系;第3類為S8站位群叢,與沉積物總磷含量呈正相關關系,意味著密刺苦草不同站位群叢受不同環境因子的影響制約。
2.5"" 種群維持與表觀性狀關系
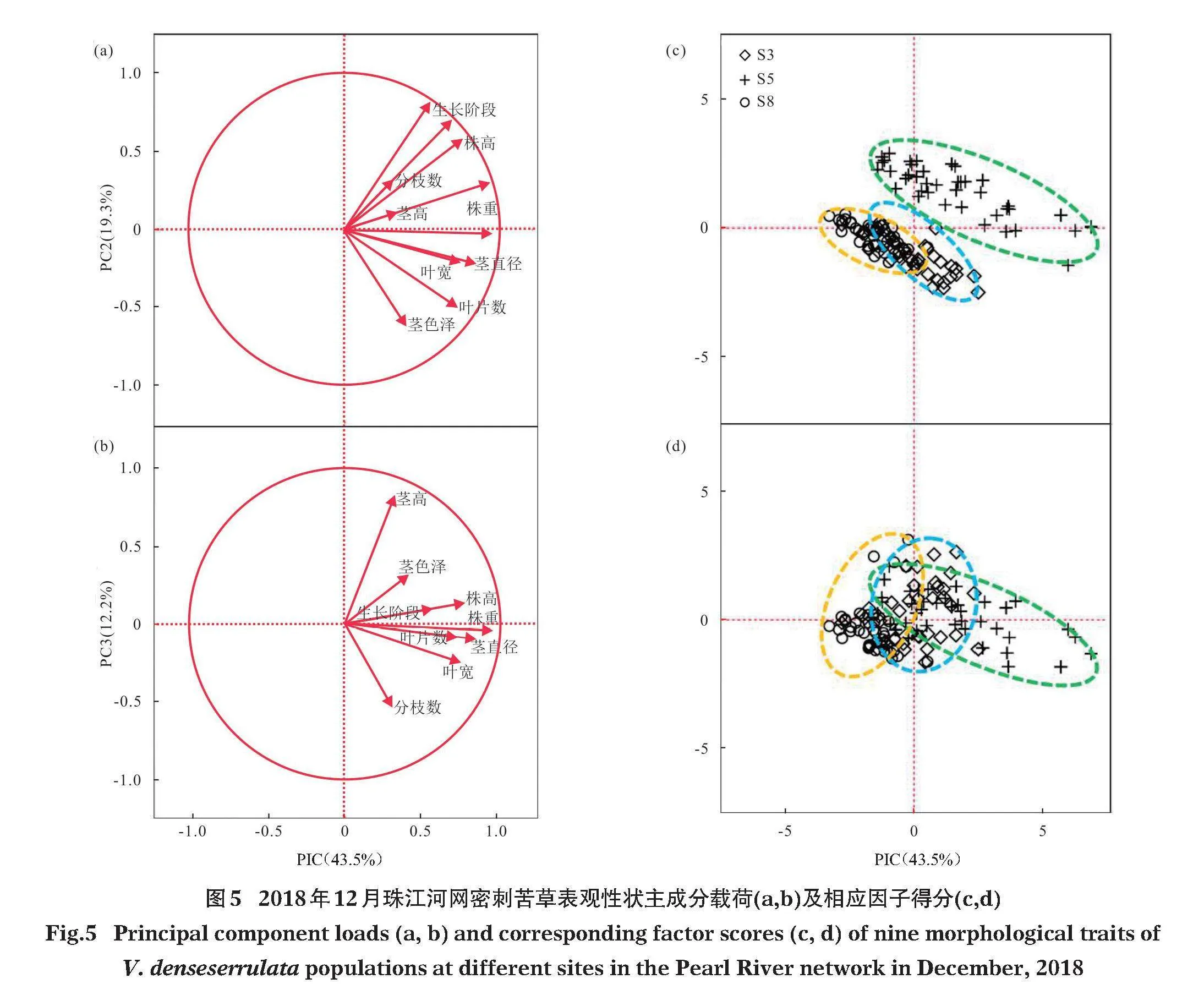
2019年對S3、S5和S8站位密刺苦草種群覆蓋面積的跟蹤監測結果發現,僅S5站位江段尚有密刺苦草種群覆蓋,但覆蓋面積較2017年下降了50%,而S3和S8兩站位區域的密刺苦草種群均已完全消失。對2018年12月越冬期密刺苦草各群叢的株高、株重、葉片數、葉寬、分枝數、莖高、莖直徑、莖色澤和生長階段9個表觀性狀指標的主成分分析Bartlett球形檢驗卡方為705.4,Plt;0.0001,各變量的獨立性假設不成立,主成分分析適用;KMO值為0.713gt;0.7,主成分分析效果較好。前3個主成分特征值大于1,其總方差貢獻率為75.0%。載荷(圖5-a,b)顯示:PC1在株重、莖直徑、株高、葉片數、葉寬等變量上均有較大載荷,載荷系數大于0.7,該主成分可表征為密刺苦草的克隆生長力;而PC2在生長階段分化上有最大的載荷,載荷系數為0.78,在株高上有較大載荷,載荷系數為0.56,該主成分可表征為密刺苦草的有性繁殖力;PC3在莖高上有較大載荷,載荷系數為0.81,而分枝數在負向有較大的載荷,載荷系數為-0.51,該主成分可表征為密刺苦草的多年生長力。隨著植株持續多年生長時間延長,莖高不斷增長的同時會不斷老化,莖分枝能力及克隆生長力下降。因子得分(圖5-c,d)顯示:2018年12月,S5站位群叢在PC1和PC2上有較大的正向分布,意味著S5站位密刺苦草群叢仍保持較強的克隆生長力和有性繁殖力;而S3和S8站位在PC1和PC2上主要為負向分布,意味著S3和S8站位群叢上述兩方面的能力較弱,在應對不良環境變化時保持種群持續生長能力將會進一步削弱并有可能急劇衰退。此外,3個站位群叢在PC3上均有不同程度的正向分布,意味著這3個站位群叢密刺苦草個體存在不同程度的多年生長力下降問題,群體面臨衰退的風險。
3"nbsp; 討論
3.1"" 珠江河網密刺苦草生長影響因素分析
水深、透明度、營養鹽被認為是影響沉水植物生長的重要因子(Rascio et al,2002;Maberly et al,2014)。刁若賢等(2017)在太湖原位圍隔研究中發現,隨著水深的增加(gt;1.5"m),苦草(V. natans)的成活率、分蘗數和平均葉長均受到抑制。王磊等(2021)研究亦發現,不同水深下苦草通過改變株高、分枝數和葉片數以適應脅迫環境。苦草生長與水體透明度之間呈正反饋機制,即水體透明度越高,越有利于苦草生長,而苦草生長狀況越好,對水體透明度維持效果越顯著(Su et al,2019)。本研究RDA分析結果表明,對于珠江河網的研究未發現密刺苦草表觀性狀特征與透明度有顯著相關關系,可能因為透明度指標在珠江河網是隨大尺度時空變化的,站位之間的透明度差異不足以對現存密刺苦草表觀性狀差異產生影響。但在調查區域水深均值0.8~1.4"m范圍內,密刺苦草株高、株重等性狀指標與水深具有正相關性,說明在珠江河網密刺苦草分布區域內,隨著水深的增加,促進了密刺苦草株高與株重的增長,這與Wang等 (2022)研究結果一致。此外,林超等(2016)研究發現,低營養條件下,密刺苦草可通過水體營養吸收和根系底泥營養吸收2種途徑,增加自身水平克隆繁殖力和擴散力;營養富足時,密刺苦草通過株高增長的方式增加生物量,從而縱向拓展群體;苦草根系在生長過程中能充分吸收利用不同形態的磷而快速擴大種群(王立志等,2019)。綜合本研究RDA分析結果卻顯示,密刺苦草的株高、株重等4個表觀性狀指標均與沉積物中總磷含量呈負相關關系,意味著該區域密刺苦草的生長在一定程度上受到了沉積物中總磷含量(481~662 mg/kg)的直接或間接抑制作用。然而,這與王立志等(2019)開展室內控制實驗結果顯示的在沉積物總磷在700"mg/kg左右時苦草處于適宜生長狀態相矛盾,結果的差異是由于種間差異亦或是室內控制與野外生長條件差異所致,仍需進一步研究。
除大量營養元素外,底質對苦草的生物量、分株形態特征及匍匐莖繁殖能力影響效應顯著,Lin等(2020)研究湖泥、湖泥與沙土混合、沙土以及淤泥4種底泥對苦草種群生長影響,發現湖泥對苦草的分蘗、生長效果均最佳;Bai等(2022)發現蛭石可提高苦草吸收利用環境中常量及微量元素效率,改善微生物環境,以促進苦草生長和種群恢復。本研究發現,珠江河網密刺苦草群叢在沉積物中粒徑(粒徑大于125"μm)組分含量高的底質環境中生長優勢特征明顯,由此推測適當的中粒徑組分底質更利于密刺苦草持續生長,這與Lin等(2020)、王磊等(2021)研究結果有差異,下一步需開展底質環境究竟是如何通過粒徑組分、微量營養元素、微生物環境作用于珠江河網密刺苦草種群的研究。
3.2"" 珠江河網密刺苦草種群維持策略探討
沉水植物的種群維持是種群在應對環境變化時保持生長和種群延續的適應性體現,其性狀特征可反映植物應對環境變化的適應策略,對揭示種群變化機制極其重要(Chambers et al,1991)。越來越多的研究表明,沉水植物以不同的生長形式應對周圍環境產生適應性策略和正反饋效應(Li et al,2018;Yuan et al, 2022)。對沉水植物而言,葉是最重要的光合作用器官,在環境指示中具有重要的意義(Dobberfuhl,2007)。本研究從葉寬、葉厚、葉片數、株高、葉總長等葉表觀參數,結合莖、生長時期分化等其他特征分析發現,珠江河網密刺苦草種群存在2類表觀性狀特征顯著差異的群體,據此推測該研究區域密刺苦草存在2種不同的種群維持策略:一種以S5站位為代表,種群在越冬期保持持續生長力,并進行有性繁殖資源分配;另一種以S3和S8為代表,種群在越冬期生長力減弱,無有性繁殖資源分配。具體表現為,S5站位密刺苦草群叢表觀性狀值綜合表現出優于S3和S8站位密刺苦草群叢的生長適應力,全年保持生長,且秋冬季群體進入有性繁殖期;而S3和S8站位密刺苦草群叢呈先生長后衰退的特征,秋冬季資源配置中地上部分尤其是葉分配降低,種群的橫向生態位拓展能力減弱,群體全年未見有性繁殖期。作者雖未在現場調查中進一步跟蹤種群的后續有性繁殖過程,但通過在實驗基地對從S5和S3站點采集的植株進行持續培養觀察,我們發現,S5站位帶回的植株有性繁殖率高于S3站位植株,這與Zhang等(2020)對長江中下游苦草(V. natans)研究發現從種子發育而來的苦草植株將產生更多的果實和種子,而從克隆繁殖體發育而來的植株將產生更多的匍匐莖和越冬塊莖的結果相一致,這在一定程度解釋了本文對珠江河網密刺苦草種群維持策略差異的推測。
雖然作者現掌握的數據不足以闡明珠江河網不同站位密刺苦草種群維持策略差異及其機制,但袁龍義等(2013)對刺苦草種群研究發現,在刺苦草生長期內水位下降會顯著降低冬芽的形成,而在繁殖期內水位脅迫會加速刺苦草營養體形成更多冬芽,即生長季節穩定的水位生境有利于密刺苦草種群的延續,而繁殖期水位的波動有利于無性繁殖體的形成。基于本研究對應S3、S5和S8 3個站位的生境特征及2019年種群跟蹤監測結果,推測在S5站位水位差異較小,營養及底質環境適宜的條件下,密刺苦草選擇了在越冬期保持持續生長,并進行有性繁殖資源分配以適應其特定生境,從而使種群在次年得以維持和延續;而S3和S8種群在2018年越冬期生長力減弱,更無多余資源進行有性繁殖資源分配,在豐水期長期高水位或枯水期長期低水位的不利環境下,種群未能有效應對不利條件生長并延續種群,最終導致2站位種群在次年急劇退化甚至種群消失,這與張忠海等(2021)對苦草的研究結論相似。種群維持依靠群體的繁殖生長能力,珠江河網密刺苦草種群的衰退可能與群體適應環境變化時的克隆生長力和有性繁殖力下降有關,而這2種能力的下降可能受水位節律異常波動導致水深、底質環境變化等綜合環境因子的疊加影響。
3.3"" 珠江河網密刺苦草種群修復與研究對策建議
以往研究表明苦草種群恢復易受到底質環境與水體環境等因子的制約(Xiao et al,2006;2007;Zhou et al,2016),結合本研究對珠江河網密刺苦草種群表觀特征分析研究結果,建議根據不同站位江段的密刺苦草生長分布特征與種群維持策略,側重采取不同的保護對策。對于S5站位江段,現存密刺苦草種群仍保持一定覆蓋面積,且處于較好的自然生長和繁殖狀態,應以避免過多的人類活動干擾且加強保護為主;而對于種群新消失的S3和S8江段,若需修復密刺苦草種群,應劃出專門的保護區域,在密刺苦草生長期進行人工移栽和特別管護,待種群恢復后,水草床底棲或底層性動物可有效改善底質條件,以維持水草床與水生動物互惠互利的穩定生態系統。
現階段珠江流域水草床保護尚未得到足夠的重視,應繼續深入開展環境因子對珠江河網沉水植物生長繁殖影響研究,查明珠江河網沉水植物生長繁殖和種群維持機制,以便進一步采取科學、合理措施加以保護和修復,維持珠江河網水草床生態功能和漁業資源可持續發展。此外,由于珠江河網現存密刺苦草覆蓋面積急劇下降,為了更好地保護現存種類,本研究嘗試了在不破壞整體植株原則下,通過測量或稱量的方法獲取研究對象的可測量指標參數,同時,經測量后的植株還可用于其他生長實驗研究。最后,本研究采用的表觀測量參數研究法簡單易操作,可為衰退水草床種群的廣泛而深入研究和修復應用提供借鑒方法。
志謝:野外調查得到姚陳婷、鄭曉瓊、陸煒梅、高燕琳等的幫助,在此表示感謝。
參考文獻
陳實, 喬永民, 侯磊, 等, 2011. 汕頭南澳海域表層沉積物氮、磷的形態分布及污染評價[J].安全與環境學報, 11(3):128-133.
刁若賢, 徐兆安, 吳東浩, 2017. 太湖原位圍隔中水深對苦草生長的影響[J].水生態學雜志, 38(4):43-47.
付文龍, 李治中, 劉洋, 等, 2019. 中國苦草屬(Vallisneria)植物命名考及區分要點[J].植物科學學報, 37(4):448-453.
賈慧娟, 賴子尼, 王超, 2019. 珠三角河網浮游植物物種豐富度時空特征[J].生態學報, 39(11):3816-3827.
林超, 韓翠敏, 游文華, 等, 2016. 不同水體營養條件對刺苦草和密刺苦草生長的影響[J].生態學雜志, 35(8):2117-2121.
王磊, 胡效卿, 張卓倫, 等, 2021. 不同水深和基質下苦草(Vallisneria natans)的生理生態適應策略[J].生態學雜志, 40(8):2421-2430.
王立志, 董彬, 宋紅麗, 等, 2019. 沉水植物苦草對沉積物各形態磷時空分布的影響[J].水生態學雜志, 40(4):58-64.
王瑞, 何亮, 張萌, 等, 2021. 中國苦草屬(Vallisneria)植物萌發與生長的影響因素[J].湖泊科學, 33(5):1315-1333.
顏素珠, 1983. 中國水生高等植物圖說[M]. 北京: 科學出版社.
顏素珠, 陳秀夫, 范允平, 等, 1988. 廣東河網地帶的水生植被[J].暨南理醫學報(理科專版), 9(3):73-79.
袁龍義, 李守淳, 李偉, 2013. 水深變化對刺苦草冬芽形成的影響研究[J].江西師范大學學報(自然科學版), 37(4):355-358.
曾艷藝, 楊婉玲, 李海燕, 等, 2018. 珠江河網典型段基礎碳源對水生動物的貢獻[J].生態學雜志, 37(8):2403-2410.
曾艷藝, 楊婉玲, 王超, 等, 2020. 珠江河網典型水草床與貝類群落生物量特征[J]. 生態學雜志, 39(1):172-179.
張忠海, 楊桐, 文紫豪, 等, 2021. 在極度弱光和兩種底質條件下苦草的生長和生理響應[J].水生生物學報, 45(3):652-662.
Bai G L, Luo F, Zou Y, et al, 2022. Effects of vermiculite on the growth process of submerged macrophyte Vallisneria spiralis and sediment microecological environment[J]. Journal of Environmental Sciences (China), 118:130-139.
Capers R S, 2003. Six years of submerged plant community dynamics in a freshwater tidal wetland[J]. Freshwater Biology, 48(9):1640-1651.
Chambers P A, Prepas E E, Hamilton H R, et al, 1991. Current velocity and its effect on aquatic macrophytes in flowing waters[J]. Ecological Applications: a Publication of the Ecological Society of America, 1(3):249-257.
Dobberfuhl D R, 2007. Light limiting thresholds for submerged aquatic vegetation in a blackwater river[J]. Aquatic Botany, 86(4):346-352.
Du Q P, Jia X S, Huang C N, 2007. Chlorobenzenes in waterweeds from the Xijiang River (Guangdong section) of the Pearl River[J]. Journal of Environmental Sciences (China), 19(10):1171-1177.
Fischer J R, Claflin T O, 1995. Declines in aquatic vegetation in navigation pool no. 8, upper Mississippi River between 1975 and 1991[J]. Regulated Rivers: Research amp; Management, 11(2):157-165.
Goldberg N A, Trent T, Hendrickson J, 2018. Temporal and spatial changes in Vallisneria americana Michaux (tape-grass) beds in the lower St. Johns river, Florida, from 2002-2011[J]. Southeastern Naturalist, 17(3):396-410.
Hamberg J, Findlay S E G, Limburg K E, et al, 2017. Post-storm sediment burial and herbivory of Vallisneria americana in the Hudson River Estuary: mechanisms of loss and implications for restoration[J]. Restoration Ecology, 25(4):629-639.
Li L, Lan Z, Chen J, et al, 2018. Allocation to clonal and sexual reproduction and its plasticity in Vallisneria spinulosa along a water-depth gradient [J]. Ecosyphere, 9(1): e02070.10.1002/ecs2.2070.
Lin Q W, Fan M J, Jin P, et al, 2020. Sediment type and the clonal size greatly affect the asexual reproduction, productivity, and nutrient absorption of Vallisneria natans[J]. Restoration Ecology, 28(2):408-417.
Liu C, Yu M, Cai H, et al, 2019, Recent changes in hydrodynamic characteristics of the Pearl River Delta during the flood period and associated underlying causes [J]. Ocean and Coastal Management, 179:104814.
Liu H, Zhou W, Li X W, et al, 2020. How many submerged macrophyte species are needed to improve water clarity and quality in Yangtze floodplain lakes?[J]. The Science of the Total Environment, 724:138267.
Liu H, Liu G H, Xing W, 2021. Functional traits of submerged macrophytes in eutrophic shallow lakes affect their ecological functions[J]. Science of the Total Environment, 760:143332.
Maberly S C, 2014. The fitness of the environments of air and water for photosynthesis, growth, reproduction and dispersal of photoautotrophs: an evolutionary and biogeochemical perspective [J]. Aquatic Botany, 118: 4-13.
Rascio N, 2002.The underwater life of secondarily aquatic plants: some problems and solutions[Review[J]. Critical Reviews in Plant Sciences, 21(4):401-427.
Shen X M, Cai Y P, Su M R, et al, 2022. High discharge intensified low net ecosystem productivity, hypoxia, and acidification at three outlets of the Pearl River Estuary, China[J]. Water Research, 214:118171.
Su H J, Chen J, Wu Y, et al, 2019. Morphological traits of submerged macrophytes reveal specific positive feedbacks to water clarity in freshwater ecosystems[J]. Science of the Total Environment, 684:578-586.
Tibby J, Adamson K, Kershaw A P, 2020. An 1800-year water-quality and vegetation record from Junction Park Billabong, Murray River, Australia: an assessment of European impacts and sensitivity to climate[J]. Journal of Paleolimnology, 63(2):159-175.
Wang T, Fang L Z, Wang C L, et al, 2022. Water depth rather than substrate heterogeneity affects the clonal performance of the stoloniferous submerged plant, Vallisneria spiralis L[J]. Flora, 287: 151995.
Willby N J, Abernethy V J, Demars B O L, 2000. Attribute-based classification of European hydrophytes and its relationship to habitat utilization[J]. Freshwater Biology, 43(1):43-74.
Xiao K Y, Yu D, Wang J W, 2006. Habitat selection in spatially heterogeneous environments: a test of foraging behavior in the clonal submerged macrophyte Vallisneria spiralis [J]. Freshwater Biology, 51: 1552-1559.
Xiao K Y, Yu D, Wu Z H, 2007. Differential effects of water depth and sediment type on clonal growth of the submersed macrophyte Vallisneria natans [J]. Hydrobiologia, 589: 265-272.
Yuan G X, Yang Z Z, Sun L J, et al, 2022. Asexual reproduction for overwintering of the submersed macrophyte Vallisneria spinulosa at different light intensities[J]. Aquatic Sciences, 84(1):13.
Zeng Y Y, Lai Z N, Yang W L, et al, 2018. Stable isotopes reveal food web reliance on different carbon sources in a subtropical watershed in South China[J]. Limnologica, 69: 39-45.
Zhang X, Guo K, Lu C, et al, 2020. Effects of origin and water depth on morphology and reproductive modes of the submerged plant Vallisneria natans [J]. Global Ecology and Conservation, 24: e01330.
Zhou Y, Li X J, Zhao Y, et al, 2016. Divergences in reproductive strategy explain the distribution ranges of Vallisneria species in China[J]. Aquatic Botany, 132: 41-48.
(責任編輯"" 鄭金秀)
Morphological Traits Indicating Decline of the Vallisneria denseserrulata
Population in the Pearl River Network
LI Yi1,5, YANG Wan‐ling1, WANG Chao1, LAI Zi‐ni1, LI Hai‐yan1, LIU Qian‐fu1, GAO Yuan1,
MAI Yong‐zhan1, ZENG Yan‐yi1,2,3,4
(1. Pearl River Fisheries Research Institute, Chinese Academy of Fishery Science, Guangzhou" 510380, P. R. China;
2. Fishery Ecological Environmental Monitoring Center of Pearl River Basin, Ministry of Agriculture
and Rural Affairs, Guangzhou 510380, P. R. China;
3. Guangdong Provincial Key Laboratory of Aquatic Animal Immune Technology, Guangzhou 510380, P. R. China;
4. Key laboratory of Prevention and Control for Aquatic Invasive Alien Species,
Ministry of Agriculture and Rural Affairs, Guangzhou 510380, P. R. China;
5. College of Fisheries, Tianjin Agricultural University, Tianjin 300392, P. R. China)
Abstract:Submerged macrophyte beds (SMBs) play important roles in aquatic ecosystem, but the succession characteristics of SMBs in urban river systems are still poorly understood. In this study, Vallisneria denseserrulata in the Pearl River network was selected for research, and we investigated the morphologic traits of V. denseserrulata at different sites in different months and explored the decline characteristics and main influencing factors. We also discussed strategies for maintaining V. denseserrulata beds in different river sections based on differentiation of morphologic traits. In February, August and December of 2017, the spatial distribution investigation of submerged macrophyte beds in the lower Pearl River network was carried out at 13 sites (S1-S13) by field investigation and fishery survey. In the same months of 2018 and 2019, monitoring of the morphologic traits of the V. denseserrulata population was conducted at S3, S5 and S8. The relationship of V. denseserrulata morphologic traits and environmental factors were then analyzed using multivariate statistical methods including redundancy analysis (RDA) and principal component analysis (PCA). Results show that the morphologic traits of V. denseserrulata presented obvious differences in temporal-spatial distribution in 2018. The plant height and weight of V. denseserrulata in beds at S3 and S8 increased from February to August, then decreased from August to December, while the plant height and weight of V. denseserrulata at S5 continued to increase. In December, growth characteristics of V. denseserrulata differed among sites, with the population at S5 entering the flowering and fruiting stage, while the populations at S3 and S8 were in recession. The RDA results show that plant height was primarily affected by water depth, medium particle size components and total phosphorus content in sediments, while the plant weight was primarily affected by total phosphorus content in sediments. The PCA results show that the 9 morphological traits comprehensively characterized the clonal growth ability, sexual reproduction ability and multi-year growth ability, and determined population maintenance strategies. The V. denseserrulata population at S5 was characterized by sustained growth during the winter and allocation of resources for sexual reproduction, adapting to environmental changes, and this enabled the population to persist in the following year. Another case, represented by the V. denseserrulata populations at S3 and S8, shows that the growth capacity of the populations declined during the winter, with no allocation of sexual reproduction resources. Having failed to meet adverse environmental conditions, the populations faced rapid population decline and even disappearance the following year.
Key words:Vallisneria denseserrulata; morphological trait; sexual reproduction; population restoration; Pearl River network

