miR-494靶向TLR-4通路在骨質疏松發病中的作用及機制*
匡嘉兵 郭 松 雷建平 程煜方
(武漢市第四醫院骨科,武漢 430060)
社會和經濟的發展帶來人口老齡化的增加以及生活方式的改變,進而導致骨質疏松癥骨代謝紊亂的發病率逐年增加[1]。根據世界衛生組織的定義,骨質疏松癥的特征主要包括骨量的丟失和骨微結構受到破壞。骨質疏松性骨折往往會給老年人造成長期行動不便和各種并發癥,影響患者的生活質量甚至生命健康[2]。因此骨質疏松癥逐漸成為世界范圍內的研究熱點,但目前對于骨質疏松的發病機制尚未完全明確。
微小RNA(microRNA)是單鏈非編碼RNA,包含20~22個核苷酸。microRNA通過靶向靶基因的3′UTR片段并提示其表達,被認為是多種細胞過程的潛在調節因子,如細胞增殖、凋亡和細胞分化[3]。最近的研究概述了數千個microRNA和參與調控它們的多種人類基因。許多研究證實了各種microRNA在調節骨質疏松中的作用[4-8]。先前有研究表明,miR-30a-5p可通過調控RUNX2的表達,抑制成骨細胞分化[6]。miR-204通過調控Wnt信號通路影響小鼠成骨細胞分化等[7]。我們先前的研究證實,miR-494抑制骨鈣素活性,抑制成骨細胞形成礦化結節,但miR-494對骨質疏松的影響尚未有體內實驗進行證實和研究[8]。Toll樣受體-4(TLR4)通路與影響成骨細胞的其他重要通路存在密切聯系。我們經過先前的研究已經證實miR-494可能調控TLR4的表達,進而抑制骨鈣素活性,抑制成骨細胞形成礦化結節[8]。
我們推測miR-494可能在骨質疏松發病過程中起作用,并可能通過靶向TLR-4參與骨質疏松大鼠骨髓間質細胞的增殖、成骨分化、成脂分化等多種重要過程。為深入探究miR-494在骨質疏松中的發病機制,通過構建骨質疏松大鼠模型進行體內實驗,探究miR-494對TLR4通路的影響以及在骨質疏松發病中的作用及機制。
1 材料和方法
1.1 材料
選取30只SPF級8周齡雌性Sprague-Dawley大鼠,購自南方醫科大學。生產許可證【SCXK(粵)2021-0041】,使用許可證【SYXK(鄂)2021-0114】,大鼠平均體質量為(218.74±23.18)g。
1.2 方法
1.2.1實驗分組:將入組的大鼠隨機分為NC組(陰性對照大鼠)、OP組(骨質疏松大鼠)、OP+miR-494 inhibitor組(骨質疏松大鼠,miR-494抑制物注射)、OP+miR-494 inhibitor+TLR-4 vector組(骨質疏松大鼠,miR-494抑制物和TLR-4過表達腺病毒載體注射)、OP+miR-494 inhibitor+sh TLR-4組(骨質疏松大鼠,miR-494抑制物和TLR-4沉默腺病毒載體注射),每組6只。本研究獲得本院動物倫理委員會批準,倫理審批號:LLX20210301D。
1.2.2模型構建:入組的NC組大鼠以每天70 mg/kg的0.9%氯化鈉溶液進行灌胃,每兩天稱量一次體質量,連續灌胃兩周。其余組大鼠均構建骨質疏松大鼠模型,以每天70 mg/kg維甲酸溶液進行灌胃,連續灌胃兩周即可造模成功。麻醉后,首先從所有大鼠的腹主動脈抽取血液。每組6只大鼠通過多聚甲醛灌注固定,獲得股骨組織。
1.2.3骨標本及血液樣本采集及制備:各組大鼠腹腔注射3%戊巴比妥鈉按照0.17 mL/100 g的標準麻醉,采集各組大鼠腹主動脈血,將腹主動脈血在3000 r/min的高速離心機中離心10 min,并獲得上清液,置于-4 ℃冰箱保存。隨后,對大鼠四肢皮膚進行初步消毒和切斷,采用斷頸法處死所有大鼠,取雙側股骨,剔除肌肉和筋膜,用生理鹽水紗布,錫紙包裹,左側用于分離BMSCs細胞,右側用于測量骨密度。
1.2.4分離BMSCs細胞和細胞培養:取左側骨標本置于含有1%雙抗體的預先制備的PBS中。將分離的長骨切斷,過濾骨髓沖洗液,移入離心管中,離心后棄去上清液,將下層細胞重懸,培養細胞,培養3 d后更換培養液,然后第2天更換液體。待培養的細胞生長至培養皿的80%后,將細胞進行傳代培養。
1.2.5大鼠檢測指標:雙能X線吸收儀測定骨密度。ELISA檢測大鼠血清中骨鈣素(BGP)和總堿性磷酸酶(TALP)含量。
1.2.5.1骨密度測定:取右側骨標本使用多聚甲醛固定,并放置在可變系數設置為<1.0%的儀器中,雙能X線吸收儀測量股骨骨密度。肱骨密度測量完畢再次使用生理鹽水紗布,錫紙包裹,用于后續Western blot檢測。
1.2.5.2ELISA:取保存于冰箱中的血液樣本,按照ELISA試劑盒的說明,將樣品和標準品分別裝入平板中,加入生物素化抗體工作液和酶結合物工作液,并清洗平板。使用分光光度計檢測450 nm處的A值,進而檢測各組大鼠血清中BGP和TALP含量。
1.2.6細胞檢測指標:qRT-PCR檢測BMSCs細胞中miR-494和TLR4 mRNA的表達。Western blot檢測大鼠BMSCs細胞中TLR4蛋白的表達。雙熒光素酶報告基因驗證miR-494與TLR-4的靶向關系。CCK8實驗檢測各組BMSCs的增殖能力。茜素紅S染色檢測各組BMSCs成骨分化情況。油紅O染色檢測各組BMSCs成脂分化情況(圖1)。
1.2.6.1qRT-PCR:提取各組大鼠BMSCs細胞RNA,使用反轉錄試劑盒將RNA反轉成cDNA。使用20 μL反應體系進行qRT-PCR。96 ℃預變性30 s,96 ℃變性10 s,60 ℃退火30 s,40個循環。TLR4 mRNA的表達以β-actin為內參,miR-494的表達以U6為內參計算相關基因的相對表達水平。
1.2.6.2Western blot:取各組大鼠右側股骨標本,加入蛋白裂解液,在冰上浸泡1 h,然后在3 000 r/min下離心10 min。使用BCA測定蛋白質濃度。通過SDS-PAGE對蛋白質進行變性和分離。將蛋白質轉移到聚偏二氟乙烯(PVDF)膜上,脫脂牛奶封閉2 h,分別使用一抗和二抗進行孵育。沖洗后,通過與化學發光試劑反應1 min,在黑暗中充分顯影。以β-actin為內參。
1.2.6.3雙熒光素酶報告基因驗證miR-494與TLR-4的靶向關系:構建野生型WT-TLR-4和突變型MUT-TLR-4的3’UTR熒光素酶報告載體。利用LipofectamineTM 2000將miR-494和miR-control分別與WT-TLR-4和MUT-TLR-4共轉染BMSCs細胞,分為以下4組:miR-control和WT-TLR-4共轉染組、miR-494和WT-TLR-4共轉染組、miR-control和MUT-TLR-4共轉染組、miR-494和MUT-TLR-4共轉染組。將各組BMSCs置于細胞培養箱內培養48 h,使用雙熒光素酶報告檢測試劑盒,檢測各組細胞相對熒光素酶活性。
1.2.6.4CCK8實驗檢測各組BMSCs的增殖能力:將各組BMSCs按5×103個/孔,接種到96孔板,在37 ℃,5%CO2條件下孵育過夜。待細胞鋪板孵育過夜后,棄去原培養基,對不同組細胞進行轉染后,繼續培養48 h,棄所有培養基,加入100 μL含有10% CCK8溶液的培養基,于37 ℃,5%CO2條件下繼續培養3 h。使用分光光度計測定A450吸光度值,計算細胞增殖活性。
1.2.6.5茜素紅S染色檢測各組BMSCs成骨分化情況:收集各組BMSCs,以1×l05個/孔 接種于6孔板,使用茜素紅S染色,根據倒置顯微鏡下觀察結果,計數礦化結節數。評價標準:茜素紅染色后鈣結節呈橘紅色;一般情況下,正常組鈣結節數量多,骨質疏松時鈣結節數量少。
1.2.6.6油紅O染色檢測各組BMSCs成脂分化情況:收集各組BMSCs,以l×l05個/孔接種于6孔板,使用油紅O染色,在倒置顯微鏡下觀察結果,計數脂肪細胞數。
1.3 統計學分析
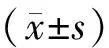
2 結果
2.1 各組大鼠骨密度、BGP和TALP含量檢測情況
檢測各組大鼠骨密度和血清中BGP和TALP含量。和NC組大鼠相比,OP組大鼠骨密度和BGP含量顯著降低,TALP含量顯著升高,差異具有統計學意義(P<0.05)。和OP組大鼠相比,OP+miR-494 inhibitor組大鼠骨密度和BGP含量顯著升高,TALP含量顯著降低,差異具有統計學意義(P<0.05)。和OP+miR-494 inhibitor組大鼠相比,OP+miR-494 inhibitor+TLR-4 vector組大鼠骨密度和BGP含量明顯降低,TALP含量顯著升高,OP+miR-494 inhibitor+sh TLR-4組大鼠骨密度和BGP含量明顯升高,TALP含量顯著降低,差異具有統計學意義(P<0.05)(表1)。
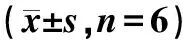
表1 各組大鼠血清中BGP和TALP含量比較Table 1 Comparison of BGP and TALP contents in serum of rats in each
2.2 各組大鼠BMSCs中miR-494和TLR4的表達情況
qRT-PCR檢測各組大鼠BMSCs中miR-494和TLR4 mRNA的表達情況,Western blot檢測各組大鼠股骨組織中TLR4蛋白的表達情況。和NC組大鼠相比,OP組miR-494、TLR4 mRNA和TLR4蛋白的表達顯著升高(P<0.05)。和OP組大鼠相比,OP+miR-494 inhibitor組miR-494、TLR4 mRNA和TLR4蛋白的表達顯著降低(P<0.05)。和OP+miR-494 inhibitor組大鼠相比,OP+miR-494 inhibitor+TLR-4 vector組TLR4 mRNA和TLR4蛋白的表達顯著升高;OP+miR-494 inhibitor+sh TLR-4組TLR4 mRNA和TLR4蛋白的表達顯著降低(P<0.05)。具體結果見表2。
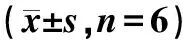
表2 各組大鼠BMSCs中miR-494和TLR4 mRNA的表達水平比較Table 2 Comparison of the expression levels of miR-494 and TLR4 mRNA in BMSCs of rats in different
2.3 miR-494和TLR4的靶向關系驗證
根據雙熒光素酶活性檢測結果顯示,miR-494和WT-TLR-4共轉染組(3.64±0.53)與miR-control和WT-TLR-4共轉染組(1.09±0.21)、miR-control和MUT-TLR-4共轉染組(1.13±0.26)、miR-494和MUT-TLR-4共轉染組(1.06±0.22)相比,熒光素酶活性顯著升高,差異具有統計學意義(P<0.05),而其他3組之間比較,熒光素酶活性無明顯變化(P>0.05)。
2.4 各組大鼠BMSCs的增殖能力比較
CCK8檢測各組大鼠BMSCs的增殖能力。結果顯示,和NC組相比,OP組細胞增殖能力顯著降低(P<0.05)。和OP組相比,OP+miR-494 inhibitor組細胞增殖能力顯著升高(P<0.05)。和OP+miR-494 inhibitor組相比,OP+miR-494 inhibitor+TLR-4 vector組細胞增殖能力顯著降低,OP+miR-494 inhibitor+sh TLR-4組細胞增殖能力顯著升高(P<0.05),具體結果見表3。
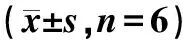
表3 各組大鼠BMSCs的增殖情況對比Table 3 Comparison of BMSCs proliferation in different groups of
2.5 各組大鼠BMSCs成骨分化和成脂分化比較
和NC組相比,OP組細胞礦化結節數顯著減少,脂肪細胞數顯著升高(P<0.05)。和OP組相比,OP+miR-494 inhibitor組細胞礦化結節數顯著升高,脂肪細胞數顯著減少(P<0.05)。和OP+miR-494 inhibitor組相比,OP+miR-494 inhibitor+TLR-4 vector組細胞礦化結節數顯著減少,脂肪細胞數顯著升高,OP+miR-494 inhibitor+sh TLR-4組細胞礦化結節數顯著升高,脂肪細胞數顯著減少(P<0.05),具體結果見表4。
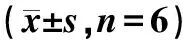
表4 細胞礦化結節數和脂肪細胞數對比Table 4 Comparison of the number of mineralized nodules and
3 討論
骨質疏松癥現在被認為是老年人的常見疾病,尤其是絕經后的老年婦女。卵巢功能退化引起的內分泌紊亂影響骨代謝,導致骨脆性增加,并隨著時間的推移破壞骨組織的內部結構。骨組織脆性的增加會導致受損骨骨折,進而導致畸形和功能喪失,嚴重時會影響心臟和肺功能。尤其是由于骨質疏松引起的骨折和畸形,住院時間延長,嚴重影響患者的生活質量。
microRNA可以改變破骨細胞和成骨細胞的活性。幾項臨床和臨床前研究發現,microRNA通過影響骨吸收、破骨細胞生成活性和骨形成來改變骨重建過程。miR-494作為microRNA家族成員之一,目前在惡性腫瘤中被廣泛研究。在本研究中,qRT-PCR檢測顯示在骨質疏松大鼠中miR-494的表達顯著升高。miR-494 inhibitor處理后,大鼠中miR-494表達顯著降低,說明miR-494 inhibitor處理大鼠,成功使骨質疏松大鼠中miR-494表達受到抑制。miR-494被抑制后,大鼠骨密度顯著升高,血清中骨密度指標BGP含量顯著升高,TALP含量顯著降低,大鼠骨質疏松程度明顯改善。BGP是維持骨組織正常鈣化的必需因子。TALP含量的升高可反應骨質疏松程度。以上結果證實miR-494在骨質疏松中存在表達差異,并可能通過影響大鼠骨形成,降低骨密度,進而加重骨質疏松。通過分離培養各組大鼠BMSCs,CCK8檢測結果顯示miR-494 inhibitor處理的大鼠BMSCs增殖能力顯著升高。同時細胞礦化結節數顯著升高,脂肪細胞數顯著減少,這表明miR-494可能是通過抑制骨髓間充質干細胞增殖和成骨分化,促進骨髓間充質干細胞成脂分化,進而影響大鼠骨形成,降低骨密度,進而加重骨質疏松。
目前的研究表明,Toll樣受體-4(TLR4)通路和骨質疏松之間存在密切的聯系[9]。TLR-4信號通路可能通過影響下游轉錄因子的表達,進而影響骨形成相關蛋白的表達,并進一步抑制成骨細胞的作用。同時TLR-4信號通路可以通過抑制成骨相關標志物的表達,導致成骨細胞增殖受到抑制,導致骨細胞中礦化結節數形成減少,從而抑制成骨細胞的礦化[10-11]。先前已通過初步探究miR-494可能和TLR-4之間存在調控關系[8]。本研究通過雙熒光素酶實驗報告顯示僅miR-494和WT-TLR-4共轉染的細胞相對熒光素酶活性顯著升高,這表明miR-494對相對熒光素酶活性的影響是通過促進TLR-4表達實現的,因此說明miR-494和TLR-4之間存在靶向關系。對骨質疏松大鼠進行miR-494 inhibitor和TLR-4 vector共處理,和miR-494 inhibitor單獨處理相比,大鼠骨質疏松程度明顯加重,細胞礦化結節數顯著減少,脂肪細胞數顯著增多,成骨分化被明顯抑制,成脂分化顯著增多。miR-494 inhibitor和shTLR-4共處理和miR-494 inhibitor單獨處理的大鼠相比,可發現大鼠骨質疏松程度進一步改善,細胞礦化結節數顯著增多,脂肪細胞數顯著減少,成骨分化抑制明顯減輕,成脂分化顯著減少。以上結果表明,miR-494可能通過促進TLR4通路的表達,抑制骨髓間充質干細胞增殖和成骨分化,促進骨髓間充質干細胞成脂分化,進而影響大鼠骨形成,降低骨密度,進而加重骨質疏松。
本研究通過構建骨質疏松大鼠模型并提取大鼠骨髓間充質干細胞,經過體內實驗探究miR-494在骨質疏松中的表達情況和調控機制,進一步完善骨質疏松的發病機制,并為臨床輔助診斷和治療骨質疏松提供新的理論依據。本研究主要的不足之處包括未更深入探究miR-494在骨質疏松中的調控網絡,進一步完善miR-494的調控機制。

