利用圖表表征法 提高化學解題有效性
沈 萍
(昆山經濟技術開發區高級中學,江蘇 蘇州 215300)
新課程改革背景下,隨著新高考制度的深入,高考化學試題更加貼近核心素養要求,注重學生能力的考查,要求學生能夠利用圖表特征,有效解答化學問題,提高學生綜合能力.對于高中學生來說,其思維能力從具體向抽象過渡,但是學生對實物敏感度較高.因此,高中化學教師需要根據化學題型講授圖表表征法的應用方式,明確問題解題步驟,提高學生的解題有效性.
1 利用表征法,解答無數據題目
在高中化學解題中,無數據題目較多,面對此類型題目,學生常常不知如何入手.因此,教師可以引入表征法,分析其中的物質關系,明確問題解答思路,提高學生解題效率與準確性.
例1在燒杯中裝有質量分數未知的AgNO3溶液,向溶液中加入足量的KI溶液,使用玻璃棒攪拌,使其充分反應,此時燒杯中的溶液質量與加入的KI溶液質量相同,求燒杯中AgNO3溶液的溶質質量分數.
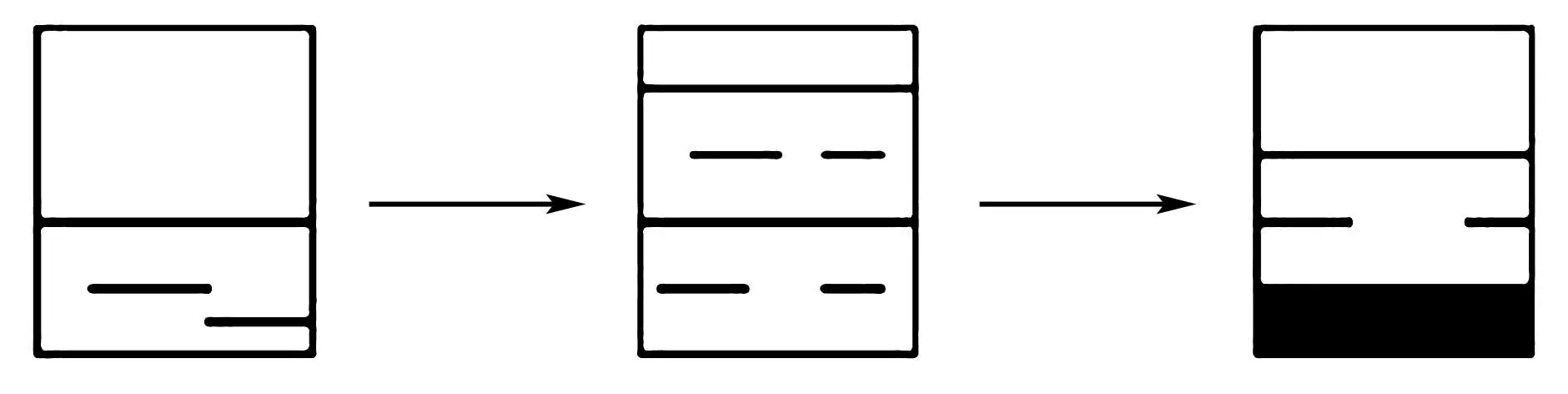
圖1 例1題圖

2 利用表征法,解答多解問題
在高中化學解題中,多解類型的題目是學生失分較多的題目,此類題目感覺并不難,學生會覺得比較容易,但是解題時難度比較大.對于此類題目,引入表征法,簡化題目信息,明確其中的邏輯關系,完成問題解答[1].
例2將30 mL 1 mol/L的AlCl3的溶液加入燒杯內,再向燒杯中加入4 mol/L的NaOH溶液,充分反應,產生0.78 g沉淀,求加入的NaOH溶液的體積.
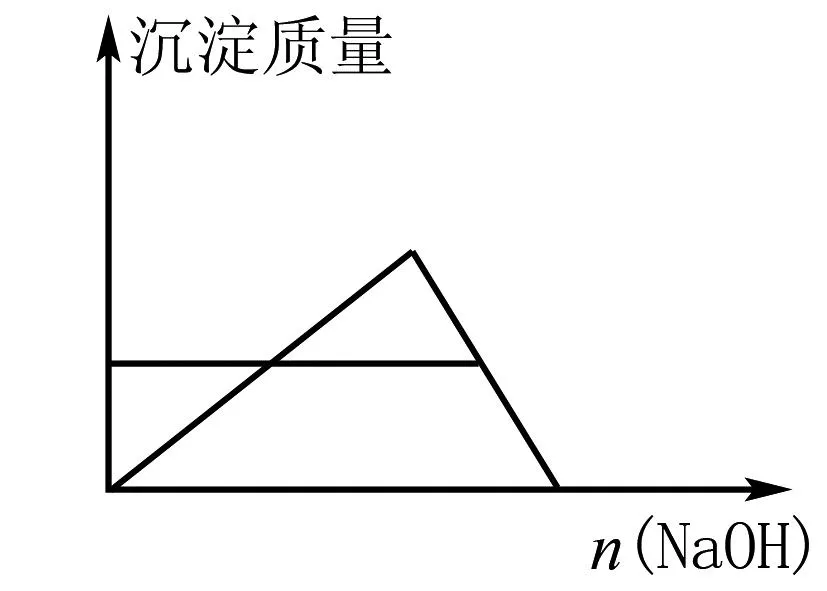
圖2 例2題圖

3 利用表征法,解決平衡問題
在高中化學教學中,化學平衡問題是重要的題目類型,也是學生學習中的難點問題.結合可逆反應,根據相應的條件,對正、逆反應速率進行對比,得出反應物與生成物處于平衡狀態的濃度.在化學平衡中,影響因素比較多,如濃度、壓強、溫度、催化劑等,所以在解題中,平衡移動屬于難點問題.因此,教師可以引入表征法,形象化地展示平衡移動,結合平衡移動的過程,明確解題思路,掌握解題方法[2].
例3N2與H2在一定條件下可以發生反應生成NH3,達到平衡狀態,之后,向密閉容器中加入He,(1)如果體積不變,則反應物濃度____(變大、變小、不變),反應速率____(變大、變小、不變),化學平衡____(向正反應方向移動、向逆反應反向移動、不移動);(2)如氣體壓強不變,那么氣體總物質的濃度____(變大、變小、不變),化學平衡____(向正反應方向移動、向逆反應反向移動、不移動).
分析對于此題,教師可以讓學生根據題意,畫出相應的圖表,如圖3所示.通過對圖表進行觀察可以了解到壓強變化,濃度不變,則反應速率不改變,平衡沒有發生移動,能夠幫助學生快速解答問題.
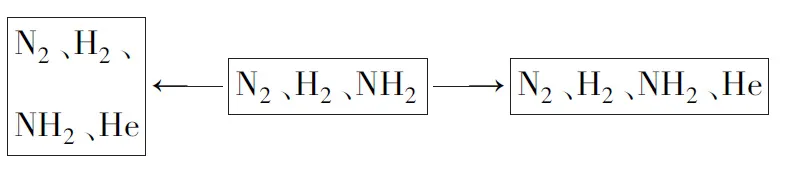
圖3 例3題圖
4 利用表征法,解決流程圖題
流程圖類型的題目涉及到的知識內容比較多,具有綜合性的特點,要求學生具備較強的邏輯思維能力.因此,在解題中,要求學生對流程圖步驟進行分析,了解每個反應的條件,分析關鍵物質的性質,理解流程圖中基本操作步驟的目的,系統全面掌握其中的信息,有效解答流程圖問題[3].
例4在工業中,使用強氧化劑PbO2制備KClO4的流程如圖4所示,下述有關流程的說法中,錯誤的是( ).
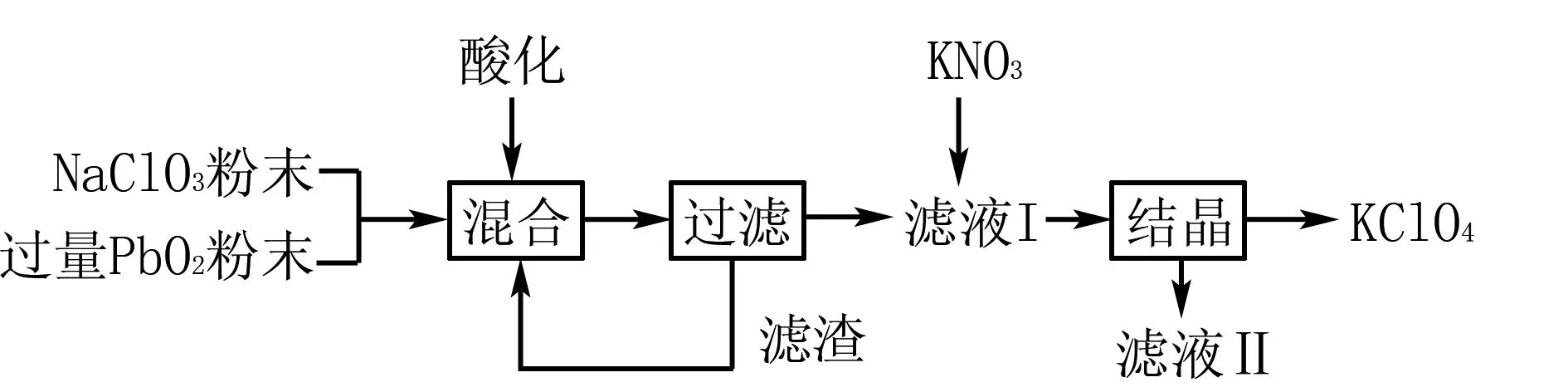
圖4 制備KClO4的流程
A.在“酸化”時,可以使用濃鹽酸
B.“濾渣”中的主要成分是PbO2粉末,可以循環使用

D.結晶中析出KClO4,表明KClO4在水中的溶解度小于NaClO4
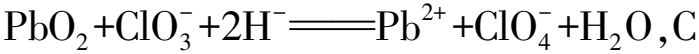
5 利用表征法,解決圖像問題
在高中化學解題中,圖像類問題是常見的題型,通常考查學生對實驗操作以及操作方法的掌握,要求學生掌握實驗操作中的注意事項,通過對坐標曲線圖像中的點與線進行分析,找出有效的信息,根據題目要求完成解題[4].
例5將某稀硫酸和稀硝酸的混合溶液200 mL平均分成兩等份.向其中一份逐漸加入銅粉,最多溶解19.2 g,另外一份逐步加入鐵粉,生成氣體質量與鐵粉質量的變化如圖5所示,已知硝酸只能夠被還原為NO氣體.下述表達中錯誤的是( ).
A.在第二份溶液中,最終的溶質為FeSO4

D.原混合溶液中,H2SO4的物質的量濃度為5 mol·L-1
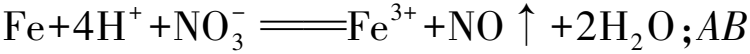
高中化學解題中,不同的題型有著不同的特點,找到正確的解題方式,能夠快速準確地解題.圖表類型的試題考查學生化學知識綜合應用能力,因此,高中化學教師要引導學生總結考點,分析常見題型的解題方式,總結解題規律,進而降低解題難度;還可引導學生利用圖表表征法,分析題目中的各種信息,提煉出有效的關鍵信息,提高其解題效率.

