涮辣和昆明皺皮椒Kas生物信息學及表達分析
周慧丹 李孟娟 吳睿 李平平 張芮豪 呂俊恒 鄧明華





摘要? [目的]探究涮辣與昆明皺皮椒3-氧酰基[酰基載體蛋白]還原酶(3-oxoacyl-[acyl-carrier-protein]synthase,Kas)的差異。[方法]特異性擴增了Kas,并進行了生物信息學分析。利用熒光定量 PCR 及酶活性測定方法測定了不同發育時期、不同環境及6種外源因子處理下 Kas 表達量及酶活性。[結果]擴增得到的涮辣和昆明皺皮椒 Kas 基因均為 1 467 bp,編碼 488個氨基酸。Kas為脂溶性、親水性的穩定蛋白,無信號肽與跨膜結構,主要定位于質膜。在不同發育階段,2種辣椒 Kas 表達水平與酶活性的趨勢均為先升高后急劇降低,且在大部分發育階段均表現為露地栽培高于大棚栽培;同一環境條件下,涮辣 Kas 表達與酶活性整體高于昆明皺皮椒;且不同外源物質在一定時間內可影響涮辣 Kas 的表達,其中MeJA和SA處理對Kas表達量影響較大。[結論]涮辣與昆明皺皮椒 Kas 基因和蛋白特性相似,但存在差異,在辣椒生長發育、環境和外源物質響應方面有重要功能。
關鍵詞? 涮辣;昆明皺皮椒;3-氧酰基[酰基載體蛋白]還原酶(Kas);生物信息學
中圖分類號? Q943.2? 文獻標識碼? A? 文章編號? 0517-6611(2024)01-0090-08
doi:10.3969/j.issn.0517-6611.2024.01.019
開放科學(資源服務)標識碼(OSID):
Bioinformatics and Expression Analysis of 3-oxoacyl-[acyl-carrier-protein]Synthase (Kas) from Capsicum chinense and C. annuum
ZHOU Hui-dan, LI Meng-juan, WU Rui et al
(College of Landscape and Horticulture, Yunnan Agricultural University, Kunming, Yunnan 650201)
Abstract? [Objective]To investigate the difference of 3-oxoacyl-[acyl-carrier-protein]synthase (Kas) between Capsicum chinense and C. annuum
. [Method]Kas was specifically amplified and bioinformatic analysis was performed.Kas expression and enzyme activity were determined by quantitative PCR and enzyme activity assay under different development stages, different environments and six exogenous factors. [Result]The Kas gene of Capsicum chinense and C. annuum was 1 467 bp, encoding 488 amino acids. Kas is a lipopolysaccharide, hydrophilic and stable protein with no signal peptide and transmembrane structure, which is mainly located in the plasma membrane. At different developmental stages, Kas expression level and enzyme activity of both kinds of capsicum were increased first and then decreased sharply, and in most developmental stages, they were higher in open field than in greenhouse cultivation. Under the same environmental conditions, Kas expression and enzyme activity in Capsicum chinense were higher than those in C.annuum. In addition, different exogenous substances could affect Kas expression in Capsicum chinense in a certain period of time, among which MeJA and SA treatments had a greater effect on Kas expression. [Conclusion]The Kas gene and protein characteristics were similar but different between Capsicum chinense and C. annuum,which had important functions in pepper growth and development, environment and foreign substance response.
Key words? Capsicum chinense;C.annuum;3-oxoacyl-[Acyl-carrier-protein]synthase (Kas);Bioinformatics
基金項目? 國家自然科學基金項目(32160708);云南省科技計劃項目(202102AE090005,202205AR070001)。
作者簡介? 周慧丹(1998—),女,云南昆明人,碩士研究生,研究方向:蔬菜遺傳育種。
*通信作者,教授,博士,從事園藝植物生物學研究。
收稿日期? 2023-02-06
辣椒(Capsicum annuum L.)為茄科辣椒屬的一年生或者有限多年生的草本植物。辣椒在全世界種植廣泛,我國是辣椒的生產大國,種植歷史已有300余年。辣椒是維生素和色素的來源之一,常被用作蔬菜、香料[1]。涮辣是云南省特有的種質資源,主要分布于云南省的德宏、保山和西雙版納等地,喜溫耐熱,成熟果實色澤艷麗鮮紅,最主要的是其辣度可與墨西哥的魔鬼椒以及印度的斷魂椒相媲美,做菜時可在湯里涮涮,整鍋湯就會有辣味,故取名為“涮辣”[2-4]。辣椒的特點是味道辛辣,這是由于存在一組被稱為辣椒素的化合物,該類物質主要在辣椒屬果實的胎盤中特異合成[5]。這些次生代謝物具有一系列的生物活性和工業應用,例如,辣椒素對于植物保護抵御一些食草動物、昆蟲和微生物是重要的,并且可以作為鳥類傳播種子的選擇劑[6-7]。辣椒素類物質具有多種藥理作用,已被用于制造個人化學防御裝置以及用于緩解關節炎、皰疹或腫瘤切除術后疼痛的護墊和乳膏等[8-12]。辣椒素類物質只在辣椒屬中合成和積累,研究辣椒中辣椒素的形成機制,對于提高辣椒素產量具有重要意義。
辣椒素主要在辣椒果實的胎盤組織中合成[13],并在開花后10~20 d開始積累,20~40 d增加,達到最大值后遞減[14]。辣椒素是通過源自類苯丙酸途徑的香草胺及源自支鏈脂肪酸途徑的一系列支鏈脂肪酸部分縮合而成的。苯丙氨酸是苯丙素生物合成的主要前體,而纈氨酸或亮氨酸是支鏈脂肪酸合成的前體底物,最終用于辣椒素生物合成[15]。由于植物的遺傳組成不同,辣椒果實可以表現出不同程度的辣味,但是辣味也依賴于果實的發育階段和辣椒生長的環境條件[16-17]。在辣椒素生物合成途徑中,3-氧酰基(酰基載體蛋白)還原酶(Kas)位于脂肪酸合成支鏈上。Kas 與酰基轉運蛋白酶(Acl)和 ACP-酰基硫酯酶(FatA)組成了脂肪酸合酶(FAS)復合體,催化脂肪鏈的延伸[18]。Aluru等[19]從辛辣型辣椒品種Habanero果實的胎座中篩選到8個編碼辣椒素生物合成活性物質的cDNA克隆,并發現其中3-酮酯酰-ACP合成酶基因(Kas)、依賴磷酸吡哆醛的轉氨酶基因(pAmt),乙酰輔酶A轉移酶基因(4A1)是胎座特異表達基因。Del等[20]基于基因沉默(VIGS)法沉默Comt、pAmt和Kas基因,發現沉默后的辣椒果實中辣椒素積累減少,由此證實了辣椒素的積累與Kas等基因的表達相關。利用病毒介導的基因沉默技術研究了Comt、pAmt 和Kas基因表達水平與辣椒素的積累量關系。任何一個基因Comt、pAmt 和 Kas的沉默都會導致辣椒素含量的急劇下降。雷建軍等[21]獲得了5個辣椒轉錄因子,同時利用基因沉默等技術解釋了pAMT、Kas等基因對辣椒素含量的正向指導作用。辣椒素的合成積累與環境條件也密切相關,有研究表明,在干旱、高溫、光照條件下辣椒素類物質的積累增加[22-25]。Medina-Lara等[26]研究表明,氮肥顯著增加了辣椒的生長和果實產量,同時辣椒素含量也維持在較高水平。Tewksbury等[27]在對野生辣椒調查中指出,總辣椒素含量隨著海拔的升高而顯著增加。大量研究表明,一定濃度的外源激素處理能顯著提高辣椒果實中辣椒素類物質的積累。較低濃度的水楊酸和茉莉酸甲酯噴施有利于辣椒素和二氫辣椒素的積累[28],脫落酸處理能顯著提高辣椒素的含量,并在各時期都與對照有顯著差異[29]。
涮辣的辣椒素含量極高,達19.814 8 mg/g,二氫辣椒素含量6.107 4 mg/g,辣度級別超過10級,且涮辣辣度為昆明皺皮椒的42.4倍[30]。筆者選取辣椒素積累差異較大的2個云南本地特色品種:涮辣和昆明皺皮椒作為試驗材料,研究辣椒素的合成。鑒于Kas在辣椒素生物合成方面的重要作用,且目前國內關于涮辣辣椒素合成與Kas酶的研究較少,為進一步探究涮辣辣椒素積累高的原因,以昆明皺皮椒為參照,從涮辣和皺皮椒中分離并鑒定了2條Kas基因,運用生物信息學方法分析Kas特性;利用qPCR方法測定了不同發育時期、環境條件下Kas表達水平,旨在探究涮辣與昆明皺皮椒Kas基因和酶的差異,與不同發育時期、環境條件和外源物質處理下Kas表達規律,并為解釋Kas在云南特色涮辣辣椒素積累方面提供理論借鑒與參考。
1? 材料與方法
1.1? 材料
涮辣和昆明皺皮椒都來自云南農業大學園林園
藝學院番茄辣椒實驗室,在后山露天和大棚2種環境條件下栽培。以花后每10 d為1個發育時期,選擇7個發育時期的辣椒果實為試驗材料,分別提取2種辣椒的RNA,再反轉錄為cDNA后進行Kas基因克隆,以下Kas 1為涮辣Kas,Kas 2為昆明皺皮椒Kas。
1.2? 方法
1.2.1? Kas基因的分離與鑒定。
在NCBI數據庫下載已有的CaKas基因序列,并根據序列設計引物(表1),委托北京擎科生物技術有限公司合成。使用北京華越洋生物技術有限公司的RNA提取試劑盒提取涮辣和昆明皺皮椒的總RNA,利用YEASEN公司的反轉錄試劑盒合成第一鏈cDNA。以cDNA為模板,使用上述引物進行PCR特異性擴增,凝膠電泳檢測后回收特異性PCR產物送北京擎科生物有限公司測序,得到目的片段序列。
1.2.2? 涮辣和昆明皺皮椒的Kas基因特性及蛋白特性分析。
按照表2所列方法對涮辣及昆明皺皮椒的Kas基因、蛋白特性進行分析。
1.2.3? 不同發育時期涮辣與昆明皺皮椒的 Kas 表達水平測定。
利用 Primer 6 設計 qRT-PCR 引物(表 1),對大棚和露天種植的涮辣和昆明皺皮椒以 10 d 為 1 個發育時期,共對果實 7 個發育時期的 Kas 表達水平進行測定,設置3個生物學重復。采用上述方法合成 cDNA。熒光定量 PCR 反應總體系 20 μL:SYBR Premix Ex Taq Ⅱ,10.0 μL,上、下游引物各 0.4 μL,cDNA 模板 2.0 μL,ddH2O 7.2 μL,在 Eppendorf 熒光定量 PCR 儀上進行反應。試驗采用相對定量的方法,以 ACTIN 基因為內參,使用 2-△△CT方法計算相對表達量。
1.2.4? 不同發育時期涮辣與昆明皺皮椒的Kas酶活性測定。使用植物(Plant)3-氧酰基-酰基載體蛋白還原酶(3-ACPR)ELISA檢測試劑盒進行測定,具體步驟按照試劑盒說明書進行。
1.2.5? 6種不同外源因子處理涮辣及其Kas表達水平測定。
采集涮辣花后 30 d 果實,用脫落酸(ABA,0.5 mmol/L)、赤霉素(GA3,0.5 mmol/L)、過氧化氫(H2O2,30%水溶液)、茉莉酸甲酯(MeJA,0.1 mmol/L)、水楊酸(SA,0.1 mmol/L)和褪黑素(MT,0.1 mmol/L)6 種外源物質分別對果實胎座進行不同時間處理(0、3、6、12、15 h),其中 0 h 為未處理樣品,以內參基因 ACTIN作為校正,測定 Kas 表達水平。
2? 結果與分析
2.1? 涮辣和昆明皺皮椒的Kas基因特性
2.1.1? Kas基因堿基序列對比。
以涮辣、昆明皺皮椒cDNA為模板進行Kas基因RT-PCR特異性擴增,對產物進行凝膠電泳驗證后測序。測序結果經BLAST驗證,涮辣Kas與NCBI 數據庫中Kas(GeneID:107864098)基因序列同一性為 98.91%,皺皮椒Kas高達99.39%。開放閱讀框預測顯示:涮辣和昆明皺皮椒Kas基因均由1 467 個堿基組成,編碼488個氨基酸殘基。與昆明皺皮椒相比,涮辣Kas存在7個SNP位點:68(T to G),192(T to C),571(A to G),745(G to T),774(G to T),975(G to A),1 221(T to C)。如圖1,氨基酸序列上存在3個SNP位點 23(V to G),191(T to A),249(A to S),其他堿基突變為同義突變。利用NCBI進行保守結構域預測發現,涮辣和昆明皺皮椒Kas基因的氨基酸序列在27~488這一位置上均有一段相同的結構域。
2.1.2? 辣椒及其他常見茄科植物Kas上游順式元件預測。
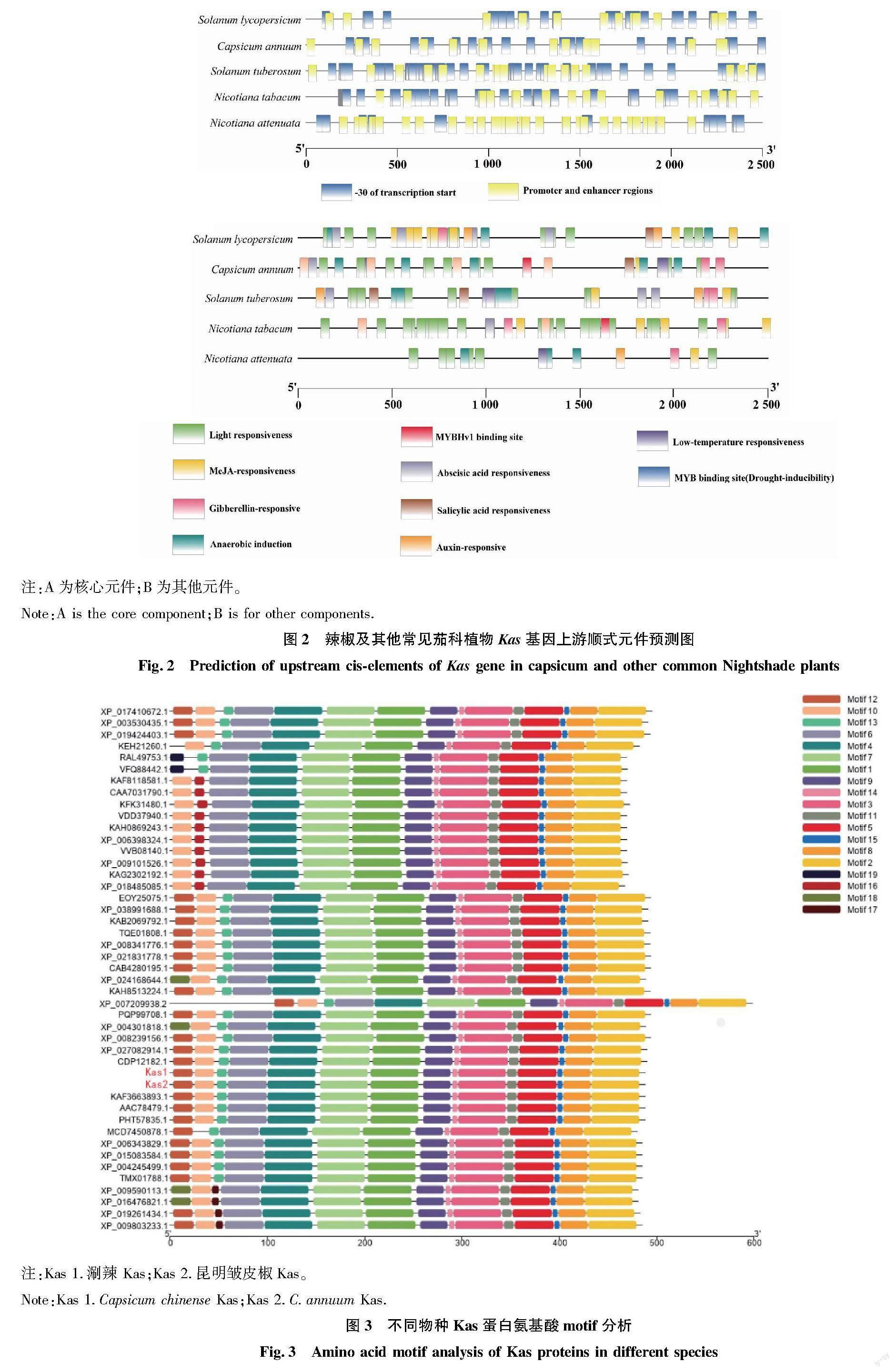
選擇包含辣椒在內共5種茄科植物Kas基因進行上游順式元件預測,對預測到的順式元件進行篩選后,共得到 584 個順式元件,其中辣椒(Capsicum annuum)93 個,番茄(Solanum lycopersicum)109 個,野生二倍體煙草(Nicotiana attenuate)83 個,煙草(Nicotiana tabacum)153 個,馬鈴薯(Solanum tuberosum)146 個(圖 2)。預測到的順勢元件按類型可分為核心元件:-30轉錄起始位點、啟動子和增強子區;植物激素響應元件:MeJA、GA、ABA、SA、Auxin響應元件;環境因子響應元件:光、低溫、厭氧誘導響應元件;MYB結合位點:干旱誘導結合位點和MYBHv1結合位點。在辣椒中除核心元件外,還有32個其他元件。包括環境因子響應元件:12個光響應元件,6個厭氧誘導響應元件,3個低溫響應元件;植物激素響應元件:MeJA、GA響應元件各2個,SA、ABA響應元件各1個;MYB結合位點:4個干旱誘導結合位點和1個MYBHv1結合位點。
2.2? 涮辣與昆明皺皮椒Kas的蛋白特性
2.2.1? 不同物種 Kas 蛋白保守結構。
選取包括茄科、十字花科、豆科、旋花科、錦葵科、茜草科和薔薇科7科共 45 條 Kas 氨基酸序列進行保守 motif 分析,結果(圖 3)顯示:共得到 19 個顯著保守的motif,其中,包括涮辣與昆明皺皮椒在內的所有植物都含有10、6、4、7、1、9、14、3、11、5、15、8、2不同保守motif。由此可推測,以上13個保守motif是Kas蛋白結構的重要組成部分,且是保證不同物種之間Kas功能相似的決定性結構。
2.2.2? 涮辣與昆明皺皮椒 Kas 理化性質及亞細胞定位預測。
蛋白理化性質預測結果顯示:涮辣與昆明皺皮椒Kas蛋白分子式分別為C2302H3666N644O704S22和C2306H3674N644O704S22,相對分子量分別為52 333.64和52 389.75,理論等電點(PI)均為7.98,均為脂溶性、親水性的穩定蛋白。 BUSCA 預測結果顯示,涮辣與昆明皺皮椒 Kas 定位在質膜上的確定性為 0.700。
2.2.3? 涮辣與昆明皺皮椒的 Kas 蛋白二級結構。
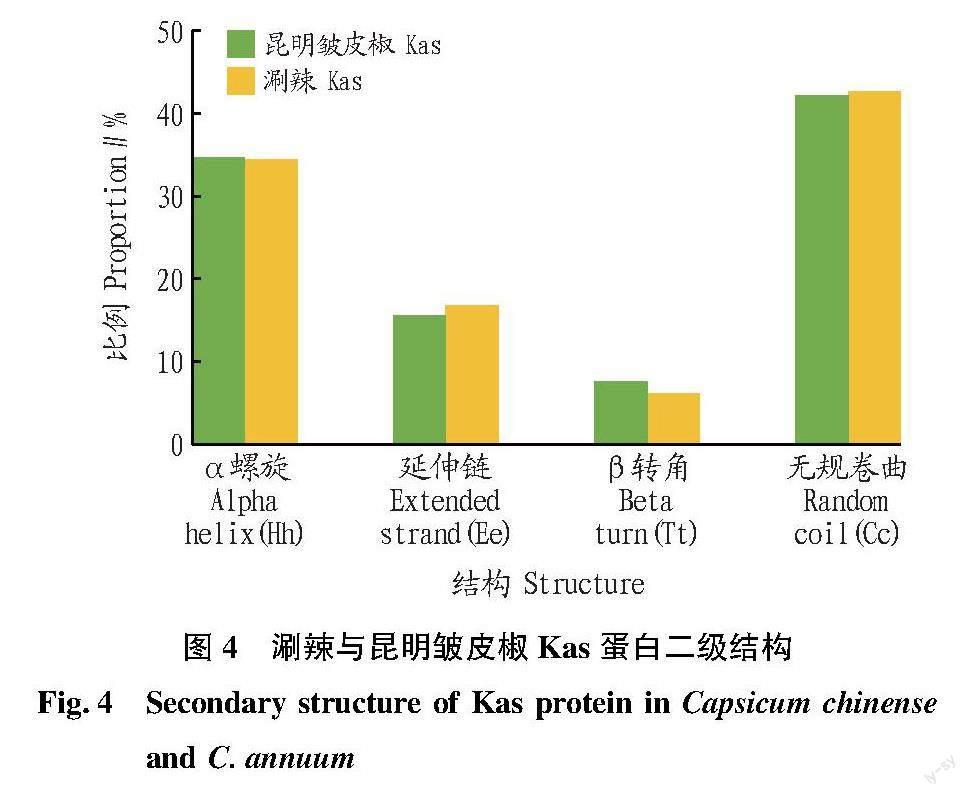
對2種辣椒Kas蛋白的二級結構進行了預測,結果顯示:涮辣和昆明皺皮椒Kas蛋白均含有α螺旋、延伸鏈、β轉角和無規卷曲4種二級結構,其中α螺旋和無規卷曲占主要部分(涮辣77.05%;昆明皺皮椒76.84%),涮辣Kas蛋白中無規卷曲和延伸鏈多于昆明皺皮椒,而α螺旋和β轉角少于昆明皺皮椒(圖4)。
2.2.4? 涮辣與昆明皺皮椒Kas蛋白的三級結構。
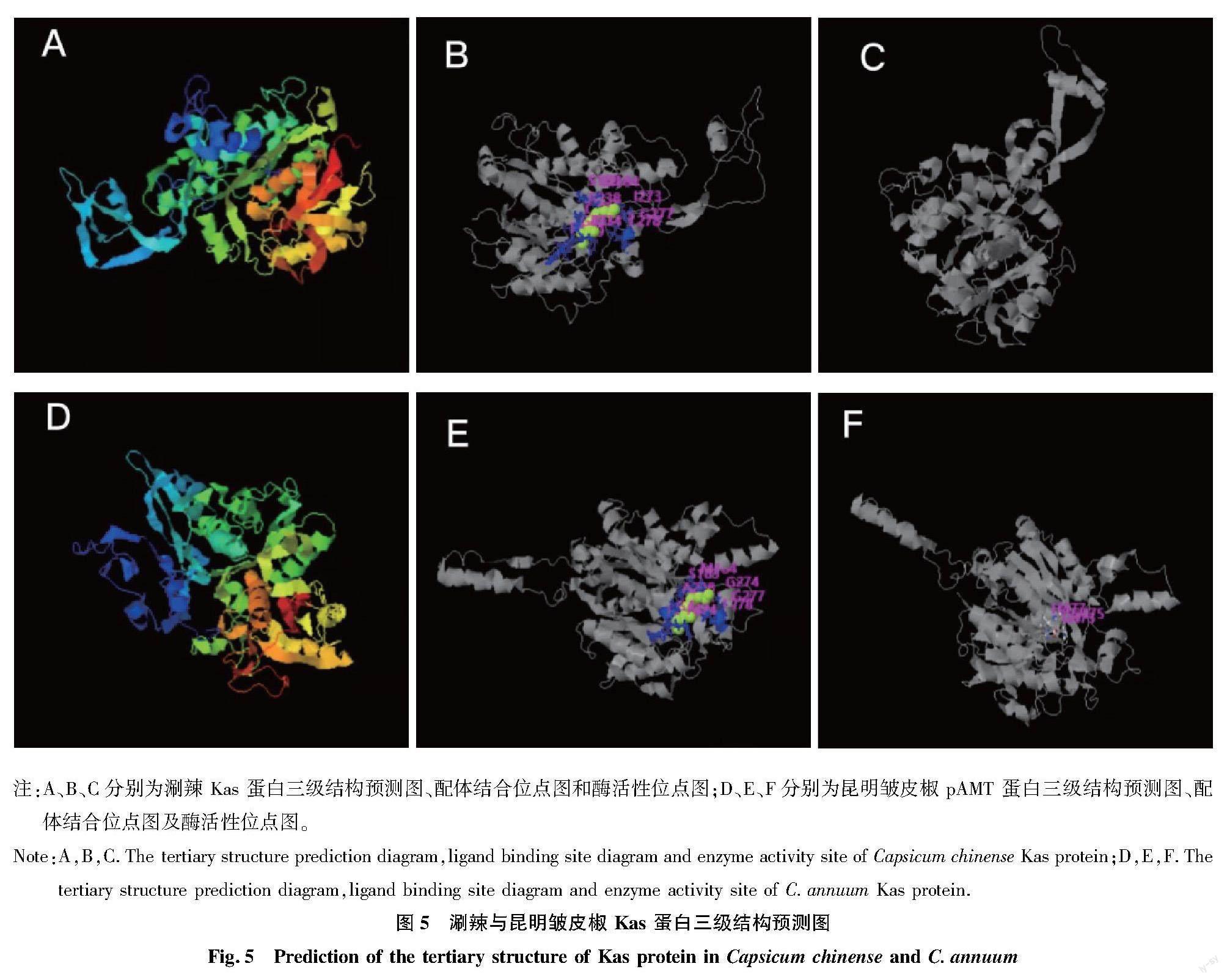
利用 I-TASSER 預測 pAMT 三級結構模型,其中C 值代表模型置信度,范圍為-5~2 ,得分越高代表模型越可靠。涮辣共構建出5個模型,其中C值最高為-0.83(圖5A);昆明皺皮椒也構建出5個模型,其中最高得分為-0.53(圖5D)。同時對Kas配體結合位點進行預測,其中C值為預測置信度,范圍在0~1,C值越大代表準確度越高。涮辣Kas預測C值為0.43,配體名稱為CER,結合位點殘基為183、184、238、239、273、277、278、379、415、472、473、474(圖5B);昆明皺皮椒配體結合位點得分為0.51,配體名稱也為CER,結合位點殘基為183、184、238、239、274、277、278、379、415、472、473、474(圖5E)。然后對Kas Enzyme Commission numbers(EC)和酶活性位點進行預測,其 CscoreEC值在 0~1,值越大代表 EC 值置信度越高。涮辣Kas CscoreEC最高為0.314,EC號為2.3.1.86,無活性位點殘基(圖5C);昆明皺皮椒CscoreEC最高為0.414,EC號為2.3.1.41,活性位點殘基為473、475、477(圖5F)。
2.2.5? 涮辣與昆明皺皮椒 Kas 蛋白信號肽、跨膜結構與磷酸化位點預測。
SignalP-5.0與TMHMM Server v.2.0預測結果顯示,涮辣和昆明皺皮椒的Kas均無跨膜結構和信號肽。運用NetPhos 3.1 Server對涮辣與昆明皺皮椒Kas蛋白磷酸化位點進行預測,同時對預測位點在0~1進行打分,預測位點可信度隨得分從0.5到1.0增加而增大,涮辣Kas評分≥0.5的磷酸化位點有63個,昆明皺皮椒有67個。以不同磷酸化類型來分,涮辣與昆明皺皮椒Kas都有13種Y型,而S型和T型存在差異,其中涮辣有36個S型,14個T型;昆明皺皮椒有39個S型,15個T型(圖6)。
2.2.6? 不同物種Kas系統發育樹構建。
以選取的包括涮辣和昆明皺皮椒在內共45條Kas序列構建進化樹(圖7),結果表明:不同Kas序列在系統發育上按照茄科、十字花科、豆科、旋花科、錦葵科、茜草科和薔薇科7個不同的科聚為四大類群。其中,茄科植物中Kas又分出眾多亞支。涮辣和昆明皺皮椒Kas與同科同屬的C.chinense(AAC78479.1)和C.annuum(KAF3663893.1)在系統發育上親緣關系最近,與C.baccatum(PHT57835.1)最遠;不同屬中,與茄屬的親緣關系最近;不同科中,與茜草科最近,與豆科親緣關系最遠。
2.3? 涮辣與昆明皺皮椒Kas基因表達及酶活性
2.3.1 不同環境條件下涮辣與昆明皺皮椒Kas基因表達。
Kas基因的表達在材料和環境間的差異十分顯著。Kas基因在涮辣和昆明皺皮椒果實發育過程中的變化趨勢基本一致,都是在果實發育前期(1~20 d)維持在一個較低的表達水平,但不斷升高;在果實發育中期(30~50 d)維持在一個非常高的水平,其中在50 d達到最高值,是0 d的130倍左右;在果實發育的后期(60~70 d)維持在一個較低水平,且不斷下降,但表達水平顯著高于果實發育前期。在同一環境條件下,涮辣的表達水平要高于昆明皺皮椒;在同一材料中,大棚表達水平要顯著低于露地表達水平(圖8)。
2.3.2? 在果實不同發育階段和環境條件下Kas酶活性差異。
Kas酶活性在涮辣和昆明皺皮椒果實發育過程中的變化趨勢基本一致,即在果實發育前期(0~20 d)維持在較低水平;在果實發育中期(30~50 d)維持在較高水平,并在花后50 d達到最高值;在果實發育后期(60~70 d),維持在較低水平,且不斷下降。對同一材料果實同一發育階段而言,大棚環境下Kas酶活性要低于露地環境。Kas 酶活性在不同材料間差異顯著。在果實發育初期,涮辣和昆明皺皮椒Kas酶活性均處于較低水平,但涮辣Kas酶活性要高于昆明皺皮椒;在果實發育中期,涮辣Kas酶活性要顯著高于昆明皺皮椒,且在花后40 d差異達到最大;在果實發育后期,涮辣Kas酶活性仍高于昆明皺皮椒(圖9)。
2.4? 不同外源物質處理對涮辣Kas基因表達的影響
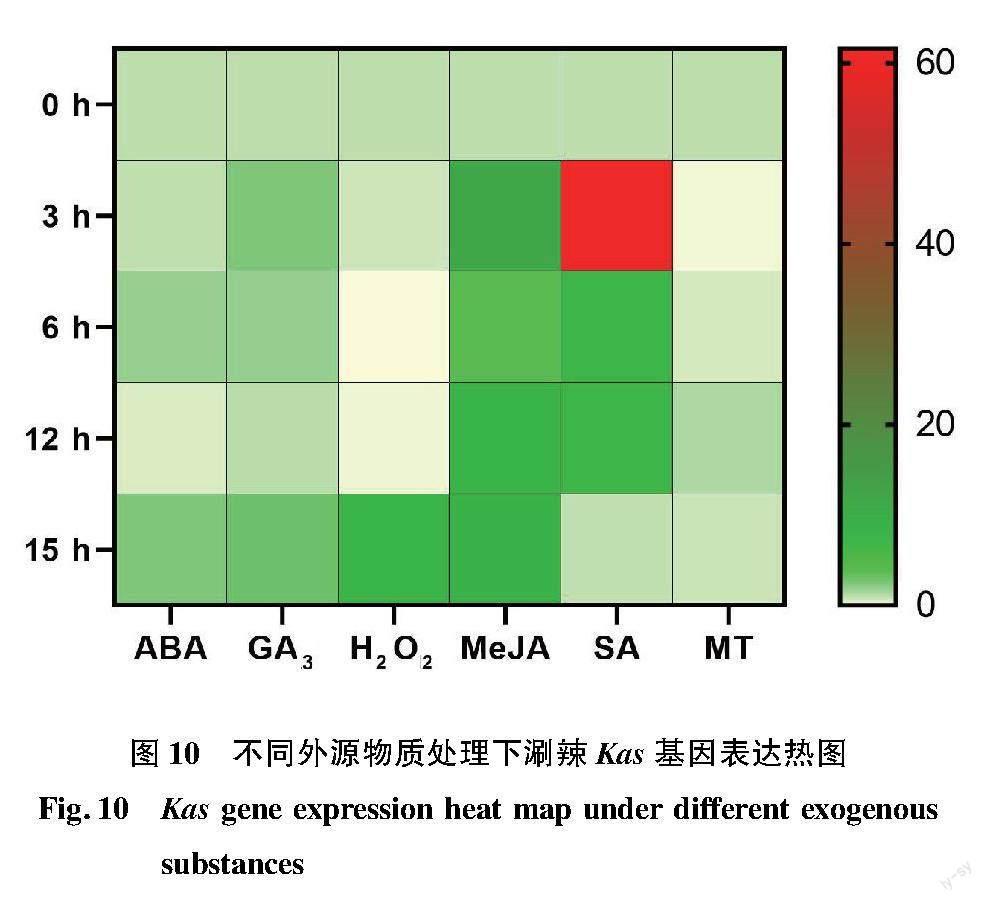
整體上看,Kas基因的表達量對MeJA和SA處理的反應最為明顯。實時熒光定量結果表明,Kas基因的表達量在ABA處理下隨處理時長的變化而變化,整體呈上升趨勢,在3 h略微下降,6 h迅速上升,隨后在12 h急速下降,15 h又上升;GA3處理下隨處理時間的延長呈上升—下降—升高的變化趨勢,其中15 h的表達水平最高;在H2O2處理下呈先下降后上升的變化趨勢,其中15 h的表達水平最高,在3~6 h持續下降,12~15 h上升;MeJA處理下呈上升—下降—上升的趨勢,其中3 h表達水平最高,于6 h迅速下降,于12 h繼續上升,15 h變化趨于平緩;在SA處理下隨處理時間的延長呈先上升后下降趨勢,其中3 h表達水平最高,從6 h開始持續下降;在MT處理下隨處理時間的延長呈下降—上升—下降的趨勢,在3 h下降,6~12 h上升,在12 h的表達水平最高,于15 h再次下降(圖10)。
3? 討論
3.1? 2種辣椒的pAMT基因及蛋白結構差異影響辣椒素合成
辣椒素生物合成經過由苯丙氨酸途徑形成香草胺或經支鏈脂肪酸途徑,由纈氨酸或亮氨酸形成支鏈脂肪酸,最終香草胺和支鏈脂肪酸合成辣椒素,而Kas催化脂肪鏈的延伸。阮文淵等[31]擴增得到辣椒Kas基因DNA序列,研究結果表明,Kas主要在胎座上表達并影響辣椒素的合成。該研究利用基因克隆方法,從涮辣與昆明皺皮椒中分離并鑒定了二者的Kas基因。2種辣椒的Kas長度為1 467 bp,各自編碼488個氨基酸殘基。以昆明皺皮椒作為參考,發現盡管二者序列大小相同,但在涮辣Kas中存在7個SNP位點,最終導致形成3個氨基酸殘基SNP位點。因此,涮辣Kas的突變可能是其產生高含量辣椒素的正向突變。
通過對不同物種Kas氨基酸序列保守motif分析,在一定程度上反映了Kas有較高的保守性,但部分物種Kas包含特有motif,也說明不同物種對Kas蛋白功能的需求存在差異。同時,不同辣椒Kas蛋白保守結構間的差異可能是辣椒素生物合成產生差異的重要原因。涮辣Kas基因的突變導致二者蛋白的二級和三級結構也發生了改變。相對于昆明皺皮椒二級結構,涮辣Kas蛋白含較少的β轉角和α螺旋以及較多的無規卷曲、延伸鏈。預測的涮辣和昆明皺皮椒Kas的三級結構模型結果顯示,2種辣椒的Kas配體名稱均為CER,但二者配體結合位點存在不同,涮辣配體結合位點殘基為183、184、238、239、273、277、278、379、415、472、473、474;昆明皺皮椒結合位點殘基為183、184、238、239、274、277、278、379、415、472、473、474。同時預測的涮辣EC號為2.3.1.86,無活性位點殘基;昆明皺皮椒EC號為2.3.1.41,活性位點殘基為473、475、477。Kas活性位點的差異,可能導致了涮辣和昆明皺皮椒Kas在底物和反應特性的不同,進而影響辣椒素的合成。總而言之,Kas基因突變引起的蛋白結構差異是影響涮辣與昆明皺皮椒辣椒素含量的重要原因。
3.2? Kas參與環境、外源因子對辣椒的調控,且影響辣椒素積累
通過NCBI公共數據庫,下載了包括辣椒在內的5條茄科植物Kas上游2 500 bp序列,并對其順式元件進行了預測。結果表明,辣椒Kas基因的表達調控受到SA、MeJA等植物激素、光及低溫的調控。通過對涮辣果實胎座進行6種外源植物激素處理后發現,SA、MeJA等外源物質在一定時間內影響涮辣Kas基因表達,同時這些結果在前人報道中也得了驗證[32-34]。基于qPCR技術對涮辣和昆明皺皮椒Kas表達水平進行了測定和分析,結果表明,Kas基因的表達在不同環境和材料間差異顯著,均呈先升高再急劇下降趨勢。許多研究也發現,辣椒素含量隨果實發育階段呈現先升高后降低的趨勢,且辣味程度與Kas表達呈正相關[35-39]。進一步解釋了辣椒發育過程中辣椒素積累與Kas的關系。該研究中,對同一材料果實同一發育階段而言,大棚環境下Kas酶活性和表達均低于露地環境,故推測露地與大棚2種不同的栽培條件下環境因子的差異對Kas酶活性及表達有影響,如低溫等因素可能誘導辣椒Kas較高表達,以產生較多次生代謝物質來抵御環境脅迫。因此,環境因素、發育時期和外源因子可通過調控Kas的表達來影響辣椒中辣椒素的積累。在同一栽培環境下,涮辣Kas的酶活性和表達均高于昆明皺皮椒,推測涮辣Kas基因的高表達可能是其辣椒素含量極高的原因之一。
4? 結論
特異性擴增得到涮辣和昆明皺皮椒Kas基因,生物信息學分析表明,涮辣與昆明皺皮椒Kas基因和Kas蛋白存在差異,在進化關系上具有保守性。同時Kas在涮辣和昆明皺皮椒生長發育過程中有重要功能,并且參與外源物質的調控。
參考文獻
[1]唐勝球,董小英.辣椒素的生理功能及應用前景[J].糧油食品科技,2002,10(6):25-27.
[2]鄧明華,文錦芬.云南涮辣的生物學特征及其栽培技術要點[J].辣椒雜志,2008,6(1):19-20.
[3]顧曉振,鄭宇峰,張正海,等.云南地方辣椒品種涮辣和雀辣的植物學分類[J].植物遺傳資源學報,2016,17(5):809-814.
[4]楊照輝,熊荔芳.不同栽培環境下涮涮辣生理性狀研究[J].現代農業科技,2019(4):53-55,61.
[5]鄧明華.辣椒色素與辣椒素的遺傳與分子調控機制研究進展[J].湖南生態科學學報,2019,6(2):43-51.
[6]TEWKSBURY J J,NABHAN G P.Directed deterrence by capsaicin in chillies[J].Nature,2001,412(6845):403-404.
[7]LEVEY D J,TEWKSBURY J J,CIPOLLINI M L,et al.A field test of the directed deterrence hypothesis in two species of wild chili[J].Oecologia,2006,150(1):61-68.
[8]OCHOA-ALEJO N,RAMIREZ-MALAGON R.In vitro chili pepper biotechnology[J].Vitro Cell Dev Biol Plant,2001,37(6):701-729.
[9]MEGHVANSI M K,SIDDIQUI S,KHAN M H,et al.Naga chilli:A potential source of capsaicinoids with broad-spectrum ethnopharmacological applications[J].J Ethnopharmacol,2010,132(1):1-14.
[10]KHAN F A,MAHMOOD T,ALI M,et al.Pharmacological importance of an ethnobotanical plant:Capsicum annuum L.[J].Nat Prod Res,2014,28(16):1267-1274.
[11]SRINIVASAN K.Biological activities of red pepper(Capsicum annuum)and its pungent principle capsaicin:A review[J].Crit Rev Food Sci Nutr,2016,56(9):1488-1500.
[12]ANTONIO A S,WIEDEMANN L S M,VEIGA JUNIOR V F.The genus Capsicum:A phytochemical review of bioactive secondary metabolites[J].RSC Adv,2018,8(45):25767-25784.
[13]劉熠,劉峰,鄒學校.辣椒素類物質生物合成及相關調控基因研究進展[J].湖南農業科學,2020(9):109-111.
[14]ARCE-RODRGUEZ M L,OCHOA-ALEJO N.An R2R3-MYB transcription factor regulates capsaicinoid biosynthesis[J].Plant Physiol,2017,174(3):1359-1370.
[15]AZA-GONZLEZ C,NU'EZ-PALENIUS H G,OCHOA-ALEJO N.Molecular biology of capsaicinoid biosynthesis in chili pepper(Capsicum spp.)[J].Plant Cell Rep,2011,30(5):695-706.
[16]IWAI K,SUZUKI T,FUJIWAKE H.Formation and accumulation of pungent principle of hot pepper fruits,capsaicin and its analogues,in Capsicum annuun var.annuun cv. Karayatsubusa at different growth stages after flowering[J].Agric Biol Chem,1979,43(12):2493-2498.
[17]GURUNG T,TECHAWONGSTIEN S,SURIHARN B,et al.Impact of environments on the accumulation of capsaicinoids in Capsicum spp.[J].HortScience,2011,46(12):1576-1581.
[18]CHAPA-OLIVER A M,MEJA-TENIENTE L.Capsaicin:From plants to a cancer-suppressing agent[J].Molecules,2016,21(8):1-14.
[19]ALURU M R,MAZOUREK M,LANDRY L G,et al.Differential expression offatty acid synthase genes, Acl, Fat and Kas, in Capsicum fruit[J].J Exp Bot,2003,54(388):1655-1664.
[20]DEL ROSARIO ABRAHAM-JUREZ M,DEL CARMEN ROCHA-GRANADOS M,LPEZ M G,et al.Virus-induced silencing of Comt,pAmt and Kas genes results in a reduction of capsaicinoid accumulation in chili pepper fruits[J].Planta,2008,227(3):681-695.
[21]雷建軍,朱張生,孫彬妹,等.辣椒素類物質生物合成及其分子生物學機理研究進展[J].園藝學報,2018,45(9):1739-1749.
[22]WANG J,LIU Y,TANG B Q,et al.Genome-wide? identification? and? capsaicinoid biosynthesis-related expression analysis of the R2R3-MYB gene family in Capsicum annuum L.[J].Front Genet,2020,11:1-12.
[23]ESTRADA B,POMAR F,DAZ J,et al.Pungency level in fruits of the Padrón pepper with different water supply[J].Sci Hortic,1999,81(4):385-396.
[24]HAVKIN-FRENKEL D,PODSTOLSKI A,KNORR D.Effect of light on vanillin precursors formation by in vitro cultures of? Vanilla planifolia[J].Plant Cell Tissue Organ Cult,1996,45(2):133-136.
[25]RUIZ-LAU N,MEDINA-LARA F,MINERO-GARCA Y,et al.Water deficit affects the accumulation of capsaicinoids in fruits of Capsicum chinense Jacq.[J].HortScience,2011,46(3):487-492.
[26]MEDINA-LARA F,ECHEVARRA-MACHADO I,PACHECO-ARJONA R,et al.Influence of nitrogen and potassium fertilization on fruiting and capsaicin content in Habanero pepper(Capsicum chinense Jacq.)[J].HortScience,2008,43(5):1549-1554.
[27]TEWKSBURY J J,MANCHEGO C,HAAK D C,et al.Where did the chili get its spice? Biogeography of capsaicinoid production in ancestral wild chili species[J].Chem Ecol,2006,32(3):547-564.
[28]張子昕.極辣辣椒資源鑒定及辣味基因的表達譜分析[D].海口:海南大學,2015.
[29]李維.脫落酸與鎘處理對辣椒果實中辣椒素的調控研究[D].長沙:湖南農業大學,2009.
[30]張祥,劉雨婷,張婧柔,等.涮辣與昆明皺皮椒pAMT生物信息學及表達分析[J/OL].分子植物育種,2021-09-24[2022-12-04].https:∥kns.cnki.net/kcms/detail/46.1068.s.20210923.1600.009.html.
[31]阮文淵,賈承國,李彥磊,等.辣椒中辣椒素生物合成途徑基因Kas克隆及表達研究[J].東北農業大學學報,2011,42(1):103-108.
[32]張子昕,黃祖梅,成善漢,等.SA和MeJA處理對‘鬼椒王’果實胎座辣椒素類物質含量的影響[J].熱帶作物學報,2015,36(10):1791-1795.
[33]彭瓊,童建華,黃志剛,等.茉莉酸甲酯和苯丙氨酸對辣椒果實品質的影響[J].植物生理學報,2012,48(7):654-658.
[34]GUTIRREZ-CARBAJAL M G,MONFORTE-GONZLEZ M,LMIRANDA-HAM M? D L,et al.Induction of capsaicinoid synthesis in Capsicum chinense cell cultures by salicylic acid or methyl jasmonate[J].Biol Plant,2010,54(3):430-434.
[35]KIM M,KIM S,KIM S,et al.Isolation of cDNA clones differentially accumulated in the placenta of pungent pepper by suppression subtractive hybridization[J].Mol Cells,2001,11(2):213-219.
[36]ZHANG Z X,ZHAO S N,LIU G F,et al.Discovery of putative capsaicin biosynthetic genes by RNA-Seq and digital gene expression analysis of pepper[J].Sci Rep,2016,6:1-14.
[37]FAYOS O,DE AGUIAR A C,JIMNEZ-CANTIZANO A,et al.Ontogenetic variation of individual and total capsaicinoids in Malagueta peppers(Capsicum frutescens)during fruit maturation[J].Molecules,2017,22(5):1-12.
[38]KONDO F,HATAKEYAMA K,SAKAI A,et al.The pungent-variable sweet chili pepper ‘Shishito’ (Capsicum annuum)provides insights regarding the relationship between pungency,the number of seeds,and gene expression involving capsaicinoid biosynthesis[J].Mol Genet Genom,2021,296(3):591-603.
[39]邵貴芳,王姣,趙凱,等.云南涮辣辣椒素積累與物質代謝關系的研究[J].辣椒雜志,2016,14(4):22-26.

