生脈方化學成分及分析方法研究進展*
錢紫萱,孫雪楊,張辰明,劉龍嬋,李林楠**,張皓月,楊 莉,3,王崢濤,3**
(1.上海中醫藥大學中藥研究所/中藥標準化教育部重點實驗室/國家中醫藥管理局中藥新資源與質量評價重點實驗室/上海市復方中藥重點實驗室 上海 201203;2.上海中醫藥大學中藥學院 上海 201203;3.上海中藥標準化研究中心 上海 201203)
經典名方生脈方由人參、麥冬和五味子三味中藥配伍組成,是中藥益氣養陰生津的代表方。該方最早見于金代張元素的《醫學啟源》,“麥門冬,氣寒,味微苦甘,治肺中伏火,脈氣欲絕,加五味子、人參二味,為生脈散,補肺中元氣不足”。方名“生脈”體現了其可“除沉疴、定回生”,“補肺中元氣不足”,用于治療氣陰兩虧,心悸氣短,暑熱汗多等[1]。根據組成不同,生脈方有人參方、黨參方之別,而人參方區分白參方(生曬參)與紅參方。近代又相繼研制出生脈飲、生脈顆粒、生脈袋泡茶、生脈膠囊、生脈注射液等劑型。這些制劑的制備工藝差別很大,有傳統煎煮,如生脈散(湯劑);有直接打粉,如生脈袋泡茶;有乙醇滲漉,如生脈飲(口服液)、生脈膠囊、注射劑(生脈注射液、注射用益氣復脈(凍干))等。上述制劑雖處方相同,但工藝流程不同,質量標準也參差不齊,大多數僅規定檢查了人參或五味子一種藥味的1 或2 個成分,導致最終產品中有效成分含量存在差異,難以保證臨床用藥的有效性和安全性(表1)。

表1 生脈方制劑的組方、制備工藝、定性鑒別和含量測定
本文通過以“生脈”、“復方化學成分、含量、測定”、“質量控制、指紋圖譜”等為關鍵詞檢索中國知網(CNKI)、PubMed、Web of Science(WOS)等國內外主流數據庫2010-2022 年的相關文獻(截止時間2022 年6 月),總結生脈方作為復方制劑的化學成分、質量標準及其分析方法,希望給經典名方的研究、開發和應用提供參考依據。
1 化學成分
生脈方由人參、五味子、麥冬三味藥組成。對復方的化學成分研究顯示,生脈方中包含多種皂苷、木脂素、黃酮類化合物,其中許多成分具有顯著藥理活性。王厚恩等[2]曾對生脈方化學成分進行了詳細總結,歸納了55 種人參皂苷、41種木脂素、7種麥冬皂苷、14種高異黃酮和7種其他類型化合物及其結構。本文在此基礎上進一步總結了2019-2022 年間新發現的化學成分[3],并補充完善了其中皂苷類成分的化學結構[4]。
1.1 皂苷類成分
1.1.1 人參皂苷
皂苷類化合物是生脈方中含量最高的成分,主要來自人參,少部分來自麥冬。其中人參皂苷主要包括達瑪烷型三萜皂苷,是生脈方的主要活性成分。目前生脈方中的人參皂苷類型包括原人參三醇型(Protopanaxatriol type,PPT)、原 人 參 二 醇 型(Protopanaxadiol type,PPD)皂苷、齊墩果酸型人參皂苷(Olenolic acid)、C-17 側鏈型皂苷(C-17 side chain)及其他皂苷[5-6]。近年新發現的人參皂苷類成分以PPT型皂苷為主,其化學結構總結如下(圖1,表2)。

圖1 生脈方中的人參皂苷化合物結構

表2 生脈方中的人參皂苷類化合物
1.1.2 麥冬皂苷
目前生脈方中共鑒定到13 種來源于麥冬的皂苷成分(圖2,表3),大部分屬于甾體皂苷,王厚恩等[2]總結了其中7種。其結構類型主要為螺甾烷醇型[9],皂苷元大多數為魯斯可皂苷元。近年又鑒定得到多種麥冬皂苷成分,其結構總結如下(表3)。
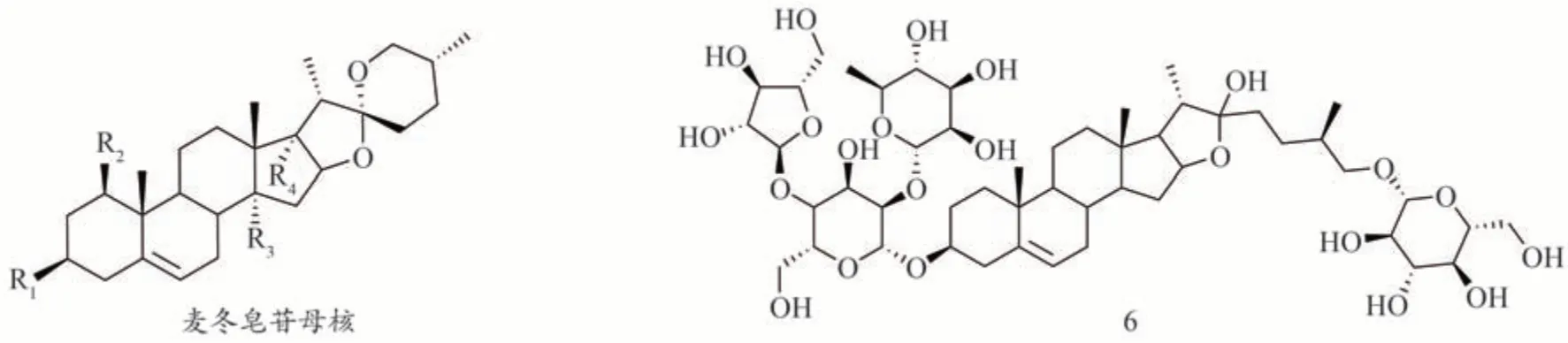
圖2 生脈方中麥冬皂苷類成分的結構

表3 生脈方中的麥冬皂苷類化合物
1.2 其他化學成分
除皂苷類成分外,生脈方中鑒定得到類型豐富的木脂素化合物和高異黃酮化合物。木脂素類成分主要來源于五味子,代表性成分包括五味子醇甲(Schizandrol A)、五味子醇乙(Schizandrol B)、五味子甲素(Schisandrin A)等[11]。高異黃酮類成分在植物中較為少見,主要分布在百合科沿階草屬Ophiopogon中[12],生脈方中鑒定得到的黃酮類化合物均來自麥冬。生脈方中的其他結構類型的化學成分的研究也有相關文獻報道,包括L-borneol-7-O-[β-D-apiofuranosyl(1→6)]-β-D-glucopyranoside[4,10]、Isoheptanol 2-(S)-Oβ-D-xylopyranosyl-(1→6)-O-β-D-glucopyranoside[3]、5-Hydroxymethylfurfural (5-HMF)[10]、 4-allyl-1, 2-benzenediol1-O-α-L-rhamnpyranosyl(1→6)-O-β-Dglucopyranoside[4]、citronellol[4]等。此外,劉瑞等[13]檢測了生脈注射液中的琥珀酸、蘋果酸、檸檬酸等有機酸成分;聶黎行等[14]對生脈注射液中的氨基酸進行檢測,確定含有門冬氨酸、蘇氨酸等16種氨基酸成分。
2 復方化學成分變化
中藥復方與單味藥的作用存在顯著差異。經過配伍或煎煮后,中藥復方的化學成分可能發生改變。研究復方配伍煎煮過程中的化學成分之間的相互作用與單味藥材化學成分的變化關系是闡明復方配伍化學效應的必要研究內容。
2.1 煎煮和提取過程中化學成分的轉化
大量學者對生脈散復方化學成分進行了深入研究[15-18]。結果顯示,生脈散經水煎煮后生成5-羥甲基糠醛(5-HMF),人參、麥冬、五味子在煎煮前均不含5-HMF,僅五味子單煎后能產生少量的5-HMF,而生脈散全方和麥冬五味子共煎液中5-HMF 的含量顯著增高[16]。后續研究表明,5-HMF 的形成可能與五味子的酸性有關,其含量隨麥冬用量的增加而升高[15]。研究顯示5-HMF作為中藥注射劑安全性評價的一部分,其本身及其降解產物都可能導致不良反應的發生,對其進行動態監測具有現實意義[19]。
中藥復方多味藥材在共同煎煮的過程中化學成分可能相互影響,發生變化。共煎過程中人參皂苷受五味子的酸性成分影響,達瑪烷型人參皂苷的C-20位糖苷鍵水解發生水解轉化;人參皂苷Rg、Rh1、Rh2等含量明顯增加,由微量成分轉化為主要成分[17]。復方中除五味子可對人參皂苷成分產生影響外,皂苷類化合物也可影響五味子的主要成分五味子醇甲的煎出。岳磊等[18]測定生脈散中全方及各配伍組五味子醇甲的含量,發現人參、麥冬、人參總皂苷、人參皂苷Rg1與五味子合煎均能提高五味子醇甲的含量。王慶慧[20]在生脈飲中五味子對麥冬化學成分的影響研究中發現,Methyl ophiopogonanone A 在麥冬、五味子復方中的含量降低,而Methyl ophiopogonanone B 在麥冬、五味子復方中的含量升高。
2.2 體內代謝轉化
生脈方中鑒定得到了多種化合物,揭示了生脈方藥效的物質基礎。而化合物只有在進入體內后才能發揮藥效,另外部分化學成分需要經人體代謝以代謝物的形式發揮藥效作用。生脈方各成分在體內的代謝轉化方式不同。Wang 等[9]從口服生脈散的大鼠血漿中鑒定得到多種化學成分的代謝產物,通過對比生脈散提取物和血漿成分的結果發現,血漿中出現了11 種新成分,是源于原型化合物的體內代謝物,除一種成分來自PPD 型人參皂苷,其他化合物均由木脂素schizandrol A 代謝而來,包括7, 8-dihydroxy-2-demethyl-schizandrin 和 7, 8-dihydroxy-3-demethylschizandrin 及其異構體、7,8-dihydroxy-schizandrin、7,8-dihydroxy-3-demethyl-schizandrin、7, 8-dihydroxy-2-demethyl-schizandrin、以及schizandrol A 的去甲基化代謝物。Zhan等[21]較為全面地研究了大鼠靜脈注射生脈注射液后體內PPD 型和PPT 型人參皂苷、麥冬皂苷D 的代謝情況。PPT 型人參皂苷快速通過膽汁、尿液和糞便消除;而PPD 人參皂苷從在膽汁、尿液中呈緩慢消除;麥冬皂苷D 則以次級代謝產物的形式消除。
中藥配伍后往往能產生一種或幾種原單味藥所不具備的效能。研究復方化學成分以及成分轉化的規律能從本質上揭示中藥復方藥理作用的物質基礎[22]。但目前針對生脈方復方化學成分變化和變化規律的研究較為缺乏,上述變化對生脈方藥效的影響仍需更深入的研究。
3 生脈方成方制劑的分析方法
以經典名方為代表的中藥成方制劑的質量控制已成為中藥研究的重點和難點。目前已有較多研究報道關于人參、麥冬、五味子中化學成分的理化分析方法,如采用薄層色譜法(TLC)、氣相色譜法(GC)、高效液相色譜法(HPLC)等對人參皂苷、麥冬皂苷、五味子木脂素進行定性、定量分析。但生脈方制劑過程中各有效成分易發生反應相互作用,僅以單一指標成分的含量作為評價指標,無法全面表征成方制劑的質量。因此建立有效檢測多指標成分的分析方法,全面進行制劑質量評價,已成為生脈方質量控制的研究熱點。目前最為常用的檢測方法是液質聯用分析(LCMS)和氣質聯用分析(GC-MS)等。此外,一些快速測定生脈方制劑中化合物的方法,如紅外光譜法(IR)、紫外-可見分光光度法(UV-Vis)、毛細管電泳法(CE)等也有應用。本文系統總結了近年來關于生脈方及其制劑的分析方法,以期為其質量控制、成分分析以及合理應用提供基礎(表4-7)。
表4 生脈制劑中單一藥味的分析方法研究進展

表5 生脈口服制劑中多成分的分析方法研究進展

表6 生脈注射制劑中多成分的LC-MS分析方法研究進展

表7 生脈制劑的指紋圖譜分析方法研究進展
3.1 薄層色譜法
《中國藥典》(2020 年版,一部)采用TLC 法對生脈飲中的紅參、麥冬、五味子進行定性鑒別;對生脈膠囊,同樣采用了TLC 法定性鑒別紅參、麥冬、五味子3 味藥材。文惠玲等[23]用TLC 鑒別了生脈飲超微提取物中的人參二醇和人參三醇,并對比了高壓差法和滲漉法,發現高壓差法提取得到種類更豐富,含量更高的人參皂苷。高效薄層色譜法(HPTLC)能顯著提高薄層板的分離能力[24],故Xie等[25]采用HPTLC對11個廠家的生脈膠囊和顆粒的樣品進行分析,發現在加工過程中人參皂苷Rb1、Re和Rg1等藥效成分發生明顯降解。
3.2 高效液相色譜法和液質聯用法
HPLC 廣泛應用于中藥的特征圖譜、指紋圖譜分析及主要成分的含量測定。《中國藥典》(2020 年版,一部)規定生脈飲的HPLC 定量測定以五味子醇甲作為對照品,對其他有效成分未做要求;規定用HPLC 法對生脈膠囊進行含量測定時,僅對制劑中的人參皂苷Rg1和Re做含量要求。目前藥典方法對生脈制劑的質量缺乏全面整體的控制。
色譜法與其他技術聯用被廣泛用于表征生脈方中的特征性成分,以及同時測定多種成分的含量。蒸發光散射檢測器(ELSD)作為通用檢測器,其信號響應只與待測物的質量有關,與待測物的光學特性無關,對無紫外吸收或僅有紫外末端吸收的物質如糖類[26]、皂苷類[27]、甾類等均有較好響應。苗圃等[28]建立了HPLC-ELSD 聯用的方法,檢測了生脈注射液中果糖、葡萄糖、蔗糖和麥芽糖等成分。與傳統HPLC 法對比,超高效液相色譜(UPLC)在分離效果和檢測時間等指標均有顯著提升。柴瑞平等[29]采用UPLC-DAD 法建立了生脈注射液中多成分的定量方法,結合中藥色譜指紋圖譜相似度評價系統標定了44 個共有峰,在35 min內檢測到11種活性成分的含量。
近年來,LC-MS 憑借其分離選擇性好、靈敏度高、能給出復雜樣品中化合物成分結構信息等優勢,而被廣泛用作生脈制劑中多種成分群的鑒別。Wu 等[8]采用UPLC-MS 法,在14 min 內獲得生脈散的質譜信息,鑒定了92 個化合物,主要為皂苷和木脂素類成分,并在生脈散中首次發現25-羥基人參皂苷類成分。Li 等[4]對生脈注射液進行分析,初步鑒定了62 個化合物,同時定量分析了其中21種成分的含量。
利用四級桿串聯飛行時間質譜(Q-TOF-MS)可滿足質量分辨率高、定性準確的分析要求。王若柳等[30]采用LC-IT-MS 檢測到參麥注射液中的74 個化合物,再按照LC-QTOF-MS 提供的信息,推測鑒定出其中的64 個化合物,其中大部分化合物來源于紅參,而來源于麥冬的化合物較少。褚延斌等[31]首次建立了益氣復脈(凍干)的UPLC-Q-TOF-MSE指紋圖譜,利用QTOF-MSE得到化合物的相對分子質量、質譜碎片離子信息后,結合參考文獻及對照品信息,指認了16 個共有色譜峰,為制劑的整體質量評價提供科學依據。
基于診斷片段的擴展策略(DFIBES),可以將復雜的色譜峰快速分類到已知的化學家族中,從而簡化結構鑒定的復雜程序。考慮到某個化合物家族如人參皂苷和木脂素,通常會產生相同的碎片離子,Zheng等[7]提出了一種改良的DFIBES 方法,能夠有效處理質譜獲得的信息,并對生脈注射液中的30 多種皂苷類和20 種木脂素類化合物加以鑒定。針對生脈制劑成分復雜,分離難度大,對照品緊缺和檢測成本高等諸多問題,一測多評法(QAMS)與HPLC 聯用可實現多成分的質量控制,降低檢測成本。梁悅等[32]使用QAMS 并以人參皂苷Rb1為內標,同時測定多個成分的含量,建立HPLC 特征圖譜,對生脈注射液中的各藥材同時進行定性、定量控制。李佳寅等[33]采用HPLC聯合QAMS法對生脈注射液中的人參皂苷和木脂素類成分開展多指標定量分析,選擇人參皂苷Rb1作為對照品,節約了檢測成本。
3.3 氣相色譜法
目前氣相色譜法用于生脈方的研究較少,對于五味子揮發性成分的鑒別具有較高的應用價值,文獻多采用水蒸氣蒸餾法提取[34]。為了避免水蒸氣在GC 分析過程中對色譜柱的影響,吳建國等[35]采用固相萃取法與GC-MS 相結合的方法建立五味子揮發性成分的9個特征峰的指紋圖,并指認了其中最大的2個峰分別為α-松油醇和4-萜品醇。聶黎行等[14]以生脈注射液中的單體成分群為切入點,對糖類、氨基酸類、皂苷類、有機酸類化學成分進行了表征,通過GC-MS 法確定了糖類的主要組成成分,通過高效離子交換色譜-柱后衍生化技術確定了結合及游離氨基酸的種類,并利用分子排阻色譜結合ELSD 對大分子物質的檢測做了初探。
3.4 紅外光譜法
紅外指紋圖譜是由化合物中化學鍵振動轉動而產生的特征信息,具有特征性和指紋性,在中藥材鑒別分析中有著重要的運用。趙楊等[36]通過傅里葉紅外光譜色譜結合液質聯用技術分析了生脈飲中的皂苷類成分。韓曉萍等[37]采用近紅外光譜法快速測定注射用益氣復脈(凍干)中人參皂苷的總量,建立了10種人參皂苷含量的定量模型,預測值與測定值的相關系數高達0.953,可用于大批量樣品的快速測定。
3.5 紫外-可見分光光度法
基于UV-Vis 的分析方法是待測物分子對光的選擇性吸收而建立的全波長掃描技術,更能全面反映樣品中不飽和化學鍵的特征規律信息,在實際應用中有著樣品前處理簡單、分析時間短、檢測成本低等特點。孫寧[38]采用香草醛比色法對生脈飲中的人參總皂苷含量進行測定,再利用高氯酸法對生脈飲中的總皂苷含量進行測定,確定了測量結果后建立換算系數法,從而計算得到麥冬總皂苷的含量。梁悅等[39]通過紅外光譜儀輔助紫外指紋圖譜對生脈注射液進行質量控制,發現不同批次樣品間質量差異較大,較單一成分定量測定更能全面反映整體情況,但是該實驗收集到的樣本量較少,有待進一步研究。
3.6 毛細管電泳法
CE法是以高壓電場為驅動力,以毛細管為分離通道的一種分離技術,以其高效、快速、成本低等優點被廣泛應用。當生脈散提取液用HPLC 分析時,一些色譜峰較難分離。此外,在樣品預處理如固相萃取和液-液萃取時,也會損失一些有效成分。季一兵等[40]采用序貫式均勻設計的方法優化CE 分離條件,確認了中藥復方生脈散中20個主要的共有指紋峰。Fan 等[41]使用了膠束電動力學毛細管色譜模式來建立生脈散的指紋圖譜。采用正交設計和順序統一設計來篩選重要參數和優化分離條件。方法驗證包括注射精度、樣品穩定性測試和穩健性測試。此外,基于回歸分析的建模方法被應用于與所提出的優化方法的比較,該方法為中藥材的指紋開發提供了新的思路。
3.7 其他分析方法
凝膠滲透色譜(GPC)是通過多孔性的凝膠分離大分子的方法。由于生脈制劑中除了皂苷類和木脂素類等主要活性成分,還存在如蛋白質、糖、鞣質等大分子,作為中藥注射制劑時存在一定的安全隱患[42],建立GPC 分離方法可有效除去某些大分子對制劑臨床使用的不利影響。彭菲等[43]進一步優化開發了GPCELSD 法并對注射用益氣復脈(凍干)中可能存在的糖苷類大分子進行檢查。
Q-標志物(Q-marker)是為中藥制品的質量評估和生產過程控制而設計的,具有傳遞性和可追溯性[44]。Zhao 等[45]建立了UPLC-DAD 和HPLC-ELSD 聯用技術來分析生脈注射液中Q-marker 的含量。該研究首先利用UPLC-QTOF-MSE 定性鑒別出了生脈注射液中的87種化學成分。通過追蹤主要化學成分并結合“蜘蛛網”模式的全面評估,篩選出了6 種化學物質作為Q-markers。Zheng 等[46]首次嘗試通過結合化學和生物活性的一致性來評估生脈方整體質量一致性。通過指紋圖譜-藥效關系分析發現了代表生脈方藥效的成分,并作為進一步控制生脈方批次間有效一致性的標志物。
綜上所述,生脈方成方制劑的分析方法目前已取得一定進展,但由于中藥復方化學成分的復雜性以及存在配伍轉化、體內外代謝變化等情況,結合臨床療效研究,更加全面、準確的解析其功效物質基礎,并建立科學、合理、先進的質量評價體系仍然是今后一段時期亟待解決的問題。
4 總結和展望
生脈方作為經典名方沿用至今,隨著目前對其化學成分分析和藥理研究的不斷深入,生脈方的主要活性成分及其作用機制等已得到初步的闡明。但現階段對生脈方中活性成分的研究仍然以皂苷類和木脂素類化合物為主,對于高異黃酮成分的研究相對缺乏。此外,在量-效關系,以及潛在毒性等方面的研究較少。從質量評價的角度,單用薄層色譜法或氣相色譜法對于質量控制效果不佳,為了整體分析生脈成方制劑,分析方法以高效液相色譜法與質譜聯用為主,可同時滿足定性和定量需求。
生脈方及其成方制劑充分體現了中藥多成分多靶點的特點,對其進行系統性的歸納總結可為經典名方的后期開發利用及質量評價提供理論依據。從目前研究的劑型來看,生脈注射劑的相關研究最多,質量控制也相對嚴格,其次是生脈飲。雖然制劑種類繁多,但是少有研究關注到不同劑型間差異,而目前僅聚焦于單味藥物的研究難以反映不同劑型間的差異。如根據組成藥物的不同,生脈方成方制劑有人參方和黨參方之別,但是關于此二者的化學成分對比、藥理活性對比、指紋圖譜對比等研究較少。另外,僅靠單一成分分析和指紋圖譜研究,也很難反映不同劑型間的差異。若是能以多種共有成分作為參照,在此基礎上建立不同劑型的指紋圖譜,能夠直觀準確地比較生脈系列不同劑型間成分的含量區別。后續對于生脈方的研究逐漸科學和完善,有利于在國家推進中醫藥傳承創新背景下,加快對含有經典名方的新藥及大健康產品的持續開發和應用。

