刺激響應型SERS探針在分子醫學領域的應用
徐逸婷,羅奧雅,曲家毅,肖嘉祥,董 倩*
(1.湖南科技大學 化學化工學院,湖南 湘潭 411201;2.湖南大學 化學化工學院,分子科學與生物醫學湖南省重點實驗室,湖南 長沙 410082;3.湖南大學 化學化工學院,化學生物傳感與計量學國家重點實驗室,湖南 長沙 410082)
拉曼光譜技術基于拉曼散射現象,即單色光(通常是激光)與樣品相互作用并散射其分子。散射的光由于分子的振動能級而發生頻率偏移,從而產生包含對應于不同分子振動的特征峰的拉曼光譜,是一種用于研究分子振動模式的強大光學技術,能夠提供檢測物的化學成分、分子結構和相互作用等有價值的信息[1-2]。拉曼光譜的非侵入性和無標記性使其在醫學應用中具有極大吸引力[3]。表面增強拉曼(SERS)和針尖增強拉曼(TERS)現象被發現以來,拉曼技術已能夠實現對微量目標分子的檢測,為分子醫學領域的應用鋪平了道路。如今,SERS探針已被廣泛應用于生命醫學研究,幫助疾病診斷和藥物監測[4-7]。而刺激響應型表面增強拉曼散射(SR-SERS)是一種結合了表面增強拉曼散射原理和對外界刺激的響應性的特殊類型的光學傳感技術,通過對增強基底進行功能化修飾,可在特定的環境變化或刺激下改變其SERS 活性。這些變化包括pH 值、溫度、某些分子或離子濃度的變化,以及其他可以表明特定生理狀態或疾病狀況的因素。當探針與目標環境相互作用時,其SERS活性發生變化,導致拉曼散射信號發生可檢測的變化。SR-SERS 探針因其敏感性、特異性和實時監測能力,在醫學應用中具有巨大的潛力。本文對現有SR-SERS探針的設計原則和響應原理進行介紹,對其在分子醫學領域的應用進行綜述,并對其未來的發展趨勢和面臨的挑戰進行了討論,旨在較為全面、客觀地展現SR-SERS探針的發展情況。
1 刺激響應型SERS探針的響應原理
刺激響應型SERS探針通常包括3個組成部分:增強基底、刺激響應介質和拉曼報告分子,有些還包括輔助部分,主要用于提高探針的生物相容性、維持探針的結構穩定性,保障檢測的高靈敏度和高特異性。其設計和響應原理如圖1所示。其中刺激響應介質是實現目標物高特異性檢測的最關鍵部分。通過對分子結構和化學特性的設計,能夠實現SERS在復雜環境中對目標分子的精確捕獲[9];通過設計多種響應介質,可根據拉曼報告分子特征圖譜的差異,實現多目標分子的同時檢測[10]。常見的響應介質有聚合物[11-14]、DNA[15-19]、蛋白質/多肽[20-21]、有機小分子化合物[22-24]、無機化合物[25-27]等。值得注意的是,增強基底、響應介質、拉曼報告分子和輔助部分既可以是相對獨立的組件也可以是統一的整體,例如Chen 課題組和Liu 課題組合成的多種貴金屬石墨納米顆粒[28-29],通過石墨材料對金屬納米顆粒的包覆,提高了探針整體在復雜生理條件下的穩定性。此外,其石墨材料既可作為拉曼增強基底,又可作為輔助部分維持信號穩定,而修飾有核酸適配體的聚乙二醇烷基鏈則既可實現目標物的捕獲,又可作為輔助部分提高探針的生物相容性。SR-SERS 探針各部分的有機整合能夠實現對目標物高選擇性、高靈敏度、高響應性的檢測。

圖1 SR-SERS探針的設計和響應原理示意圖[8]Fig.1 Schematic diagram of the design and responsive mechanism of SR-SERS probes[8]
SR-SERS探針在待檢測分子或外部刺激與SERS探針的特定相互作用下可以激活探針體系產生SERS信號的變化,基于此可建立定性或定量檢測方法。這種SERS信號變化可分為信號強度變化和位移變化。
1.1 強度變化
SERS效應中拉曼散射信號的增強通常由兩種機制產生[30]:一是通過光場在金屬納米結構中的局部化而產生的電磁場增強,這種局部電磁場增強被稱為“熱點”(Hot spot)。當金屬納米粒子之間的距離減小,彼此間會產生更多“熱點”,并引發局部電磁場增強,獲得更強的拉曼信號;二是在分子或晶格與金屬納米結構接觸時,當被檢測分子與增強基底之間距離減小(通常要求小于2 nm),由于拉曼截面的增加而產生化學或電子增強,從而獲得更強的拉曼信號。上述兩種響應機制分別調控了增強基底之間的耦合距離或基底-報告分子之間的耦合距離。這種對距離的調控可通過在金屬納米粒子表面修飾響應介質實現。
調控增強基底之間的耦合距離:利用基底之間介質對外界刺激的響應,能夠引起體系中電荷[31-32]或親疏水性質[33-34]的變化,在靜電作用力或范德華力的作用下探針內部空間結構膨脹或坍縮,引起增強基底金屬納米粒子之間間隙的改變。
調控基底-報告分子之間的耦合距離:與控制基底之間的間隙不同,基底-報告分子距離調控主要是利用外界刺激改變增強基底與報告分子之間的距離,隨著報告分子與基底之間距離的增加,等離子共振耦合強度削弱,拉曼信號也隨之減弱。這種信號分子與基底的距離調控可采用中間介質空間結構轉變或與其它配體的結合競爭等策略實現。
上述兩種策略通常能夠帶來拉曼信號數十倍到數百倍不等的強度變化,極大提高了分析檢測的選擇性和靈敏度。然而,大部分探針通過靜電相互作用力或疏水作用力實現這種轉變,非鍵合力相對較弱,易受到體內生理環境的干擾。針對這一問題,有研究工作進一步設計了刺激響應的共價連接的SERS 探針。Huang 等[35]開發了一種pH 響應納米診療體系。在該系統中,模型藥物阿霉素(DOX)通過pH 響應的硼酸酯鍵連接在拉曼報告分子4-巰基苯基硼酸(4-MPBA)上。進入腫瘤后,硼酸酯在酸性環境中的斷裂導致DOX 的釋放和4-MPBA SERS 信號的恢復。通過4-MPBA SERS 光譜的實時變化可監測藥物的動態釋放情況(圖2A)。以人乳腺癌細胞(MCF-7)作為模型細胞,這種納米復合材料利用拉曼信號的變化實現了藥物信號的檢測,并通過光熱治療實現了對腫瘤細胞的高效抑制且在活體移植瘤模型中未發現明顯的副作用,顯示出其在實際應用中良好的生物相容性和卓越的SERS活性,為檢測其他藥物的釋放提供了有效方式。

圖2 pH響應共價連接型SR-SERS探針4-巰基苯基硼酸[35](A),基質金屬蛋白酶-2(MMP-2)敏感的比率型SR-SERS探針[36](B),膽汁多組分識別的位移變化型SR-SERS探針[37](C)Fig.2 pH response covalent linked SR-SERS probe,4-MPBA[35](A);rate-type SR-SERS probes sensitive to metalloproteinase-2(MMP-2)[36](B);displacement-varying SR-SERS probes for bile multi-component recognition[37](C)
然而,受到成像條件和外界環境的干擾,例如探針濃度、底物狀態以及激光聚焦深度等因素,拉曼絕對強度的分析已不能夠實現目標物的準確定量檢測。研究表明,設置對目標物分子或離子不敏感的內參分子信標,通過分析內參與響應性拉曼報告分子信號比率的變化可有效提高定量檢測的準確性。如圖2B,Zhong等[36]提出了一種基質金屬蛋白酶-2(MMP-2)敏感的比率型SERS納米探針。納米探針包含3 個組分:等離子體活性金納米粒子作為SERS 增強基質,拉曼染料羅丹明B(Rh B)標記的底物肽作為特異性MMP-2 識別元件,2-萘硫醇(2-NT)作為內標。MMP-2 響應性切割納米探針表面的肽導致Rh B的SERS信號減弱,其與內標2-NT的強度成比例變化,可定量反映MMP-2的活性水平,而MMP-2的活性可用于區分兩種不同惡性程度的乳腺癌細胞亞型。該工作利用具有較大拉曼截面積的拉曼報告分子Rh B 與化學惰性分子2-NT 結合,提高了納米探針的靈敏度和穩定性,使該探針可檢測生物樣本中MMP-2 酶活性,并實現了對正常的乳腺上表皮細胞和不同亞型的乳腺癌細胞中MMP-2 酶的可視化分析,為區分不同惡性程度的腫瘤細胞提供了極具可行性的檢測方案。
1.2 拉曼位移變化
除了調控強度變化以外,SR-SERS 探針還可通過構建與目標物發生作用前后散射光譜峰位移數與目標物濃度之間的關系對目標物進行檢測。這種針對指紋圖譜位移的分析有時能夠極大提高檢測的靈敏度和準確性。例如Bui 等[37]探索了一種間接響應多種膽汁成分的SERS 分析方法(如圖2C),在SERS襯底(Ni箔上的Au納米枝晶)表面修飾了4種具有不同官能團的烷硫醇分子作為膽汁成分響應的拉曼報告分子(—SH(CH2)2CH3、—SH(CH2)2NH2、—SH(CH2)2COOH 和—SH(CH2)2OH),每種報告分子具有特征指紋譜,且與膽汁純組分及膽汁水溶液相互作用時的SERS 峰明顯不同。分析結果表明,將—SH(CH2)2CH3和—SH(CH2)2OH 所獲得的光譜主成分評分組合后,基于k 近鄰法的鑒別準確率為100%,優于單獨使用底物的鑒別準確率(90.6%~96.9%)。這種由多種報告分子提供的互補的光譜信息提高了膽囊息肉和膽囊癌等疾病鑒別的準確性。
以上兩種響應原理各有優缺點。從檢測的靈敏度上來說,通常強度信號變化高于拉曼位移信號變化。這是因為區分小的拉曼位移信號(2~10 cm-1)變化需要更窄的光柵,同時還要滿足響應前后各譜峰相對分離、不重疊。而比率信號變化通過設置內參,有效提高了探針的抗干擾能力,準確性優于單純的強度信號變化[38];而基于拉曼位移信號變化原理,能夠對指紋圖譜中多個特征峰的位移變化進行同時分析,由于這些變化提供了樣品中分子鍵振動頻率的直接信息,相對于特定峰強度信號或比率信號變化,其檢測特異性更強,特別是在復雜混合物的定性分析以及微量化合物的檢測應用中[39-40]。例如Zheng 等[41]報道了一種基于單抗體、多變量回歸和峰移策略的等離子體拉曼免疫測定方法,用于血清生物標志物的檢測。通過對拉曼報告器振動的納米力學擾動而產生的具有特征的光譜變化,重新編碼了與捕獲的分析物相關的豐富信息。該工作通過融合拉曼光譜和化學計量分析,建立了用于生物標志物敏感檢測的拉曼頻移和多元回歸模型,實現了羊血清等樣品中生物分子的檢測。
2 刺激響應型SERS探針在分子醫學領域的應用
2.1 在疾病診斷中的應用
拉曼成像技術可在細胞水平乃至生物分子水平對復雜的生物體結構進行解析,對疾病診斷具有重要意義。本文將對不同響應刺激的探針在分子醫學領域的應用進行系統闡述。
2.1.1 pH 響應型SERS 探針生理局部pH 是一個動態平衡的指標。異常的pH 水平通常與疾病發生與發展密切相關。發展pH 響應型SERS 探針對這類pH 相關疾病的診斷可以起到輔助作用。pH 響應型SERS 探針通常由SERS 基底和pH 響應的介質或拉曼報告分子組成。介質或拉曼報告分子在外界pH 刺激下發生質子化/去質子化或者化合鍵斷裂/形成的過程,基于不同的響應機理,上述改變帶來信號強度或拉曼位移的變化,可用于檢測環境pH水平變化。例如Quazi等[31]合成了一種pH響應的多功能金納米粒子。通過在納米粒子表面引入混合層的熒光染料修飾的單鏈DNA(作為拉曼探針和帶負電荷的配體)和細胞色素C(作為pH 響應的電荷反轉配體),在腫瘤酸性環境中可逆調控了基底間的耦合距離。但這種以調控增強基底之間的耦合距離改變信號強度來測定pH的策略往往受到響應介質單一等電點的限制,無法滿足高分辨的pH測定。相比之下,通過觀測相應介質本身拉曼峰強比率信號的改變來監測pH水平能夠克服這一缺點。如圖3,Chung等[43]開發了一種可穿戴的柔性Au/TPU靜電紡納米纖維SERS貼片用于汗液pH 的傳感。該工作引入pH 響應分子4-巰基苯甲酸(4-MBA)和4-巰基吡啶(4-Mpy)作為pH 響應拉曼信號分子,結果顯示,通過分析4-MBA 的特征峰強度比能夠實現在pH 5.5~7.0 范圍內0.14~0.33 pH 的高分辨率檢測。該方法成本低,機械性能穩定,便于干燥室溫存儲,同時由于水分子可以快速滲透,可作為少量液體SERS基底用于汗液、血液、尿液等外周體液的檢測。pH響應型SERS探針在分子醫學領域中的應用如表1所示。

表1 pH響應型SERS探針在分子醫學領域的應用Table 1 The applications of pH responsive SERS probes in molecular medicine

圖3 基于SERS活性的靜電紡絲可穿戴汗液pH傳感器示意圖(A),以及利用4-MBA峰值比率標定pH曲線v(COO-)/v(ref)(B)和v(C=O)/v(ref)(C)[43]Fig.3 Schematic diagram of electrospinning wearable sweat pH sensor based on SERS activity(A);calibration curves of 4-MBA using intensity ratio of peaks v(COO-)/v(ref)(B) and v(C=O)/v(ref)(C)[43]v(ref) represented the peak value in 1 590 cm-1,which was assigned to the v8a ring breathing mode of the 4-MBA aromatic ring
2.1.2 溫度響應型SERS 探針溫度響應型SERS 探針較少用于生物體的測溫,其應用更多集中在利用溫度響應性調節耦合距離增強待測目標物的拉曼信號(見表2)。如圖4,Juang 等[48]利用溫敏性聚合物Pluronic?F127(F127)制備了一種帶有金納米顆粒(AuNPs)的熱響應性拉曼增強納米囊。F127的低共溶溫度(LCST)約為26.5 ℃,當溫度從15 ℃升至37 ℃時,F127 納米囊從親水性(溶脹)變為疏水性(皺縮),納米膠囊的尺寸會從160 nm大幅縮小到20 nm,使得AuNPs之間的距離顯著減小,從而增強了熱點效應,提高了SERS檢測的靈敏度,其對臨床樣本中難以檢測的羧基末端甲狀旁腺激素片段(PTH)的LOD 為10-6mol/L。這種無需額外熒光標記的SERS 檢測方法不但樣品前處理簡單,而且可快速分析待測物的濃度,因此在生物醫學、環境和臨床檢測中有廣闊的應用前景。

表2 溫度響應型SERS探針在分子醫學領域的應用Table 2 The applications of temperature responsive SERS probes in molecular medicine

圖4 AuNPs@Pluronic F127納米膠囊的熱響應性合成和檢測示意圖(A),及其對羧基末端甲狀旁腺激素片段(C-PTH)的SERS光譜(37 ℃>LCST)(B)[48]Fig.4 Schematic diagram of thermal response synthesis and detection of AuNPs@Pluronic F127 nanocapsules(A);SERS spectra of AuNPs@Pluronic F127 nanocapsules for carboxylterminal parathyroid hormone fragments(C-PTH)at 37 ℃ (above LCST)(B)[48]
2.1.3 代謝小分子響應型SERS 探針代謝物是參與體內各種生化通路的小分子物質。通過分析代謝產物,醫療人員可以了解與疾病相關的特定代謝改變。代謝物水平的變化常發生在出現明顯癥狀前,檢測這些變化有助于疾病的早期發現、監測和預后[52]。在眾多代謝物中,活性氧簇(如超氧化物陰離子、過氧化氫、羥基自由基、單線態氧等)廣泛參與細胞分化、增殖、腫瘤發生和免疫應答等多種生理或病理過程,而這種活性氧簇分子由于化學活性高,存在時間短,使得原位定量檢測H2O2存在挑戰。2021年,Li等[53]發展了一種新型核心-衛星納米金探針,該探針采取SERS 和光聲(PA)雙比率成像策略,在活體層面實現了對炎癥/癌癥相關活性氧簇的定量可視化檢測和治療(圖5)。在H2O2存在下,這種核心-衛星納米結構的外部AuNPs 首先發生解離,使4-巰基苯甲腈(MBN)在2 228 cm-1處的SERS 峰值強度減弱,而放置在介孔硅(MSNs)包覆金納米棒間隙(AuNNR)的2-萘硫醇(NAT)在1 418 cm-1處的信號不變,形成H2O2響應的I2228/I1418的比值SERS 信號。同時,在H2O2存在下,負載在MSNs 殼中的2,2'-聯氮雙(3-乙基苯并噻唑啉-6-磺酸)二銨(ABTS)轉化為氧化形式,750 nm 處的PA 信號增強,而1 250 nm 處AuNNR的PA 強度保持不變,產生比率PA750/PA1250信號。這一雙模態比率成像機制提高了檢測的準確性,為解構復雜的生理過程提供了有力的分析工具。除了可對代謝物進行原位檢測外,SERS技術還可實現體外高靈敏度的快速檢測以滿足臨床檢測的需要。例如Sahoo等[54]設計并構建了一種簡單、無標記、無預處理的潛在生物傳感器用于人血清中直接膽紅素(D-BIL)的快速檢測。該傳感器由銀納米線組成隨機交叉-木樁的納米結構(圖6)。這種三維富等離子體納米結構能夠提供豐富的空間熱點,具有較高靈敏度,對D-BIL的檢測限為10 nmol/L,且所需樣本極少,只需要10 μL人血清。這是利用SERS技術首次在臨床檢測范圍內檢測到D-BIL,為這類響應型SERS探針的臨床轉化提供了可能。代謝小分子響應型SERS探針在分子醫學領域的應用實例如表3所示。

表3 代謝小分子響應型SERS探針在分子醫學領域的應用Table 3 The applications of small molecular metabolite responsive SERS probes in molecular medicine
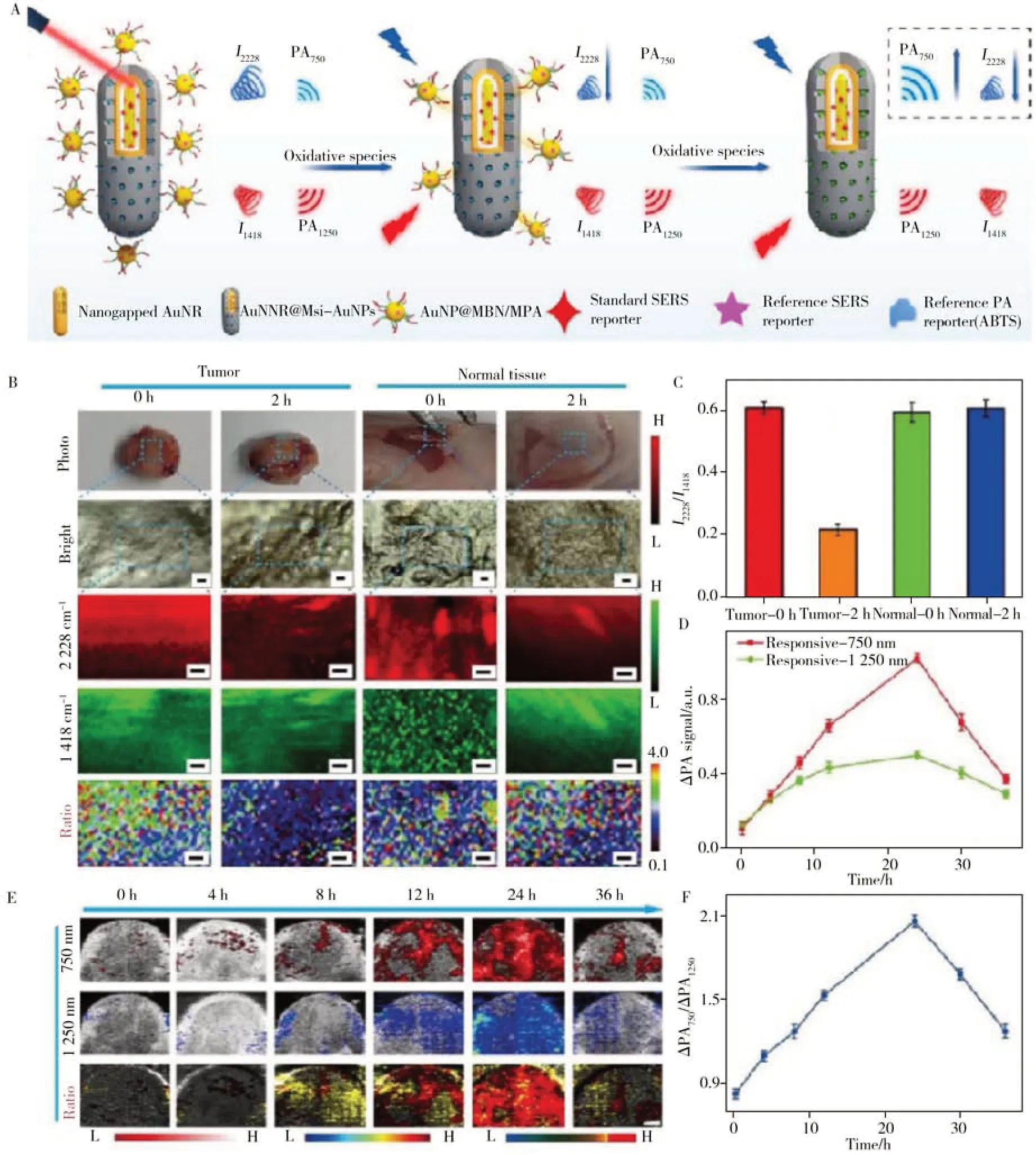
圖5 H2O2響應的SERS和光聲(PA)雙比率成像示意圖(A);SERS比率(I2228/I1418)信號成像腫瘤和正常組織(B);SERS比率(I2228/I1418)信號在納米探針注入后不同時間點的強度(C);靜脈注射納米探針后不同時間皮下4T1腫瘤小鼠的PA值(D,750 nm、1 250 nm)及相應的比例(ΔPA750/ΔPA1250)PA成像(E),以及注射后不同時間點ΔPA750/ΔPA1250信號強度(F)[53]Fig.5 Schematic illustration of H2O2 responsive dual ratiometric SERS and photoacoustic imaging (A);ratio(I2228/I1418) SERS imaging of tumors and normal tissues (B);ratio(I2228/I1418) SERS intensity at different time points after injection of the nanoprobe(C);PA values(D) at 750 nm and 1 250 nm and the corresponding ratiometric PA imaging(E) and the ratiometric PA intensity in mice with subcutaneous 4T1 tumor at different times after intravenous injection of the nanoprobe (F)[53]

圖6 銀納米線組成的隨機交叉-木樁的三維富等離子體納米結構示意圖(A),以及在胎牛血清中監測到的膽紅素分子指紋圖譜(B)[54]Fig.6 3D plasma nanostructure diagram of silver nanowires composed of random cross-wood piles(A),SERS substrates identify bilirubin molecular fingerprints in bilirubin-containing fetal bovine serum(B)[54]
2.1.4 生物大分子響應型SERS 探針大分子如蛋白質(包括酶)和核酸(DNA 和RNA),是細胞的基本組成部分,在生物過程中發揮重要作用,檢測這些生物標志物有助于了解發病機制、早期診斷、風險評估和監測疾病進展。生物大分子響應型SERS探針通常是基于分子識別機制來構建,其在分子醫學領域的應用如表4 所示。如圖7A,Wang 等[65]構建了一種新型的SERS 生物傳感平臺,結合靶向響應的DNA 水凝膠實現了快速、準確、靈活地檢測肝癌特異性標志物甲胎蛋白(AFP)。通過引入特異性識別AFP的適配子構成DNA 水凝膠中的連接子鏈,在AFP存在的情況下,引起水凝膠解纏結并釋放免疫球蛋白G(IgG)。隨后,釋放的IgG被SERS探針和生物功能磁珠通過形成三明治狀結構捕獲,導致磁分離后上清液中拉曼標簽的信號峰值比率I1612/I520降低(圖7C)。這種檢測方法由于SERS 生物傳感器的超高靈敏度,檢測線性范圍較寬(50~0.5 μg/mL),檢測限低至50 pg/mL,為肝癌診斷提供了新的分子工具。

表4 生物大分子響應型SERS探針在分子醫學領域的應用Table 4 The applications of micromolecule responsive SERS probes in molecular medicine

圖7 甲胎蛋白(AFP)響應性DNA水凝膠示意圖[65](A);該檢測平臺在不同濃度AFP下采集的SERS光譜[65](B);I1612/I520峰值比率與AFP濃度對數值的線性關系(n=6)[65](C);內切酶響應的DNA-炔納米傳感器示意圖[66](D);添加不同濃度DNA酶I后的SERS光譜[66](E);I1983/I2215的峰值強度比與DNA酶I濃度的相關性[66](F)Fig.7 Schematic diagram of alpha-fetoprotein(AFP) responsive DNA hydrogel[65](A);SERS spectra of this detection platform collected with various concentrations of AFP[65](B);linear relationship between the value of I1612/I520 and the logarithm of AFP concentration(n=6)[65](C);schematic diagram of endonuclide responsive DNA-acetylene nanosensor[66](D);SERS spectra upon addition of DNase I with different concentrations[66](E);correlation of the peak intensity ratios of I1983/I2215 and DNase I concentrations[66](F)
利用酶催化反應構建探針是檢測疾病相關酶的常見策略。Si等[66]構建了一種新型的比率型SERS傳感器用于檢測核酸內切酶的活性(圖7D)。該工作在金銀合金納米粒子表面修飾3-[4-(苯乙炔基)芐基硫]丙酸(PEB)的單鏈DNA(ssDNA)作為內切核酸酶響應的SERS 信號分子,同時修飾4-噻吩基乙炔(TPA)作為內標SERS信號分子。在核酸內切酶存在時,ssDNA 被切割,從粒子表面釋放PEB 分子,使得PEB在2 215 cm-1處的SERS信號降低,而TPA內標在1 983 cm-1處的信號保持不變,基于I1983/I2215的比率實現了核酸內切酶的定量檢測,檢測限低至0.056 U/mL(圖7E、7F)。該研究證明了Au/Ag納米復合材料除了具有更好的化學穩定性和低生物毒性,還具有更優異的等離子體特性。通過在材料表面進行炔烴的功能化修飾在生物靜默區獲得明顯的拉曼特征信號,這種比率型的拉曼信號檢測方法使體外和活細胞層面的檢測結果更為可靠。
2.2 在成像輔助手術治療中的應用
成像輔助手術,又稱術中成像,通過在手術過程中為外科醫生提供實時的視覺指導,在現代醫療實踐中發揮著至關重要的作用。傳統臨床成像技術,例如核磁共振成像、計算機斷層掃描成像和超聲成像,雖然能夠在組織穿透深度和解剖學結構上提供更豐富的信息,但在分子層面的理解仍較少。SR-SERS 探針可被設計為具有靶向特定組織或細胞的識別探針。在手術中,這些探針在特定區域產生SERS 信號,可輔助外科醫生從分子層面實時區分不同的組織類型。Yang 等[68]探索了一種pH 響應的SERS 策略,用于快速識別膠質瘤邊界。該研究制備了一種由銀納米粒子自組裝膜組成的傳感芯片(圖8A),在其表面修飾了pH 響應的SERS 報告基因4-巰基吡啶(4-MPY)。4-MPY 的特征SERS 峰比值在不同pH 條件下呈現規律性的變化。通過活體實驗測量組織間液浸潤水珠的pH 值能夠有效確定膠質瘤的浸潤邊界(圖8B),在最大限度地切除腫瘤組織的同時減少了對正常組織的損傷。

圖8 膠質瘤樣本組織液提取及用便攜式光纖拉曼光譜儀測量其SERS圖譜的示意圖(A);在小鼠膠質瘤不同位置測得的特征峰比值(I1091/I1580)及其相應的pH值(B)[68]Fig.8 Schematic diagram of the extraction of interstitial fluid of a glioma sample,and its SERS measurement by a portable optical-fiber Raman spectrometer(A);characteristic peak ratios(I1091/I1580) measured at different locations of mouse glioma and its corresponding pH values(B)[68]
2.3 在藥物釋放監測中的應用
SR-SERS 探針在藥物檢測和分析中具有重要的應用價值,能夠滿足低濃度特定目標分子的高靈敏度、高選擇性檢測。SERS 探針可以集成到藥物遞送系統中,以監測藥物在目標位點的釋放情況。Sreedevi等[69]開發了一種模塊化的膠束化方法,用于多種疏水性藥物的靶向遞送。通過監測膠束分子和藥物的拉曼特征峰,首次實現了利用SERS技術評估藥物形成、細胞攝取和細胞內釋放等過程中的臨界膠束濃度。這種實時監測確保了藥物遞送的可控和高效,最大限度地減少了副作用,對藥物開發和評價具有重要意義。
3 總結與展望
自1928年拉曼散射被錢德拉塞卡拉·文卡塔·拉曼發現以來,拉曼光譜技術飛速發展,擁有眾多分支的刺激響應型SERS技術因其高選擇性的增強效果、多目標物同時分析以及多模成像的潛力成為重要的分子醫學研究工具,在疾病診斷、成像輔助手術治療和藥物釋放監測等方面有著不可替代的地位。然而,從針對臨床醫學應用的發展來看,SERS探針仍面臨以下挑戰。
3.1 毒性問題
SR-SERS 探針應用于臨床,面臨的首要問題是毒性問題。多數SERS 探針依靠貴金屬納米粒子,如金或銀納米粒子實現拉曼信號的增強。為了提高體內拉曼成像的靈敏度,傳統SERS探針基底金納米顆粒通常采用直徑大于10 nm 的顆粒,而如此大的金納米粒子難以在短時間內排出體外,存在納米材料的毒性隱患,限制了拉曼成像技術的臨床轉化。基于此,2023年Yu等[70]制備了一種金超團簇拉曼活性基底,該基底兼具顯著的SERS活性和超高的排出率(圖9)。實驗證明這種金超團簇經瘤內注射入實驗小鼠體內后,在體內可逐步分解為直徑2~3 nm的超小團簇,加快基底材料在體內的代謝過程,四個月的排出率達到73%,其中肝和腎幾乎無藥物殘留,極大地減少了納米材料滯留體內帶來的潛在毒性。機理驗證顯示這種金納米超團簇構建組分的小尺寸雖然損害了電磁場增強效應,但由于NIR 共振拉曼染料的高負載和金屬超團簇的熒光背景受到很大抑制,超團簇表現出與大金納米顆粒相當的SERS 活性。此外,選擇具有良好生物相容性的基底材料和利用表面修飾增加探針的生物相容性,減少基底可能引起不良反應和對樣品生物學特性的影響是目前的主流研究方向。

圖9 金納米粒子與超簇的示意圖比較(A);球形和分枝的金超團簇方案作為納米團簇在肝臟和脾臟中可生物降解和排泄,并在體內進行腫瘤的拉曼成像(B)[70]Fig.9 A schematic comparison of a gold nanoparticle and a supracluster(A);a scheme of spherical and branched gold supraclusters that are biodegradable and excretable as nanoclusters in the liver and spleen and perform in vivo Raman imaging of tumors(B)[70]
3.2 重現性問題
SR-SERS 探針應用于活體檢測的重現性易受到探針的分布、組織深度、外界環境觸發的探針形態或大小變化等因素影響。因此,保障SERS信號檢測結果的一致性和重現性極具挑戰。除了控制實驗條件、樣品制備標準化等解決方法外,設置穩定的內參信號、結合其它檢測方法是發展的新方向。例如Feng 等[71]基于缺口金納米顆粒和聚N-異丙基丙烯酰胺分子設計合成了一種Cu2+響應的探針,利用探針具有的SERS和近紅外二區(NIR-Ⅱ)活性,在威爾遜疾病模型動物中實現了肝臟和尿液中Cu2+含量的同時定量檢測。探針體系經Cu2+激活后,其NIR-Ⅱ光聲信號(PA1250)和SERS 比率信號(I2223/I1378)的強度均與Cu2+含量呈線性關系。利用此特性,該探針排除了單一響應型拉曼成像易受假陽性信號或非特異性攝取的干擾,在活體層面實現了對Cu2+的定量檢測,有效提高了檢測結果的可靠性。
3.3 穿透深度限制
SR-SERS 探針原理上屬于光學成像技術,囿于光與人體生物組織之間的相互作用會導致信號衰減、散射和吸收,SERS信號能夠有效檢測到的深度受到限制(通常小于1 cm)[72]。這極大限制了對深層病變組織的觀察。克服組織穿透性的挑戰對于擴大SERS 在深部組織成像和診斷中的適用性至關重要。提高組織穿透的一種方法是使用近紅外激發波長。近紅外光在生物組織中的散射和吸收減少,從而能夠穿透更深(可達到數厘米)[73-74]。此外,利用光纖系統,研究人員可將激發光傳送到感興趣的組織部位,并從組織部位直接收集拉曼信號。該方法可以利用微創操作抵達傳統方法不易到達的組織部位[75-79]。另外,將SERS與光學相干斷層掃描、磁共振成像或超聲等其他成像模式相結合,可以提供互補的組織層結構信息[27,80-82]。這種技術的集成有助于引導SERS測量到目標區域,提高信號檢測的準確性。同時,通過分析體外或表面樣品,例如血液、尿液、汗液、皮膚,也是繞開組織穿透深度限制的一種方法[83]。
未來SR-SERS 探針在分子醫學領域的發展將集中在實現快速精準的診療一體化,隨著材料科學、化學、生物和醫學等多學科交叉領域研究人員之間的合作,突破現有材料毒性、重現性和穿透深度等SR-SERS檢測技術的局限,將為SR-SERS探針的進一步臨床轉化帶來可能。

