葡萄MYB轉錄因子基因VvMYB30的克隆及其耐鹽性分析
解振強,許桓瑜,黃金霞,蔡善亞,李剛,趙鵬程*
(1.江蘇農林職業技術學院,江蘇句容 212400;2.揚中市經濟開發區管委會,江蘇揚中 212200)
葡萄作為重要的經濟果樹在優化農業結構和促進農民增收等方面發揮了重要作用。然而,環境污染、灌溉和施肥不當等造成的土壤鹽漬化嚴重降低了葡萄的產量和品質,同時我國沿海灘涂等鹽堿地也制約著葡萄的推廣種植[1-2]。為了減少鹽堿造成的損失,除進行土壤改良和耐鹽砧木嫁接外,挖掘耐鹽基因并通過基因工程育種已成為果樹遺傳改良中高效可行的手段。
MYB轉錄因子是植物中最大的一類轉錄因子家族,其中多數為R2R3型,而R2R3-MYB轉錄因子又可聚類為25個亞類[3]。已有的研究表明,Subgroup I亞類成員通過多種通路廣泛參與了植物的脅迫響應。Zhao等[4]發現,在擬南芥中,過表達小麥TaMYB31可促進蠟質合成及耐旱基因的表達,提高植株的耐旱性;擬南芥AtMYB30則可通過ROS通路及鈣信號通路參與鹽、氧化和高溫等脅迫信號的傳遞與正向調節[5-6]。而對AtMYB96的研究表明,其可經由ABA信號通路正調控植株對干旱和冷脅迫的耐受性[7-8]。除作為正調節因子外,該亞類成員還可負調節植株的耐逆性,如Lyu等[9]對水稻OsMYB30的功能研究發現OsMYB30通過降低麥芽糖的含量負調控水稻的耐寒性。目前,從葡萄基因組中共鑒定到131個R2R3-MYB轉錄因子[10]。已有的功能研究表明,其參與調控了葡萄中原花青素、花青素和二苯乙烯等次生代謝物的合成。如過表達VvMYB4、VviMYB86和VvMYBC2L2可抑制植株體內花青素的合成,其中VviMYB86還可促進原花青素的合成[11-13]。也有研究表明,VvMYBA1和VvMYBA2通過調控花青素的生物合成控制葡萄的漿果顏色[14]。此外,Holl等[15]發現,在葡萄毛狀根中過表達VvMYBA14和VvMYBA15能夠顯著促進白藜蘆醇前體物質二苯乙烯的合成。然而,葡萄MYB轉錄因子參與耐逆調控的報道還較少。其中,過表達VvMYB6可提高轉基因煙草對干旱和鹽脅迫的耐受性,耐鹽砧木‘1103P’中的VvMYB62正調控植株的耐鹽性[16-17]。而Zhang等[18]的研究發現,將野生葡萄VaMYB44在擬南芥和葡萄愈傷組織中過表達則降低了耐寒性。
本研究以‘陽光玫瑰’葡萄中MYB轉錄因子Subgroup I亞類成員VvMYB30為對象,通過對其進化關系、表達模式、亞細胞定位、轉錄激活活性和耐鹽性進行分析,探究其在葡萄耐鹽響應過程中的生物學功能,為葡萄的耐鹽分子育種提供候選基因資源。
1 材料與方法
1.1 植物材料及處理
葡萄材料來自于江蘇省農博園無土栽培的3年生歐美雜交種葡萄‘陽光玫瑰’,正常生長條件下,于初花期采集各組織器官樣品,并在果實發育的不同時期采集果實樣品,各樣品經液氮速凍后置于-80 ℃冰箱內保存。鹽脅迫處理:以當年生扦插苗為試材,清洗后將其置于1/2 Hoagland培養液中培養1周,然后轉移至含200 mmol?L-1NaCl的培養液中進行鹽處理,分別在處理0、6、12、24、36、48 h后采集相同位置的成熟葉片,液氮速凍后置于-80 ℃冰箱內保存。
本研究所用煙草材料為本氏煙(Nicotiana benthamiana),用于轉基因的擬南芥(Arabidopsis thaliana)為Col-0。煙草、擬南芥及鹽處理葡萄培養溫度為24 ℃,光照周期為16 h光照/8 h黑暗。
1.2 基因克隆及載體構建
使用Spectrum植物總RNA試劑盒(Sigma-Aldrich)提取各樣品的總RNA,并通過Nanodrop 2000分光光度計(Thermo Fisher Scientific)和2%瓊脂糖凝膠檢測濃度及完整性。以RNA為模板,使用HiScript III 1st Strand cDNA Synthesis Kit with gDNA wiper(Vazyme)試劑盒合成cDNA,稀釋50倍并分裝后置于-20 ℃冰箱內保存。基于已有葡萄基因組設計特異引物,以成熟葉片cDNA為模板擴增VvMYB30的CDS序列,純化后克隆到pMD18-T載體中并送至通用生物進行測序。依據CDS序列合成亞細胞定位引物和轉錄激活驗證引物,擴增全長序列,通過ClonExpress II One Step Cloning Kit(Vazyme)分別將其同源重組到pCAMBIA1305-GFP和pGreenII-62-SK-GAL4BD(pBD)載體上,獲得亞細胞定位載體35S::VvMYB30-GFP及效應載體pBD-VvMYB30。
1.3 亞細胞定位及轉錄激活驗證
亞細胞定位方法:將分別含GFP及mCherry載體的農桿菌振蕩培養至OD600≈0.8后離心,用侵染液(10 mmol?L-1MES、10 mmol?L-1MgCl2和200 μmol?L-1AS)重懸菌體至OD600≈0.2,放置2 h后,將不同侵染液等體積混合并注射入本氏煙草葉片,在培養箱中培養2~3 d后,用激光共聚焦顯微鏡觀察熒光信號并拍照。
轉錄激活驗證方法:參考Wang等[19]的研究進行,將構建好的效應載體組合報告載體轉入煙草葉片,共進行6次生物學重復。在培養箱中培養2~3 d,參照雙螢光素酶報告基因檢測試劑盒(Yeason)使用說明,檢測螢火蟲螢光素酶及海腎螢光素酶報告基因的活性。將LUC/REN比值與對照組進行歸一化處理,所產生的數值表示活性強弱。
1.4 熒光定量PCR分析
利用Primer Premier 5.0設計VvMYB30的定量引物,以VvACTIN為內參基因。熒光定量PCR反應體系包括:2×SYBR Green Supermix 10 μL、上、下游引物各1 μL、稀釋后的cDNA8 μL,ddH2O補足至20 μL。反應程序為:95 ℃預變性30 s;95 ℃變性5 s,60 ℃退火延伸30 s,共40個循環。利用2-ΔΔCT法分析基因的相對表達量。
1.5 擬南芥遺傳轉化及耐鹽性鑒定
將35S::VvMYB30-GFP載體通過花序侵染法轉至擬南芥Col-0中,利用含25 mg?L-1潮霉素的1/2 MS抗性培養基以及PCR檢測擴增目的基因的方法進行逐代篩選,最終獲得T3代純合轉基因株系。通過RT-PCR鑒定VvMYB30在轉基因株系中是否轉錄,并進一步利用qRT-PCR檢測各株系中VvMYB30的表達量,從中選取表達量較高的株系用于耐鹽性鑒定。將消毒后的野生型和轉基因擬南芥種子分別點播于含有0或125 mmol?L-1NaCl的1/2MS培養基上,4 ℃春化3 d,然后將其置于光照下培養,并統計7 d內的發芽情況,共進行3次生物學重復。萌發率(%)=(發芽種子數/供試種子數)×100。
將在培養基上生長7 d的野生型和轉基因擬南芥分別移栽至方盆中,每盆9株。待植株生長20 d后進行鹽處理,處理方法為每隔3 d澆灌一次300 mmol?L-1NaCl溶液。處理7 d后統計植株存活率,共進行3次生物學重復。存活率(%)=(處理后的存活株數/總株數)×100。
2 結果與分析
2.1 VvMYB30的克隆及生物信息分析
以‘陽光玫瑰’葡萄成熟葉片cDNA為模板,進行PCR擴增并對其產物進行測序和BLAST分析,其與擬南芥AtMYB30具有較高的同源性,相似度為60.54%,故暫命名為VvMYB30。VvMYB30基因全長984 bp,編碼327個氨基酸,其蛋白分子量為36.54 kDa,等電點為5.69,平均疏水指數(GRAVY)為-0.779,為親水性蛋白。
使用MEGA7.0軟件,采用鄰接法(Neighbor-Joining)構建VvMYB30與擬南芥、甜橙、水稻等其他植物MYB轉錄因子的系統進化樹。結果發現VvMYB30與甜橙CsMYB30的親緣關系最近,相似度為64.75%,推測二者可能具有相近的生物學功能(圖1A)。序列比對結果顯示,VvMYB30與親緣關系較近的 MYB30蛋白的氨基酸相似度在56.98%~64.75%,不同植物MYB30蛋白間的氨基酸數量有較大差異,但在N端序列具有高度的保守性,均含有1個保守的R2R3結構域(圖1B)。

圖1 VvMYB30及其同源蛋白的進化樹(A)和多序列比對(B)分析Figure 1 Phylogenetic (A) and multiple amino acid sequence alignment (B) analysis of VvMYB30 and its homologs from diあerent plant species
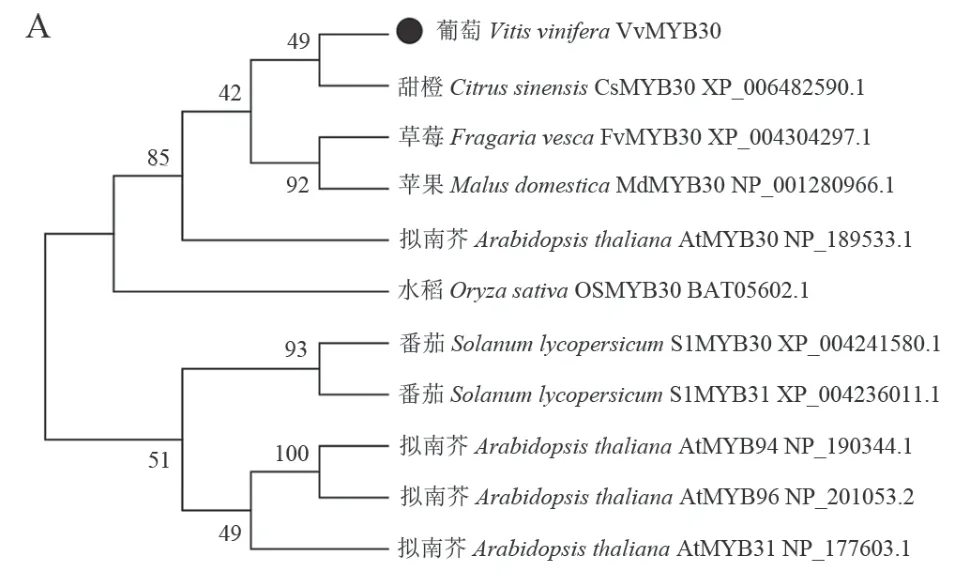

表1 VvMYB30基因克隆及功能分析所用引物Table 1 Primer used for VvMYB30 gene cloning and functional analysis
2.2 VvMYB30的亞細胞定位及轉錄激活分析
將35S::VvMYB30-GFP載體與細胞核標簽載體(35S::AtHY5-mCherry)在本氏煙葉片中瞬時表達。激光共聚焦顯微鏡觀察發現,空GFP蛋白分布在細胞質及細胞核內,而VvMYB30-GFP融合蛋白主要分布在細胞核(如圖2A),表明VvMYB30定位于細胞核,屬于核蛋白。
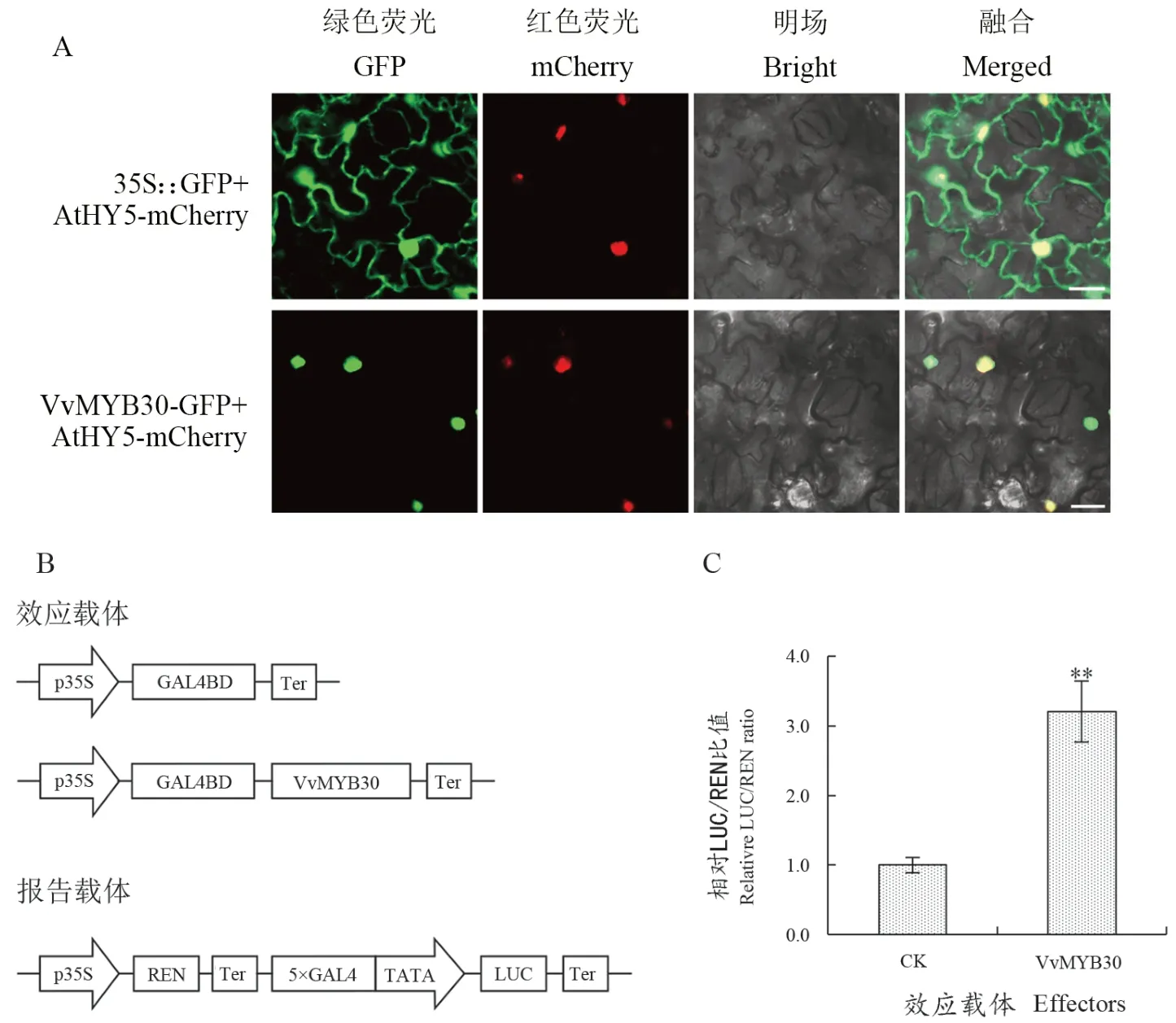
圖2 VvMYB30的亞細胞定位及轉錄激活分析Figure 2 Subcellular localization and transcriptional activation analysis of VvMYB30
通過雙熒光素酶試驗確定VvMYB30在植物體內的轉錄激活活性,將GAL4 DNA結合結構域與VvMYB30融合表達獲得效應載體;報告載體REN基因由35S驅動,LUC基因由5×GAL4激活域序列驅動(圖2B)。將效應載體與報告載體在煙草葉片中瞬時表達并測定雙熒光素酶活性,結果顯示pBDVvMYB30效應載體的LUC/REN值顯著高于陰性對照,為對照的3.28倍(圖2C),表明VvMYB30具有轉錄激活活性。
2.3 VvMYB30在葡萄組織中的表達分析
qRT-PCR分析發現,VvMYB30在葡萄不同發育時期的果實中呈高表達,約為根部表達量的7.06~10.12倍;其次是花和成熟葉片,分別為根部的4.20和4.35倍,而在根和莖中表達量較低(圖3A)。VvMYB30受高鹽脅迫,處理24 h后表達量達到最高,為對照的6.86倍,并且在48 h仍然保持在較高水平(圖3B),表明VvMYB30屬于鹽脅迫誘導基因。
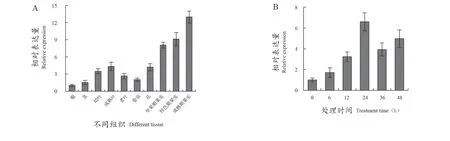
圖3 VvMYB30基因在葡萄不同組織(A)及鹽脅迫(B)的表達分析Figure 3 Expression analysis of VvMYB30 in diあerent tissues(A) and salt stress (B) of 'Shine-Muscat' grape
2.4 過表達VvMYB30提高擬南芥的耐鹽性
利用花序侵染法將VvMYB30在擬南芥轉化,篩選共獲得5個純合株系,RT-PCR結果如圖4A。利用qRT-PCR檢測純合株系中VvMYB30的表達水平,從中挑選2個表達量較高的株系用于耐鹽性分析(圖4B)。
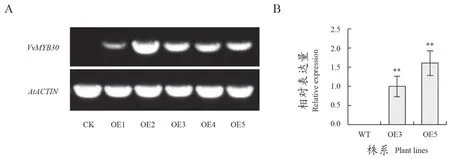
圖4 過表達VvMYB30擬南芥的分子鑒定Figure 4 Molecular identification of VvMYB30 ectopic expression lines in Arabidopsis
將野生型和2個過表達株系的擬南芥種子置于含125 mmol?L-1NaCl的培養基上,每天統計萌發情況。結果表明,在不含NaCl的培養基上,在同一天內野生型和2個過表達株系的萌發率均無顯著差異(圖5A),但在鹽脅迫處理后,2個過表達株系的萌發率均顯著高于野生型(圖5B),表明在擬南芥中過表達VvMYB30可顯著促進鹽脅迫下種子的萌發。為進一步鑒定過表達VvMYB30擬南芥的耐鹽性,對生長20 d的擬南芥植株進行NaCl溶液澆灌,在7 d后統計存活率。結果如圖6所示,鹽脅迫處理后2個過表達株系的存活率分別為40.74%和44.44%,均高于野生型。綜上結果表明,過表達VvMYB30可顯著增強擬南芥的耐鹽性。

圖5 NaCl處理對擬南芥種子萌發的影響Figure 5 Eあects of NaCl treatment on seed germination of Arabidopsis

圖6 NaCl處理對擬南芥幼苗存活率的影響Figure 6 Eあects of NaCl treatment on the survival rate of Arabidopsis seedlings
3 討論
土壤鹽漬化嚴重影響著葡萄的推廣種植和果實品質,挖掘葡萄耐鹽基因對于葡萄的遺傳改良具有指導作用。其中,MYB轉錄因子作為植物中最大的一類轉錄因子家族,在調控植物耐逆響應過程中發揮關鍵作用。本研究從‘陽光玫瑰’葡萄中克隆到1個受鹽脅迫誘導表達的MYB轉錄因子基因VvMYB30,其編碼的VvMYB30蛋白與其他物種的MYB30蛋白親緣關系最近,同屬于MYB轉錄因子家族Subgroup Ⅰ亞家族成員。同源性分析表明,它們在蛋白N端均存在1個高度保守的R2R3結構域,而C端則同源性較低,C端區域的差異可能影響著MYB轉錄因子的轉錄激活[20]。這一結構特征也與其他MYB亞家族一致[21]。
VvMYB30在其他植物中的同源蛋白已被證實廣泛參與對非生物脅迫的應答過程,如水稻中OsMYB30負調控耐寒性[9],甜橙CsMYB30可提高轉基因擬南芥對干旱和鹽脅迫的耐受性[22],擬南芥AtMYB30參與對鹽、氧化和熱脅迫的應激反應[5,6]。本研究發現,VvMYB30受鹽脅迫誘導上調表達,暗示其可能參與葡萄的耐鹽性響應,進一步在擬南芥中過量表達VvMYB30可促進擬南芥在鹽脅迫下種子的萌發率及幼苗的存活率,表明VvMYB30正向調控植物的耐鹽性。該結果與同源蛋白AtMYB30和CsMYB30的研究結果一致[5,22]。但是,本文未設置空載體對照,在后期的深入研究中將會加入空載體對照,以便于得出更嚴謹的結論。
前人研究發現,擬南芥AtMYB30通過激活交替氧化酶AtAOX1a的表達維持細胞氧化還原穩態來增強耐鹽性[5],番茄SlMYB30可能與正調控鹽脅迫的BZR轉錄因子SlBZR1互作調控耐鹽性[23],而甜橙CsMYB30及擬南芥AtMYB96則是通過調控蠟質合成基因的表達提高植株的耐鹽性[22,24]。上述結果表明,MYB30轉錄因子可通過多種途徑調控植物的耐鹽性。本研究中VvMYB30定位于細胞核且具有轉錄激活活性,這為其通過與啟動子區結合來激活或抑制靶基因的表達提供了可能,但通過調控哪些耐鹽基因轉錄有待深入研究。
此外,本研究中VvMYB30在葡萄各組織中具有不同的表達模式,在花和果實中高表達,而在根、葉中低表達,這與甜橙CsMYB30的組織表達模式基本一致[22,25]。VvMYB30的同源基因CsMYB30、MdMYB30、AtMYB30和SlMYB31等均被證實為烷烴等蠟質合成基因的正調控因子[22,26-28]。此外,研究還發現VvMYB30在葡萄果實中與蠟質合成基因VvCER、VvKCS的表達呈強相關性[29]。因此,推測VvMYB30還可能參與了調控果實發育過程中果實和果粉中蠟質的生物合成,其功能有待進一步研究。
4 結論
本研究從‘陽光玫瑰’葡萄中克隆了MYB基因VvMYB30,其表達受鹽脅迫誘導。VvMYB30與其他植物的MYB30蛋白同源性較高,為SubgroupⅠ亞家族成員。VvMYB30定位于細胞核且具有轉錄激活活性。在擬南芥中過表達VvMYB30可顯著增強轉基因擬南芥的耐鹽性。上述結果表明,VvMYB30可能在植物抵御鹽脅迫中發揮重要作用。

