健脾益腎降濁方治療糖尿病腎病的臨床療效及對患者微炎癥狀態的影響※
趙惠葉 劉紅利 田金悅△ 李 洋 趙重陽
(1.河北省石家莊市第二醫院糖尿病中醫科,河北 石家莊 050035; 2.河北省石家莊市糖尿病精準診療技術創新中心,河北 石家莊 050035;3.河北省糖尿病基礎醫學研究重點實驗室,河北 石家莊 050035;4.河北省石家莊市中醫院兒科,河北 石家莊 050011)
糖尿病腎病(diabetic kidney disease,DKD)是糖尿病的微血管并發癥之一,是導致終末期腎病的重要原因之一。微炎癥狀態是一種有別于病原體感染的炎癥,其表現為全身低水平、持續性炎癥因子升高,而并無明確的病原體感染[1]。有研究發現,DKD患者機體內普遍存在微炎癥狀態,在疾病早期即可出現,隨著病情發展逐漸加重,會加快患者腎功能的降低及腎實質的損傷[2]。因此,改善DKD患者的微炎癥狀態成為延緩疾病進展的一個治療新思路[3]。2020年1月-2021年3月,我們在西醫常規治療的基礎上聯合健脾益腎降濁方治療DKD 40例,并與單純采用西醫常規治療40例對照觀察,結果如下。
1 資料與方法
1.1 一般資料 全部80例均為河北省石家莊市第二醫院收治的DKD患者,按照隨機數字表法分為2組。治療組40例,男22例,女18例;年齡33~69歲,平均(56.24±7.98)歲;糖尿病病程2~10年,平均(5.76±2.28)年;DKD病程12~36個月,平均(14.28±2.01)個月。對照組40例,男27例,女13例;年齡24~67歲,平均(56.38±6.44)歲;糖尿病病程3~10年,平均(5.36±1.79)年;DKD病程12~33個月,平均(14.67±2.29)個月。2組一般資料比較差異無統計學意義(P>0.05),具有可比性。
1.2 病例選擇
1.2.1 診斷標準
1.2.1.1 糖尿病診斷 參照《中國2型糖尿病防治指南(2017年版)》中2型糖尿病的診斷標準[4]。即有典型糖尿病癥狀且隨機血糖≥11.1 mmol/L,或空腹血糖(FPG)≥7.0 mmol/L,或口服葡萄糖耐量試驗(OGTT)餐后2 h血糖(2 hPG)≥11.1 mmol/L。
1.2.1.2 DKD診斷 參照《美國腎臟基金會腎臟病預后質量倡議(NKF-K/DOQI)指南標準》[5]和《糖尿病腎臟防治專家共識(2014年版)》[6]中DKD的診斷標準,病情分期為Ⅲ期,伴有持續性微量白蛋白尿,尿白蛋白排泄率(UAER)20~200 μg/min或30~300 mg/24 h。
1.2.2 納入標準 符合上述診斷標準;年齡30~70歲,DKD分期為Ⅲ期;患者自愿參加本研究并簽署治療知情同意書,經過醫院醫學倫理委員會批準。
1.2.3 排除標準 近期有手術史或者感染者;合并有其他腎病或泌尿系系統疾病者;DKD病情嚴重需透析治療者;患有嚴重的心腦血管疾病或肝功能異常者;妊娠期及哺乳期婦女。
1.3 治療方法
1.3.1 對照組 參照《糖尿病腎臟防治專家共識(2014年版)》[6]中相關內容給予西醫常規治療。包括糖尿病健康教育、飲食(限制蛋白質攝入)、運動等基礎治療,并口服降糖藥或皮下注射胰島素控制血糖水平,降壓藥物予血管緊張素轉化酶抑制劑(ACEI)或血管緊張素Ⅱ受體拮抗劑(ARB),控制血壓在140/90 mmHg(1 mmHg≈0.133 kPa)左右,口服阿托伐他汀鈣片等藥物控制血脂。
1.3.2 治療組 在對照組基礎上聯合健脾益腎降濁方治療。藥物組成:黃芪20 g,防己15 g,白術15 g,山藥15 g,山茱萸15 g,地龍10 g,蒲黃15 g,澤蘭15 g,半夏6 g。均采用中藥顆粒劑(神威藥業集團有限公司),每日1劑,分早、晚2次溫開水沖服。
1.3.3 療程 2組均治療12周后統計療效。
1.4 觀察指標及方法
1.4.1 血糖 比較2組治療前后血糖指標變化情況,包括FPG、2 hPG及糖化血紅蛋白(HbA1c)。
1.4.2 炎癥指標 比較2組治療前后炎癥指標變化情況,包括超敏C反應蛋白(hs-CRP)、白細胞介素8(IL-8)、IL-6及腫瘤壞死因子α(TNF-α)水平。
1.4.3 腎功能 比較2組治療前后腎功能指標變化情況,包括血肌酐(SCr)、尿素氮(BUN)及UAER。
1.4.4 中醫癥狀評分 比較2組治療前后中醫癥狀評分變化情況,參照《中藥新藥臨床研究指導原則(試行)》[7]中相關內容擬定評分標準包括倦怠乏力、氣短懶言、腰膝酸軟、腰痛或刺痛固定不移、食少納呆、口中黏膩、肢體困重、形體肥胖、面浮足腫及肢體麻木,根據癥狀輕重,按無、輕、中、重分別記0、1、2、3分,評分越高表示癥狀越嚴重。
1.4.5 安全性監測 觀察記錄2組治療過程中不良反應發生情況。
1.5 療效標準 顯效:患者癥狀、體征消失,UAER較治療前下降>40%,炎癥因子水平恢復正常;有效:患者癥狀、體征較前減輕,UAER較治療前下降<40%,炎癥因子水平下降;無效:患者癥狀、體征未見改善或惡化[5]。
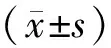
2 結果
2.1 2組治療前后血糖指標FPG、2 hPG及HbA1c水平變化比較 與本組治療前比較,2組治療后血糖指標FPG、2 hPG及HbA1c水平均下降(P<0.05),但2組治療后FPG、2 hPG及HbA1c組間比較差異無統計學意義(P>0.05)。見表1。
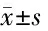
表1 2組治療前后血糖指標FPG、2 hPG及HbA1c水平變化比較
2.2 2組治療前后炎癥指標hs-CRP、IL-8、IL-6及TNF-α水平變化比較 與本組治療前比較,2組治療后炎癥指標hs-CRP、IL-8、IL-6及TNF-α水平均降低(P<0.05),且治療組治療后hs-CRP、IL-8、IL-6及TNF-α水平均低于對照組(P<0.05)。見表2。
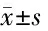
表2 2組治療前后炎癥指標hs-CRP、IL-8、IL-6及TNF-α水平變化比較
2.3 2組治療前后腎功能指標SCr、BUN及UAER水平變化比較 與本組治療前比較,2組治療后腎功能指標SCr、BUN及UAER水平均降低,比較差異均有統計學意義(P<0.05),且治療組治療后腎功能指標SCr、BUN及UAER水平均低于對照組,比較差異均有統計學意義(P<0.05)。見表3。
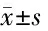
表3 2組治療前后腎功能指標SCr、BUN及UAER水平變化比較
2.4 2組治療前后中醫癥狀評分變化比較 與本組治療前比較,2組治療后中醫癥狀評分均降低(P<0.05),且治療組治療后中醫癥狀評分低于對照組(P<0.05)。見表4。
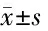
表4 2組治療前后中醫癥狀評分變化比較 分,
2.5 2組臨床療效比較 治療組治療后總有效率87.5%(35/40),對照組治療后總有效率62.5%(25/40),治療組總治療后有效率高于對照組(P<0.05)。見表5。

表5 2組臨床療效比較 例(%)
2.6 安全性 2組治療期間均未出現明顯不良反應。
3 討論
DKD是導致終末期腎病的重要原因,其發病機制復雜,目前研究認為本病是代謝、氧化應激、炎癥、胰島素抵抗、細胞因子及遺傳等多重因素共同作用的結果。近年來的多項研究表明,炎癥是導致DKD腎纖維化的重要原因,因此患者早期的微炎癥狀態越來越受到關注[8]。與外源性感染不同,微炎癥狀態是指DKD患者并未出現局部或全身的臨床感染癥狀,而是體內持續存在低水平的炎癥狀態。DKD患者體內激活及催生了大量炎癥因子,產生級聯的炎癥瀑布效應,這些炎癥因子又可刺激血管活性物質釋放,使腎小球系膜細胞增生,內皮細胞通透性增加,加速腎臟損傷的進展。有關糖尿病動物模型的實驗研究顯示,模型小鼠血清中TNF-α水平明顯升高,且升高程度與腎臟損傷程度呈正相關[9]。IL-6是一種多功能細胞因子,可與腎小球系膜細胞IL-6 受體結合后產生過多的細胞外基質,使腎小球濾過膜異常增厚,從而導致腎小球濾過障礙,IL-6還可使血管內皮細胞上黏附分子的表達增加,通過黏附過多的炎癥細胞,導致毛細血管通透性異常,從而促進DKD的發生發展[10-11]。有研究發現,TNF-α與IL-6 可能存在協同作用,共同導致腎小球硬化[12-13]。hs-CRP作為一種非特異性急性期反應蛋白,在急慢性炎癥以及DKD患者中均明顯升高,是提示微炎癥的可靠指標[14]。IL-8是白細胞介素家族成員之一,在急慢性炎癥發生發展中具有重要作用。有研究發現,IL-8水平與DKD疾病發展相關,IL-8升高在一定程度上反映尿蛋白的嚴重程度[15]。在DKD治療方面,現代醫學目前主要采用降壓、降糖、調脂等治療方法來控制臨床癥狀,但是缺乏對因治療,而中醫學從整體出發,辨證論治,在治療DKD方面有較大的優勢。
中醫學中無DKD的病名,根據其臨床表現可歸屬于“消渴腎病”“水腫”“尿濁”等病證范疇。《素問·奇病論》言:“此肥美之所發也,此人必數食甘美而多肥也,肥者令人內熱,甘者令人中滿,故其氣上溢,轉為消渴。”認為消渴是由于飲食失節,長期過食肥甘醇酒厚味,損傷脾胃,致脾胃運化失職,積熱內蘊,化燥傷津,消谷耗液,發為消渴。《外臺秘要》引《古今錄驗》曰:“渴而飲水不能多,但腿腫,腳先瘦小,陰痿弱,數小便者,此為腎消病也。”《圣濟總錄》中言:“消渴病久,腎氣受傷,腎主水,腎氣虛衰,氣化失常,開闔不利,水液聚于體內而現水腫。”認為消渴病久入絡,病久及腎,導致血脈瘀滯,腎失濡養,開闔固攝失權,則水谷精微直趨下泄,形成DKD。故治療當以健脾益腎、通絡降濁為主。我們所用健脾益腎降濁方是由防己黃芪湯化裁而來,方中黃芪、防己為君藥,黃芪是健脾益氣、升陽舉陷的要藥,既可健脾益肺以扶正,又可益氣固表及消腫,防己行利濕行水之功;半夏、白術、山藥、山茱萸為臣藥,半夏、白術、山藥健脾化濕,利水消腫,山茱萸益腎養陰,還可收斂固澀;澤蘭、地龍、蒲黃為佐使,活血化瘀利水,且地龍為蟲類藥,可加強走竄通絡之效。現代藥理學研究表明,黃芪中的多糖和皂苷成分能提高胰島素受體底物活性,刺激胰島素分泌,還能提高糖原合成酶的活性,增加葡萄糖轉運能力,從而降低血糖[16];黃芪總黃酮可能通過絲裂原活化蛋白激酶(MAPK)信號通路,調控TNF-α、IL-1β、IL-6的生成,發揮抗炎作用[17];黃芪與山藥配伍能夠使DKD大鼠血糖水平明顯下降,血清BUN、SCr水平明顯減少,保護腎功能,防止腎臟損傷[18];蒲黃總黃酮能抑制IL-6基因表達,減少IL-6分泌,其抗炎效應與核因子κB(NF-κB)通路活性受到抑制密切相關[19];地龍可降低細胞間黏附分子-1(ICAM-1)的表達,阻止炎癥細胞對腎組織的浸潤,進而防止腎小球硬化,延緩DKD進展,地龍具有抗氧化作用,減輕氧化應激對患者機體的進一步損傷[20]。
本研究結果顯示,治療組總有效率高于對照組(P<0.05),治療組治療后炎癥指標hs-CRP、IL-8、IL-6及TNF-α水平均低于對照組(P<0.05),腎功能指標SCr、BUN及UAER水平均低于對照組(P<0.05),中醫癥狀評分低于對照組(P<0.05)。說明治療組聯合健脾益腎降濁方治療后可以更好地改善DKD患者微炎癥狀態,提高腎功能,改善中醫癥狀。另外本研究還顯示,2組治療后血糖指標FPG、2 hPG及HbA1c水平雖較治療前均明顯降低(P<0.05),但2組治療后組間比較差異無統計學意義(P>0.05),說明健脾益腎降濁方對DKD患者血糖水平并無明顯治療作用,可能與研究所用藥物劑量及研究時間有關。
綜上所述,健脾益腎降濁方治療DKD臨床療效確切,可有效改善患者微炎癥狀態,提高腎功能,改善中醫癥狀,從而減慢疾病進展,安全可靠,值得臨床借鑒參考。

