基于黏膜sIgA抗體的非洲豬瘟病毒感染早期血清學檢測方法的建立
白 昀,謝青云,歐陽偉,甘 源,袁 廳,趙東明,步志高, 邵國青,馮志新*
(1.江蘇省農業科學院獸醫研究所 農業農村部獸用生物制品工程重點實驗室,南京 210014; 2.中國農業科學院哈爾濱獸醫研究所獸醫生物技術國家重點實驗室,哈爾濱 150069; 3.獸用生物制品(泰州)國泰技術創新中心,泰州 225300)
非洲豬瘟(African swine fever,ASF)是由非洲豬瘟病毒(African swine fever virus,ASFV)引起家豬及野豬的一種急性、熱性、高度接觸性傳染病。ASFV的臨床癥狀表現為發熱、皮膚發紺和淋巴結、腎、胃腸黏膜明顯出血,強毒株感染的病死率可高達100%[1]。2018年8月,我國遼寧省某養豬場首次暴發ASF疫情,而后迅速席卷全國,造成嚴重的經濟損失[2-3]。目前,臨床上流行的低毒力突變株產生亞急性型、且可造成長期潛伏感染,給ASF的精準預防和控制帶來了很大的困難[4-6]。由于感染這些低毒力突變株的動物病毒載量低、間歇性排毒和個體差異大[4],采用qPCR檢測ASFV是有限的。目前臨床上已嘗試同步檢測抗原和抗體,以提高檢測精度,但ASFV血清抗體檢測技術還有待進一步提高,特別是早期診斷的靈敏度方面。
P30蛋白是ASFV粒子的主要誘導蛋白,由CP204 L基因編碼,帶有強的免疫原決定簇,可作為體液免疫反應非常有效的誘導蛋白。P30蛋白能在感染后早期表達和分泌,與世界動物衛生組織(Office International Des Epizooties,OIE)推薦的以CS-P為包被抗原的ELISA抗體檢測方法相比,可以提前1周檢測到ASFV特異性抗體,可用于感染后免疫反應的早期檢測[7]。另外,ASFV主要以口鼻接觸的方式感染,除了血清中產生特異性的IgG抗體外,還可從口腔液中檢測特異性的黏膜sIgA抗體。sIgA抗體主要存在于口腔及呼吸道分泌液、唾液、淚液、乳汁、胃腸分泌液和泌尿生殖道分泌液中,是機體黏膜免疫的主要抗體,據報道,每100 mL人的唾液中IgA、IgG和IgM的含量分別僅為19.4、1.4和0.2 mg,明顯低于血清中的含量,這使得以口腔液作為抗體檢測對象時,IgA抗體檢測極限沒有血清抗體高,同時由于口腔液的均質性問題,檢測值的均一穩定性也不如血清,但黏膜sIgA抗體也是病原體侵入后最先產生的免疫反應,常用作疾病感染早期診斷的檢測指標[8-10]。許多學者將口腔液應用于不同豬病的抗體檢測,如豬繁殖與呼吸綜合征病毒(PRRSV)、豬圓環病毒2型病毒(PCV2)、豬瘟病毒、豬流感病毒和偽狂犬病病毒等[11-17],認為口腔液中的抗體水平可以滿足免疫學診斷[11]。本課題組前期研究將呼吸道黏膜sIgA抗體作為豬肺炎支原體感染的診斷靶標,可實現感染后4 d即檢測到轉陽,比血清中IgG抗體轉陽時間至少早14 d[18]。
因此,本研究擬建立一種不用采血,可以從口腔液中檢測ASFV特異性sIgA抗體的方法,為ASFV的早期診斷提供技術手段。
1 材料與方法
1.1 試驗材料
1.1.1 材料 MiniBEST質粒純化試劑盒、DNA凝膠回收試劑盒、BAC/PAC DNA Isolation Kit購自Omega公司;蛋白marker和質粒pFastBac1購自Thermo Fisher Scientific公司;X-tremeGENE HP DNA transfection轉染試劑購自Roche公司;HRP-豬IgA單克隆抗體[19]由江蘇省農業科學院獸醫研究所制備與保存;Grace’s Insect Cell Culture購自Gibco公司;其他試劑均為分析純。
1.1.2 參考血清 ASFV抗體陰性血清,收集自2017年以前健康豬,由江蘇省農業科學院獸醫研究所保存提供;ASFV抗體陽性血清,由中國農業科學院哈爾濱獸醫研究所國家非洲豬瘟專業實驗室提供,保存于-70 ℃。
1.1.3 參考口腔液 ASFV黏膜抗體陰性口腔液,采集自8~10周齡健康豬,其對應豬的血清經金諾百泰公司非洲豬瘟病毒ELISA抗體檢測試劑盒(批號:20210646)鑒定為陰性,由江蘇省農業科學院獸醫研究所提供;感染ASFV后不同時間同一頭豬的口腔液和血清樣品由中國農業科學院哈爾濱獸醫研究所國家非洲豬瘟專業實驗室提供;豬瘟病毒(CSFV)抗體陽性口腔液、豬偽狂犬病病毒(PRV)抗體陽性口腔液和PRRSV抗體陽性口腔液分別采集自4~6周齡經口鼻免疫(滴鼻1頭份,口服5頭份)相應活疫苗(CSFV活疫苗(CVCC AV1412株)、PRV活疫苗(Bartha-K61株)和PRRSV活疫苗(JXA1-R株))后28 d的杜×長×大三元豬。三種抗體檢測方法如下:分別在CSFV抗體檢測試劑盒、PRV抗體檢測試劑盒和PRRSV抗體檢測試劑盒(均購自韓國金諾)的酶標板中每孔加入100 μL用試劑盒稀釋液稀釋一倍后的口腔液樣品,37 ℃孵育2 h后洗滌3次,加再入1∶10 000稀釋的 HRP標記羊抗豬IgA(BETHYL公司產品),100 μL·孔-1,37 ℃孵育0.5 h后洗滌3次;加入底物TMB,37 ℃避光顯色,測定OD450 nm值>2.1×未免對照組OD450 nm值;同時,同一頭豬其對應時間的血清經相應的商品化ELISA抗體檢測試劑盒鑒定也為陽性;以上樣品均保存于-70 ℃。
1.1.4 臨床樣品 臨床口腔液樣品43份,其中30份采集自2018年以前屠宰場的屠宰豬,由江蘇省農業科學研究院獸醫研究所保存于-40 ℃。另13份采集自人工感染野毒變異株HLJ/HRB1/20后不同時間以及與感染豬同圈飼養豬,以及與口腔液樣品對應的同一時間同一頭豬的血清樣品13份,由中國農業科學院哈爾濱獸醫研究所國家非洲豬瘟專業實驗室提供。
1.2 重組桿狀病毒表達質粒 SUMO-P30 的構建
1.2.1 密碼子優化與基因合成 根據GenBank中已經發表的非洲豬瘟病毒P30基因序列CP204L(GenBank. NO. MH766894,124 770~125 375),采用分子生物學技術,根據昆蟲細胞的密碼子偏愛性,對ASFV的P30基因進行密碼子優化,同時在P30的N′端添加6×His-SUMO標簽。優化設計的基因6×His-SUMO-P30由通用生物系統(安徽)有限公司合成。
1.2.2 重組桿狀病毒vBAC-P30的制備與鑒定 將上述合成的6×His-SUMO-P30基因通過BamHI和HindIII雙酶切插入桿狀病毒供體質粒pFastBac1,獲得含SUMO-P30基因的重組桿狀病毒供體質粒pFastBac-SUMO-P30。再轉化E.coliDH10Bac感受態細胞,按X-tremeGENE HP DNA transfection說明書轉染對數生長期的Sf9細胞;當細胞病變達80%時,離心收集培養上清即為重組桿狀病毒vBAC-P30。用BAC/PAC DNA Isolation Kit提取重組Bacmid DNA,以其為模板采用引物S-p30(y-F2):5′-GGATCCACCATGTCCTACTACC-3′和S-p30(y-R2):5′-AAGCTTTTAGAACATCAGGTGC-3′進行PCR鑒定和測序。
1.3 重組SUMO-P30蛋白的表達與鑒定
1.3.1 重組SUMO-P30蛋白的表達與純化 將重組桿狀病毒vBAC-P30株按1%的體積(V/V)感染sf9細胞,72~96 h后,1 000×g離心10 min,棄掉上清,收集細胞沉淀。用Binding buffer重懸細胞沉淀,超聲破碎。4 ℃,12 000×g15 min收獲上清液。經0.22 μm濾膜過濾裝載至Ni親和柱。用10倍柱體積Binding buffer進行漂洗,用5倍柱體積 Elution buffer進行洗脫,洗脫后的蛋白用蛋白濃縮超濾管(截留分子量10 000 MWCO)4 000×g離心,洗滌濃縮后即為SUMO-P30蛋白,分裝,-70 ℃凍存備用。
1.3.2 重組SUMO-P30蛋白的Western blot鑒定 將純化的SUMO-P30重組蛋白經SDS-PAGE電泳轉印至NC膜,用5%脫脂乳(PBS稀釋)37 ℃封閉2 h后,分別以500倍稀釋(PBS)的ASFV抗體陽性血清和ASFV抗體陰性血清作為一抗,2~8 ℃孵育過夜;TBST洗滌3次,10 min·次-1。用TBST進行1∶20 000倍稀釋的HRP-羊抗豬IgG酶標抗體,37 ℃孵育0.5 h。TBST洗滌3次,10 min·次-1。按ECL試劑盒說明書進行顯色,觀察特異蛋白條帶。
1.4 ASFV間接ELISA黏膜sIgA抗體檢測方法的條件優化及效果檢驗
1.4.1 包被方案的確定及條件優化 用棋盤法對P30重組蛋白不同包被濃度(4~0.5 μg·mL-1)和口腔液樣品稀釋度(9∶1、8∶2、5∶5、2∶8、1∶9)進行優化;以最佳方案包被P30重組蛋白后,分別以5%脫脂乳、3%脫脂乳、1%水解乳蛋白、1%牛血清白蛋白(BSA)、1%酪蛋白(OXOID)和0.25%明膠作為封閉液,37 ℃封閉2 h后棄去,分別檢測2份ASFV抗體陰性口腔液和2份ASFV抗體陽性口腔液樣品,37 ℃溫育30~120 min后棄去液體,洗滌酶標板3次后加入不同稀釋比例的HRP-豬IgA單克隆抗體,置37 ℃溫育30~90 min后棄去液體,洗滌酶標板3次,加入TMB顯色液,37 ℃避光顯色5~20 min后終止反應。讀取OD450 nm值,計算P/N平均值。
1.4.2 臨界值CUT-OFF的確定 按照優化好的方案檢測219份健康豬口腔液樣品(其中育肥豬169份、母豬20份、保育豬30份),與其對應同一頭豬的血清樣品經金諾百泰公司非洲豬瘟病毒ELISA抗體檢測試劑盒鑒定為陰性,計算S/P值=(樣品的OD450 nm值-陰性對照的OD450 nm平均值)/(陽性對照的OD450 nm平均值-陰性對照的OD450 nm平均值),再計算所有樣品的S/P平均值(X)和3倍S/P值標準偏差(SD)之和,將X+3SD作為陰性血清的臨界值,小于等于臨界值判為陰性。大于臨界值判為陽性。
1.4.3 敏感性檢驗 取ASFV黏膜抗體陽性口腔液,按2倍比稀釋至128倍,利用本試驗建立的 ELISA方法進行檢測,評估該ELISA方法的靈敏度。
1.4.4 特異性檢驗 利用本試驗建立的間接ELISA方法分別檢測 CSFV、PRV、PRRSV黏膜抗體陽性口腔液,檢測該方法的特異性。
1.4.5 重復性與穩定性檢驗 取2份ASFV黏膜抗體陽性口腔液作為強陽性樣品、2份經16倍稀釋(PBS)的ASFV黏膜抗體陽性口腔液作為弱陽性樣品及4份陰ASFV黏膜抗體陰性口腔液作為陰性樣品,使用同批次包被的酶標板進行5次重復試驗,檢驗該方法的批次內穩定性;使用3個不同批次包被的酶標板進行檢測,檢驗該方法的批次間穩定性;分別以OD450 nm讀值計算出變異系數,分析該方法的穩定性。
1.4.6 抗體分泌規律檢驗 以本試驗建立ASFV間接ELISA黏膜抗體檢測方法檢測2頭經口鼻接種105TCID50ASFV強毒株HLJ/18后0、3、6 d的口腔液樣品(2頭試驗豬均在感染后第8天死亡)和2頭經口腔接種106TCID50ASFV人工致弱株HLJ/18-7GD后0、5、10、15、20、30、45、60 d的口腔液樣品,同時用金諾百泰公司ASFV ELISA抗體檢測試劑盒檢測同一頭豬的血清抗體,比較黏膜抗體和血清抗體的轉陽時間。
1.4.7 臨床樣品的檢測 用本研究建立的非洲豬瘟病毒間接ELISA黏膜抗體檢測方法對43份臨床口腔液樣品進行檢測,并將其中來自于人工感染豬的13份口腔液樣品和13份血清樣品,分別用本研究方法及商品化非洲豬瘟病毒血清抗體檢測試劑盒進行檢測并比較,計算符合率。
2 結 果
2.1 重組質粒的PCR產物及酶切鑒定
將人工合成的6×His-SUMO-P30基因克隆到pFastBac1載體上后,轉染SF9細胞,構建重組桿狀病毒vBAC-P30株。以提取的重組質粒為模板,通過PCR擴增獲得了大小約為981 bp的特異性目的條帶,與預期大小一致,測序結果通過比對顯示插入序列無突變和缺失,結果表明正確構建了重組桿狀病毒vBAC-P30株。
2.2 重組SUMO-P30蛋白的SDS-PAGE和Western blot鑒定
重組桿狀病毒vBAC-P30株在SF9細胞中傳代兩次后收獲培養液上清,經Ni柱親和純化后,對純化蛋白進行SDS-PAGE和Western blot鑒定。SDS-PAGE結果顯示,純化后出現一條約47 ku大小的單一條帶,Western blot結果顯示,其與ASFV抗體陽性血清在約47 ku大小左右位置出現特異性反應條帶(圖1);而與ASFV抗體陰性血清沒有出現特異性反應條帶,由此證明該SUMO-P30重組表達蛋白能夠被ASFV抗體識別,具有良好的反應原性。
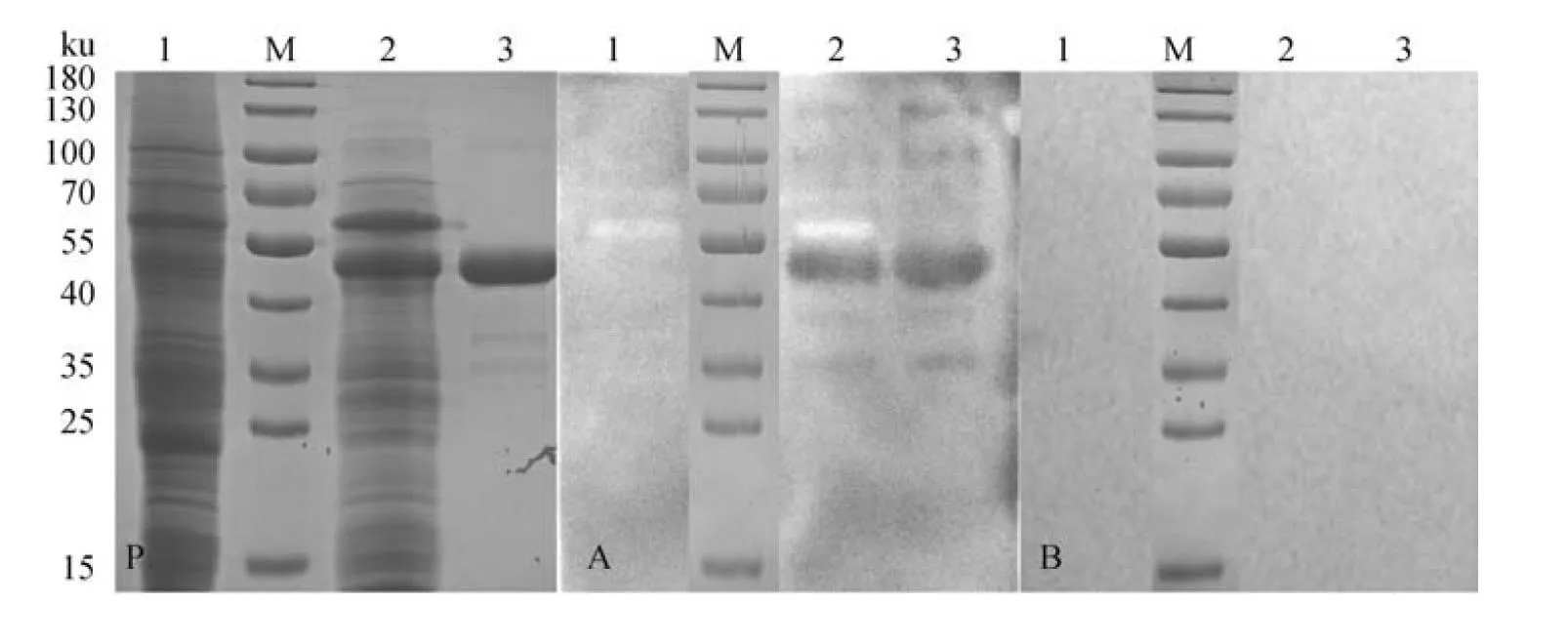
P.重組蛋白SUMO-P30純化前后PAGE分析;A.非洲豬瘟病毒抗體陽性血清;B.非洲豬瘟病毒抗體陰性血清。泳道:1.空載體pFastBac1-6×His-SUMO轉染SF9細胞破碎蛋白;M. Protein Marker;2.純化前的感染SF9細胞破碎蛋白;3.純化后的SUMO-P30重組蛋白 P. PAGE analysis of recombinant protein SUMO-P30 before and after purification; A. ASFV antibody positive serum; B. ASFV antibody negative serum. Lane: 1. Empty plasmid pFastBac1-6×His SUMO transfected SF9 cell disruption protein; 2. Infected SF9 cell disruption protein before purification; 3. Purified SUMO-P30 recombinant protein圖1 重組蛋白SUMO-P30的SDS-PAGE和Western blot分析Fig.1 SDS-PAGE and Western blot analysis of recombinant protein SUMO-P30
2.3 ASFV間接ELISA黏膜sIgA抗體檢測方法反應條件的優化結果
試驗結果顯示5%脫脂乳為最佳封閉液。P30重組蛋白的最佳包被濃度為1.0 μg·mL-1,口腔液樣品與5%脫脂乳的最佳比例為8∶2,待檢口腔液在37 ℃的最佳孵育時間為120 min;酶標抗體的最佳作用稀釋度為1∶5 000,最佳反應時間為60 min;TMB底物的最佳顯色時間為15 min。
2.4 臨界值的確定
按照優化好的方案檢測219份健康豬口腔液樣品(其中采集自育肥豬169份,母豬20份,保育豬30份,與其對應同一頭豬的血清樣品經金諾百泰公司ASFV ELISA抗體檢測試劑盒檢測為陰性),計算S/P值。結果顯示,所有陰性口腔液樣品的S/P平均值(X)為0.024,標準偏差(SD)為0.050,陰性樣品的S/P平均值+3倍標準差為0.174,考慮到臨床樣品的復雜性,適當放寬陽性樣品判定的臨界值,即當樣品的S/P值<0.2時判為陰性,當樣品的S/P值≥0.2時判為陽性(圖2)。
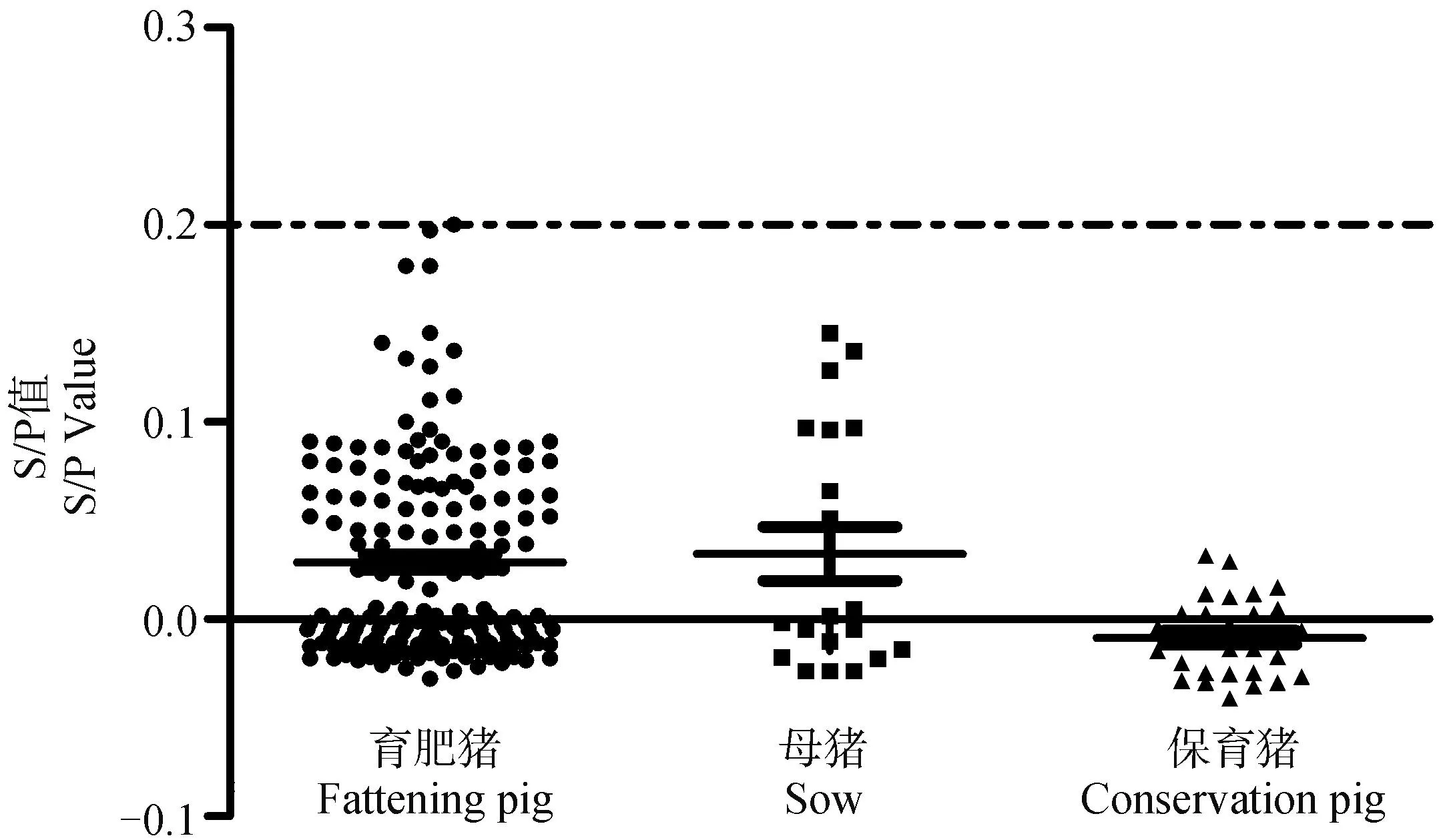
圖2 陰性口腔液樣品的黏膜sIgA抗體ELISA檢測結果(n=219)Fig.2 ELISA results of mucosal sIgA antibody in negative oral fluid samples(n=219)
2.5 敏感性檢驗
利用本研究建立的間接ELISA方法檢測經PBS作1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128稀釋的ASFV黏膜sIgA抗體陽性口腔液,結果顯示,2份ASFV黏膜sIgA抗體陽性口腔液的最大稀釋倍數均為1∶32(圖3),表明該方法具有較好的敏感性。
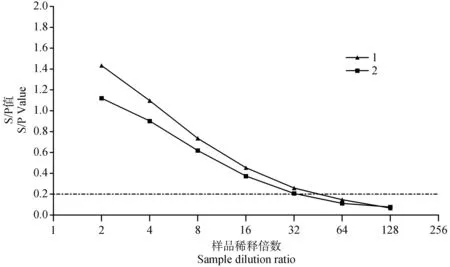
圖3 敏感性試驗結果Fig.3 Sensitivity test results
2.6 特異性檢驗
利用本研究建立的間接ELISA方法分別檢測 CSFV、PRV、PRRSV黏膜sIgA抗體陽性口腔液,結果如表1所示,該方法能夠特異性檢測 ASFV黏膜sIgA抗體口腔液,具有良好的特異性。
2.7 重復性與穩定性檢驗
利用建立的ASFV間接ELISA 黏膜sIgA抗體檢測方法對8 份口腔液樣本進行批次內及批次間重復試驗,結果顯示其變異系數均小于15%(表2),表明該方法具有較好的穩定性。
2.8 黏膜sIgA抗體分泌規律
以本研究建立的ASFV間接ELISA黏膜sIgA抗體檢測方法檢測2頭經口鼻感染 ASFV強毒株HLJ/18后0、3、6 d的口腔液樣品(2頭試驗豬均在感染后第8天死亡)和2頭經口腔接種106TCID50ASFV人工致弱株HLJ/18-7GD后0、5、10、15、20、30、45、60 d的口腔液樣品,同時用金諾百泰公司ASFV ELISA抗體檢測試劑盒檢測同一頭豬的血清抗體,結果如圖4所示,感染ASFV強毒株HLJ/18后第3天就有1頭豬可檢測到口腔液中的ASFV特異性黏膜sIgA抗體轉陽,到感染后第6天,兩頭豬均可檢測到黏膜sIgA抗體轉陽,而兩頭豬的血清抗體在感染后的第6天仍為陰性(圖4A)。感染人工致弱株HLJ/18-7GD后,口腔液中的ASFV特異性黏膜sIgA抗體最早在第5天就顯著提升,30~45 d后可穩定檢出抗體陽性;血清抗體在監測期內一直未檢測到轉陽(圖4B)。
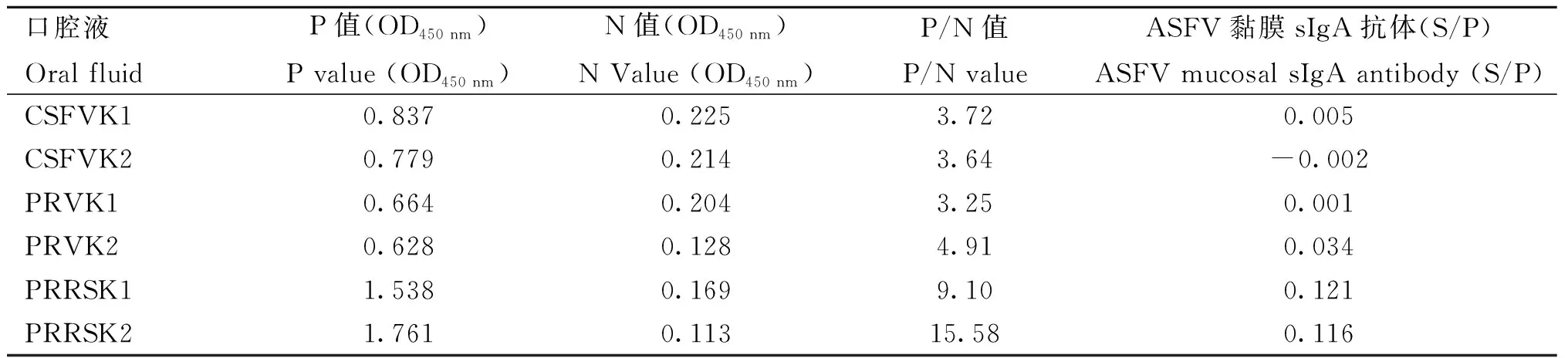
表1 特異性試驗結果Table 1 Specific test results
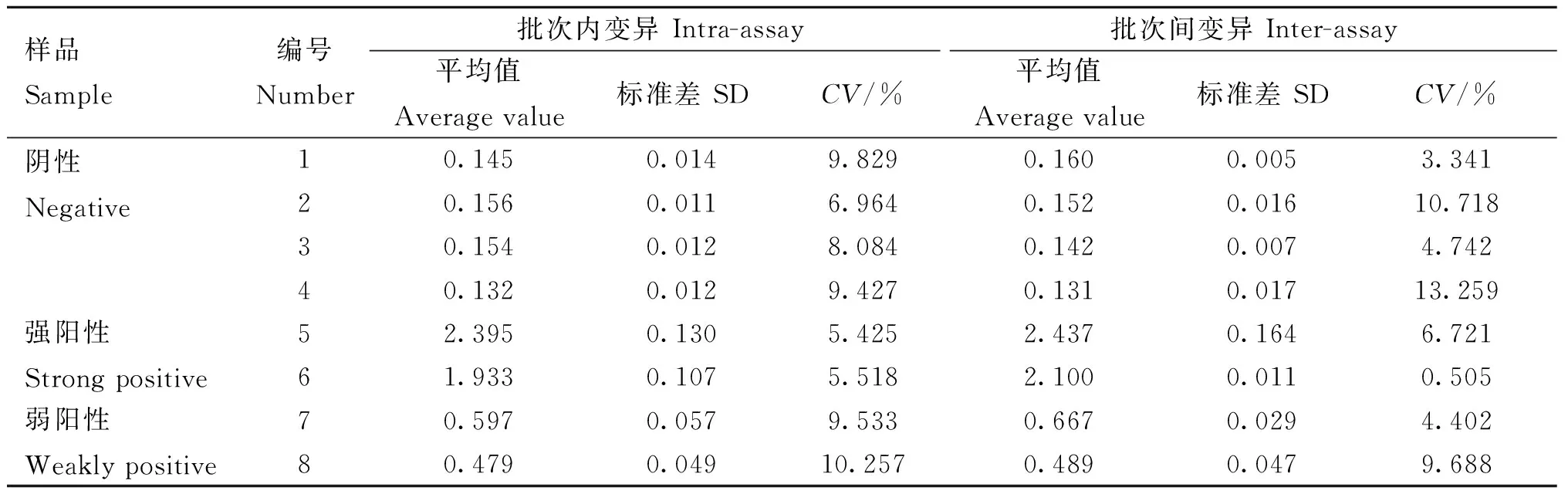
表2 ASFV間接ELISA 黏膜sIgA抗體檢測方法的重復性試驗結果(OD450 nm值)Table 2 Repeatability test results of ASFV indirect ELISA mucosal sIgA antibody detection method(OD450 nm value)

A. 感染強毒株HLJ/18;B. 口腔接種人工致弱株HLJ/18-7GD。血清IgG抗體的判定標準:S/P值>0.4為陽性,S/P值≤0.4為陰性;黏膜sIgA抗體的判定標準:S/P值≥0.2為陽性,S/P值<0.2為陰性 A. Infected with virulent strain HLJ/18; B. Oral inoculation of artificially attenuated strain HLJ/18-7GD. The determination standard of serum IgG antibody: S/P value > 0.4 is positive, and S/P value ≤ 0.4 is negative; The determination standard of mucosal sIgA antibody: S/P value ≥ 0.2 is positive, and S/P value<0.2 is negative圖4 人工感染ASFV后黏膜抗體與血清抗體的分泌規律Fig.4 Secretion patterns of mucosal and serum antibodies after artificial infection with ASFV
2.9 臨床樣品的檢測
用本研究建立的非洲豬瘟病毒間接ELISA黏膜抗體檢測方法對43份臨床口腔液樣品進行檢測,其中采集自2018年以前的30份口腔液樣品均為陰性;采集自人工感染豬的13份口腔液樣品中有10份陽性,而對應的13份血清樣品經商品化非洲豬瘟病毒血清抗體檢測試劑盒檢測出5份為陽性。本研究方法與商品化血清抗體檢測試劑盒的檢測陽性符合率為100%,陰性符合率為37.5%,總符合率為61.5%。
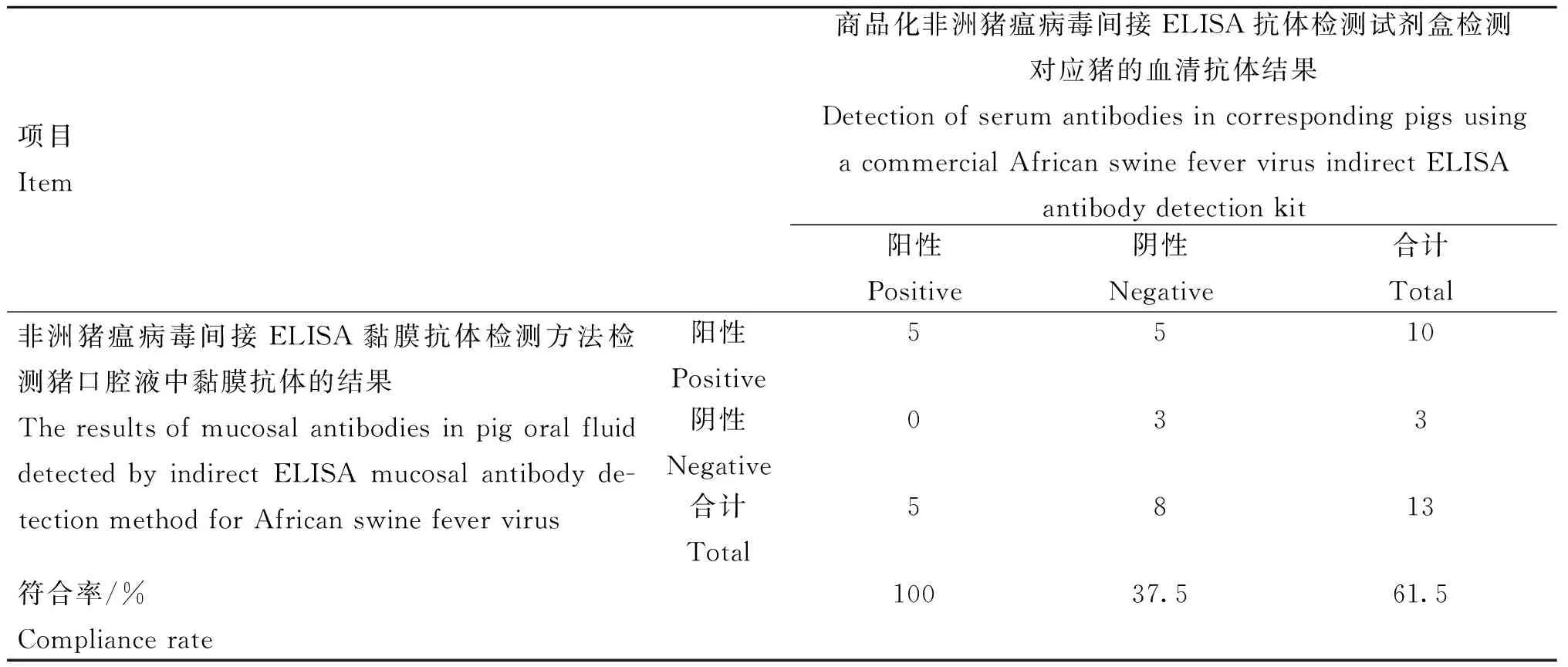
表3 13份臨床口腔液與13份血清樣品檢測結果符合率Table 3 Compliance rate of 13 clinical oral fluid samples and 13 serum samples detection results
3 討 論
ASF于2018年傳入我國,是一種急性、熱性、感染病死率高達100%的烈性傳染病,給我國養豬業造成了嚴重的損失[2-3]。經過近4年的傳播,國內出現了部分自然變異弱毒株,其致病力發生一定程度減弱,引起的臨床癥狀不明顯,傳播不易引起注意,更容易造成大面積擴散,對其根除也將變得困難[20-21]。當豬被低毒力毒株感染時,高特異性與靈敏度的抗體診斷可能是監測被感染動物的最佳方法。目前,我國商品化的ASFV抗體檢測試劑盒都是檢測血清中的抗體,在ASFV的監測和防控工作中被應用,但其檢測敏感性仍有待進一步提高[22-24]。而豬的機體在應答ASFV感染時,除了血清中產生特異性的IgG抗體外,在呼吸道與消化道黏膜還可產生特異性的sIgA抗體。sIgA抗體主要存在于呼吸道分泌液、唾液、淚液、乳汁、胃腸分泌液和泌尿生殖道分泌液中,是機體黏膜免疫的主要抗體,也是病原體通過侵入后最先產生的免疫反應。ASFV作為一種主要通過口鼻途徑傳播的病原,口腔液中的 sIgA抗體非常適合作為早期檢測的抗體樣本。另外,以口腔液為檢測樣品而替代常規的血清樣品,在樣品采集的操作上更為方便,也更加符合動物福利的要求。
P30蛋白是 ASFV較為保守的主要結構蛋白,在感染早期表達和分泌,感染后4 h即可在細胞漿中檢測到P30,可用于感染早期的檢測[25-27],是目前國內外最常選擇的檢測靶標蛋白之一[22,28-33]。本研究選擇利用昆蟲細胞表達系統來表達P30蛋白,并且通過在目標蛋白前增加SUMO標簽和His標簽,使P30蛋白呈可溶性表達,且表達量可達每100 mL的SF細胞產出10 mg以上的純化蛋白,大大提高了P30蛋白的產出。通過與ASFV陰、陽性血清的Western blot試驗結果表明,SUMO和His標簽不會影響試驗的特異性。為之后產業化降低成本提供了可能。
在確定臨界值的試驗中,由于大量的臨床陽性樣品難以得到,本研究通過用大量的臨床陰性樣品的S/P平均值+3倍的標準差來確定,結果發現仍有個別樣品的S/P值在0.174以上,考慮到臨床樣品的復雜性,將判定臨界值確定為0.2以減少檢測的假陽性。在特異性檢驗試驗中,由于沒有CSFV、PRV、PRRSV黏膜抗體陽性口腔液標準品,本研究通過檢測接種相應的弱毒活疫苗后不同時間點的口腔液發現,免疫后28 d時,用相應病毒的商品化抗體檢測試劑盒中的抗原包被板檢測口腔液樣品,以超過對照未免豬的口腔液檢測值的2.1倍為閾值線,均可判為陽性,可作為CSFV、PRV、PRRSV黏膜抗體陽性口腔液樣品使用。
在檢測經口鼻接種ASFV強毒株HLJ/18后的口腔液樣品結果顯示,感染強毒株后第3天即可從口腔液中檢測到的ASFV特異性黏膜sIgA抗體,而血清抗體在感染后的第6天仍為陰性。在檢測口服接種ASFV基因缺失株HLJ/18-7GD后的抗體分泌規律試驗中,有1頭豬口腔液中的黏膜sIgA抗體最早感染后5 d,S/P值就顯著提升,但在隨后的10、15和20 d三個時間點不能穩定的檢測到特異性黏膜抗體,直到接種后第30天以后才可穩定的檢測到特異性黏膜抗體,這可能是由于口腔液中的黏膜抗體不均一,或采樣前試驗豬喝水導致口腔液被稀釋等原因造成。本研究中,試驗豬經口服接種ASFV基因缺失株HLJ/18-7GD后,血清抗體雖在監測末期出現提升,但在整個監測期內一直未檢測到轉陽,這與以前發表的報道中,以相同劑量肌肉注射14 d后出現血清抗體轉陽不一致[34]。這可能與ASFV弱毒株以不同的接種方式感染后,在體內增殖效率及抗體應答能力的差異有關。
在檢測口腔液中ASFV黏膜sIgA抗體分泌規律試驗中,本研究只統計了2頭試驗豬的樣品,數量較少,但表現出了一致的趨勢。自然變異弱毒株的感染在目前臨床上較為多見,給常規的核酸檢測與血清抗體檢測帶來很大挑戰。本研究建立的黏膜sIgA抗體檢測方法在自然變異弱毒株感染的檢測中,相比常規的血清抗體檢測方法體現出更為敏感的優勢,可實現ASFV感染的早期與敏感診斷。另外,在目前越來越注重ASFV精準防控和提高動物福利的大環境下,無需采集血清即可快速檢測ASFV感染的方法具有廣闊的應用前景。
4 結 論
本研究通過昆蟲細胞系統表達了ASFV的SUMO-P30蛋白,并建立了ASFV黏膜sIgA抗體的間接ELISA檢測方法,可從感染豬的口腔液中檢測到特異性sIgA黏膜抗體,陽性口腔液的最大稀釋度可達1∶32,且不與CSFV、PRV、PRRSV黏膜抗體陽性口腔液反應,感染ASFV后3~5 d,S/P值就顯著提升,具有良好的敏感性和特異性。為ASFV的早期血清學診斷方法提供了新的思路,為ASFV的防控提供了科學工具。

