環狀RNA在大腦功能調控及藥物成癮中的作用研究進展
楊茜茜,高菲菲,楊瀟宇,高靖麒,張玉向,閻春霞
(1.西安交通大學醫學部法醫學院,陜西西安 710061;2.國家衛健委法醫學重點實驗室,陜西西安 710061;3.西安交通大學中國西部科技創新港生物證據研究院,陜西西安 710100)
在人類基因組中約2%的基因編碼蛋白質,絕大部分DNA 序列轉錄產生的是非編碼RNA[1]。環狀RNA(circular RNA,circRNA)是一類特殊的非編碼RNA,由稱為反向剪接(back-splicing)的非規范剪接事件產生。20世紀70年代后期,借助電子顯微鏡的高分辨率成像,circRNA 在真核生物的細胞質中首次被發現[2]。然而,circRNA 在當時被認為是異常剪接產生的副產物,并沒有受到關注[3]。近年來,核糖體RNA 耗盡的高通量RNA 測序和高靈敏circRNA 芯片技術的發展為circRNA 的檢測提供高效平臺。借助circRNA注釋的特異性生物信息學算法,研究人員已在哺乳動物中鑒定出豐富的circRNA。circRNA 在中樞神經系統大量表達,尤其在神經元突觸中顯著富集,且在神經發育和神經發生過程中動態調節[4]。circRNA 在神經系統生理功能及神經精神疾病的發生機制中具有重要的調控作用,如阿爾茨海默病(Alzheimer disease,AD)[5]、藥物成癮[6]和重度抑郁癥[7]等。藥物成癮是一種以強迫性覓藥和用藥為特征的慢性復發性腦疾病,涉及前額葉皮質(prefrontal cortex,PFC)、腹側被蓋區(ventral tegmental area,VTA)和伏隔核(nucleus accumben,NAc)等構成腦獎賞環路的多個相關腦區的神經適應性變化。有研究發現,腦內circRNA參與調控藥物成癮,為研究毒品的作用機制開辟了新思路。本文綜述了circRNA的生物發生和功能機制,探討circRNA 在大腦功能調控和藥物成癮中的潛在作用和研究進展,以期為藥物成癮防治提供新靶點。
1 環狀RNA的生物合成和功能
1.1 生物合成
circRNA 在哺乳動物真核轉錄組中廣泛表達,并顯示出細胞或組織類型的特異性[8]。根據來源基因組序列,circRNA 通常被分為3 種亞型,分別是外顯子circRNA、內含子circRNA 和外顯子-內含子circRNA[9]。除胞核基因組外,線粒體基因組也產生一類circRNA,即線粒體circRNA[10]。目前認為,除內含子circRNA 以標準線性剪接方式形成內含子套索外,大部分外顯子來源circRNA通過前體mRNA的反向剪接產生[11]。反向剪接是一種特殊形式的剪接方式,主要用于circRNA 環化。在反向剪接過程中,前體mRNA下游外顯子3′端受體剪接位點與上游外顯子5′端供體剪接位點共價結合形成單鏈閉合環狀結構。因此,circRNA 不具有5′端帽子結構與3′端多聚腺苷酸尾巴,其結構比mRNA分子更穩定并耐受核酸外切酶介導的降解[12]。
研究表明,在反向剪接過程中,內含子配對驅動的環化受順式作用元件和反式作用因子的共同調節[12]。位于側翼內含子內的反向重復序列負責順式調節。反向重復Alu 序列(Alu sequence)可使上、下游外顯子的剪接位點彼此靠近并促進反向剪接。側翼長內含子和豐富的互補序列為反式作用因子提供更多潛在結合位點。反式因子通常可以促進circRNA 表達,多種RNA 結合蛋白如信號轉導與RNA 激活家族成員Quaking(QKI)、肉瘤融合蛋白(fused in sarcoma,FUS)和核不均一核糖核蛋白等,可與側翼內含子中的特定基序結合,在circRNA 生物合成的反式調節中起重要作用。此外,白細胞介素增強子結合因子3的蛋白異構體核因子90 和核因子110 可通過穩定內含子促進circRNA產生[13]。相反,RNA 特異性腺苷脫氨酶及ATP 依賴性RNA 解旋酶A 可抑制內含子序列環化,阻止circRNA 生物合成[14-15]。基因表觀遺傳修飾也能對circRNA 合成產生直接影響,如敲低DNA 甲基轉移酶3B 引起獨立于宿主基因線性轉錄本的circRNA表達改變[16]。此外,circRNA兩側的同源序列、剪接位點和功能元件與circRNA跨物種的高保守性也密切相關[17]。
1.2 功能
circRNA 可通過多種機制發揮功能調控作用。位于細胞質的circRNA 可作為競爭性內源性RNA(competitive endogenous RNA,ceRNA),通過海綿吸附微RNA(microRNA,miRNA)調節下游靶基因的表達[18]。位于細胞核的circRNA 可調節宿主基因或其他基因的轉錄[19-20]。circRNA 還可作為吸附蛋白質的海綿或誘餌[5,21-23]、酶-底物反應的支架[24-25]或將蛋白質募集到特定位置發揮作用[26],部分circRNA 還具有翻譯多肽的潛力[27-28]。總之,circRNA 可在轉錄、轉錄后和蛋白質翻譯等水平調控基因表達,廣泛參與機體重要生命過程。
在神經系統中,部分circRNA 展現出典型的miRNA 海綿活性[18]。小腦變性相關蛋白1 反義轉錄物(cerebellar degeneration-related protein 1 antisense,CDR1as)是發揮miRNA 分子海綿作用的經典circRNA,具有70 多個miR-7 保守結合位點。在AD 患者的海馬中,CDR1as 的下調將釋放出游離的miR-7 抑制泛素結合酶E2 A(ubiquitin conjugating enzyme E2 A,UBE2A)表達,從而調節神經組織淀粉樣變病理過程[29]。CDR1as/miR-7軸也參與調控帕金森病(Pakinson disease,PD)患者大腦黑質中α-突觸核蛋白的積累和聚集[30]。circRNA 與蛋白質相互作用的首次報道是黑腹果蠅編碼肌盲樣蛋白1(muscle blind-like protein 1,Mbnl1)的反饋調節研究[21]。Mbnl1通過結合circMbl的側翼內含子可促進circMbl 的生成。過表達的circMbl 導致Mbnl1的線性剪接減少,同時circMbl會與過量的Mbnl1結合,反而抑制Mbnl1參與功能調控。部分神經系統circRNA 還可以作為RNA 結合蛋白的調控因子,如circHomer1a 與一種高度保守的神經元特異性RNA 結合蛋白Hu 抗原D(Hu antigen D,HuD)結合,影響HuD 在額葉皮質神經元突觸中的表達[23],circSTAG1 可捕獲N6-甲基腺嘌呤(N6-methyladenosine,m6A)去甲基化酶烷基化修復同源物5 并減少其向細胞核的易位[22],circ-Cwc27 與富含嘌呤元件結合蛋白α(purine-rich element binding protein alpha,PUR-α)結合,增加PUR-α 在細胞質中的保留,并抑制其募集到AD 相關基因的啟動子[5]。
此外,部分circRNA 與蛋白質的相互作用不會抑制蛋白質功能,而是形成參與基因調控的復合物,如circFOXO3通過與細胞周期蛋白依賴性激酶2(cyclin-dependent kinase 2,CDK2)和CDK 抑制劑1A相互作用,通過影響CDK2功能來促進細胞周期進程[24];circACC1 充當AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)全酶的RNA 成分,通過與調節性AMPK 的β 和γ 亞基形成三元復合物來穩定和促進AMPK 酶活性[25]。細胞核內circKcnt2通過將核小體重塑及組蛋白去乙酰化酶復合物募集到堿性亮氨酸拉鏈轉錄激活因子的啟動子上來抑制其基因表達,從而促進結腸炎消退[26]。研究表明,定位于人類細胞核的circRNA,如源自錨蛋白重復結構域52(ankyrin repeat domain 52,ANKRD52)的ci-ankrd52、源自真核翻譯起始因子3亞基J(eukaryotic translation initiation factor 3 subunit J,EIF3J)的circEIF3J 和源自多聚腺苷酸結合蛋白相互作用蛋白2〔poly(A)binding protein interacting protein 2,PAIP2A〕的circPAIP2,主要通過與RNA 聚合酶Ⅱ和U1 小核糖核蛋白復合物相互作用分別調控親本基因ANKRD52,EIF3J和PAIP2A的轉錄[19-20]。
最近研究表明,circRNA 除可發揮多種非編碼作用外,部分外顯子衍生的circRNA 具有內部核糖體進入位點和開放閱讀框,可被翻譯成蛋白質或多肽[28]。然而,核糖體結合并不總能促使circRNA 自身的翻譯,如源自多聚腺苷酸結合蛋白1〔poly(A)binding protein nuclear 1,PABPN1〕的環狀RNA circPABPN1[31]可調節其同源線性PABPN1mRNA的翻譯而非自身翻譯。此外,m6A是RNA修飾最豐富的類型,除具有調節circRNA穩定性的經典功能,還可使用m6A修飾位點的短序列作為內部核糖體進入位點,以不依賴帽的方式驅動circRNA翻譯[27]。
2 環狀RNA 參與調控大腦生理功能及神經系統疾病
相對于其他組織,circRNA 在腦中顯著富集,表現出高豐度、動態表達和時空調節等特征[32],在小腦、海馬、PFC 和嗅球區域大量表達[8]。在哺乳動物大腦中,已知約20%蛋白質編碼基因可產生circRNA[21]。在人腦背外側PFC(dorsolateral PFC,dlPFC)中已鑒定出超過9 萬種circRNA[33],根據序列同源性和反向剪接位點特征,中樞神經系統circRNA 被認為在哺乳動物間有較高的保守性[8,34]。盡管大多數circRNA 的生物學功能尚未明確,但越來越多的證據表明,circRNA 對于大腦生理功能至關重要,并通過多種機制廣泛參與神經精神類疾病的調控。
2.1 參與調控神經發育
Rybak-Wolf 等[8]發現,在人類和小鼠等哺乳動物大腦,以及人源和鼠源的體外神經元中,都有大量高度保守的同源circRNA 表達。部分circRNA在小鼠畸胎瘤細胞P19、人神經母細胞瘤細胞SH-SY5Y 的分化階段差異表達,表明突觸富集的circRNA 在大腦發育和神經元分化中具有重要作用。大腦富含的多種circRNA 與神經遞質功能、神經元成熟和突觸活動有關,如人類妊娠中期胎兒大腦中circRNA 表達上調與其大腦發育呈現同步變化[35],并且大量circRNA 在突觸發生期間表達豐度改變,宿主基因的GO 功能注釋結果與突觸功能顯著相關等。此外,Maass 等[36]鑒定了339個源自大腦皮質的circRNA,其中141個僅在皮質中表達。值得注意的是,這些大腦皮質特異circRNA 通常來自神經疾病相關基因。總之,腦中circRNA 參與神經分化和突觸可塑性的動態調節,在腦生理功能調節中發揮重要作用。
2.2 參與大腦衰老進程
大腦衰老機制復雜,受多重因素共同調控,其中隨年齡和環境變化的表觀遺傳被認為是重要的調控環節。研究表明,部分circRNA 在老年小鼠突觸體中表達豐度增加,表現出年齡依賴的獨特表達模式[37]。衰老是人認知能力下降的主要原因,通常與PFC 和海馬中突觸可塑性的改變有關[38]。有研究揭示circRNA在衰老進程中顯示出年齡偏倚的動態變化,并且衰老相關circRNA 與其宿主mRNA 表達水平存在負性調節[39-40]。例如,circGRIA1 是一種靈長類動物保守的circRNA,由谷氨酸離子型受體α-氨基-3-羥基-5-甲基-4-異惡唑丙酸亞基1(GRIA1)衍生,在老年雄性獼猴的PFC 和海馬中表達增加。功能上,circGRIA1 通過順式作用于宿主基因啟動子,負向調節GRIA1 mRNA 和蛋白質表達,從而介導年齡誘導的鈣穩態失衡、突觸發生減少和突觸可塑性缺陷[40]。電壓門控鈣通道在維持鈣穩態和神經元細胞信號傳遞中有重要作用。circ-CACNA1E 和circCACNA2D1 是年齡相關鈣通道基因衍生的circRNA,在衰老恒河猴大腦中顯著增加,并且與宿主基因線性mRNA 表達呈負相關。敲低circCACNA2D1 和circCACNA1E 可逆轉衰老導致的鈣通道基因表達水平下降。因此,circRNA 表達變化可能對衰老過程中大腦功能失調極為重要。隨著越來越多的神經系統功能性circRNA 被鑒定,進一步證實circRNA 的時空動態表達對于大腦生理穩態的維持至關重要。
2.3 參與調控神經退行性疾病
大腦中circRNA表達失調被認為在神經退行性疾病的發病機制中發揮重要作用。CDR1as在健康的人腦中表達量豐富,在AD 患者的大腦中表達量顯著下調[41]。CDR1as 除可通過miR-7/UBE2A 調控軸介導β-淀粉樣蛋白的水解外[29],還可抑制NF-κB的翻譯并誘導其細胞質定位,以下調泛素C 端水解酶L1 的方式促進β-淀粉樣前體蛋白(β-amyloid precursor protein,APP)和APP 裂解酶1 的降解[42]。此外,Mo 等[43]研究表明,源自APP基因β-淀粉樣蛋白編碼區的circRNA通過調節糖原合酶激酶3β 的表達促使tau 蛋白磷酸化,并促進其聚集成神經纖維纏結,在AD 發病機制中發揮重要作用。PD 是發病率僅次于AD 的第二大神經退行性疾病。Jia 等[44]發現,PD 模型小鼠多腦區circRNA 表達譜顯著改變。源自盤狀大同源相關蛋白4(discs large homologous affinity protein 4,DLGAP4)的circDLGAP4 在PD 患者大腦中顯著下調,circDLGAP4 可通過miR-134-5p/CREB 軸激活下游靶基因,發揮神經保護作用[45]。源自溶質載體家族8 成員a1(solute carrier family 8 member a1,SLC8A1)的circSLC8A1 在PD 患者大腦黑質中表達上調,circSLC8A1 可通過miR-128/AGO2 軸在氧化應激中發揮作用,參與調節PD 發病機制[46]。肌萎縮性側索硬化癥可導致腦干和脊髓選擇性運動神經元(motor neurons,MN)的喪失。D′ambra 等[47]在MN 中檢測到源自肝癌衍生生長因子相關蛋白3(hepatoma-derived growth factor-related protein 3,HDGFRP3)的circHDGFRP3。研究結果顯示,在攜帶突變型FUS的MN 中,circHDGFRP3 沿神經突的運輸被阻滯在FUS 聚集體中[47],豐富肌萎縮性側索硬化癥的發病機制假說。總之,多種circRNA 通過調節疾病相關肽的產生和降解、神經自噬、神經炎癥和氧化應激等生物功能,在神經退行性疾病的發生發展中發揮重要作用,為疾病提供診療靶點。
2.4 參與調控精神疾病
非編碼RNA 在精神類疾病的發病機制中起重要作用,包括重度抑郁癥、雙相情感障礙(bipolar disorder,BD)和精神分裂癥(schizophrenia,SCZ)等[48]。Mahmoudi 等[33]對SCZ 患者尸檢腦組織的RNA 測序分析顯示,circRNA 表達在dlPFC 中具有多樣性,但SCZ 患者的表達譜復雜程度降低,circRNA 總體呈現下調趨勢。全基因組關聯分析(genome-wide association studies,GWAS)通過在人類基因組范圍內篩選與精神類疾病顯著相關的單核苷酸多態性(single nucleotide polymorphism,SNP)位點,推動了對精神類疾病的病因關聯機制的研究。Liu等[49]開展的關聯研究結果顯示,將dlPFC中circRNA 的表達水平與SNP 相結合,可鑒定出豐富的受遺傳變異調節的circRNA數量性狀位點(circRNA quantitative trait loci,circQTL)。研究發現,circQTL SNP 可通過改變規范剪接位點或反向互補序列的匹配來調控circRNA 的產生。此外,circQTL SNP 顯著富集與各種復雜疾病相關的GWAS 變異,其中circQTL SNP 的一個子集與精神分裂癥的GWAS 信號高度相關。起源自荷馬支架蛋白1(homer scaffold protein 1,HOMER1)的circHomer1a是一種顯著富集于神經元并在物種間進化保守的circRNA。circHomer1a 在健康人額葉皮質中大量表達,而在SCZ 和BD 患者額葉皮質中顯著下調,且其表達變化與SCZ 的發病年齡呈正相關。進一步分析表明,circHomer1a 通過與神經元RNA 結合蛋白HuD 相互作用可調節突觸可塑性以及和重度抑郁癥等精神疾病相關基因mRNA 異構體的表達。BD 或SCZ 患者臨床上表現出與眶額皮質(orbitofrontal cortex,OFC)功能密切相關的認知功能障礙,而敲低OFC 腦區circHomer1a 可損害OFC 介導的對認知和行為靈活性的調節[23]。自閉癥譜系障礙(autism spectrum disorder,ASD)患者大腦內也存在疾病相關的基因表達失調。一項關于ASD 的circRNA 表達譜研究揭示,源自腺嘌呤-胸腺嘧啶豐富結構域1A(AT-rich interactive domain 1A,ARID1A)的circARID1A 在患者尸檢大腦皮質中顯著上調。circARID1A 可通過競爭性結合miR-204-3p 間接調節ASD 風險基因的表達,從而影響記憶鞏固和加強的動態過程[50]。此外,采用慢性不可預見性應激誘導小鼠抑郁模型研究顯示,小鼠海馬內過表達源自基質抗原1 的circRNA(stromal antigen 1 circRNA,circSTAG1)可顯著改善小鼠抑郁樣行為,其機制為過表達circSTAG1 可捕獲胞漿內m6A 去甲基化酶AlkB 同源物5,抑制其胞核轉運,由此引發胞核內脂肪酸酰胺水解酶的甲基化修飾,脂肪酸酰胺水解酶mRNA 上的m6A 修飾增多并誘導其降解,從而緩解小鼠抑郁樣行為[22]。值得注意的是,外周血circRNA 表達異常也參與中樞神經系統疾病的調控。研究發現,源自迪格弗-梅爾基奧爾-克勞森綜合征蛋白(Dymeclin,DYM)編碼基因的circRNA(circDYM)在重度抑郁癥患者血液中表達顯著降低,過表達circDYM可抑制miR-9活性,導致下游靶標同源E6-AP 羧基末端結構域E3 泛素蛋白連接酶1 表達增加,促進熱休克蛋白90 泛素化,導致小膠質細胞活化減少,從而改善抑郁樣行為[7]。以上研究表明,circRNA 可作為精神類疾病潛在的分子標記和治療靶點。
3 環狀RNA在藥物成癮中的作用
藥物成癮是由藥物濫用所引起的慢性、復發性腦疾病,主要表現為不計后果地覓藥、強迫性用藥及撤藥后出現強烈的戒斷癥狀,導致長久的軀體和精神依賴[51]。近來研究表明,長期藥物濫用誘導的突觸可塑性改變導致牢固的病理性成癮記憶和與成癮相關的持久行為異常[52]。大腦中富集的circRNA 對成癮過程中神經適應性改變有重要調節作用。盡管circRNA在神經退行性疾病中被廣泛研究,但其在藥物成癮中的生物學功能最近才被部分揭示(表1)。
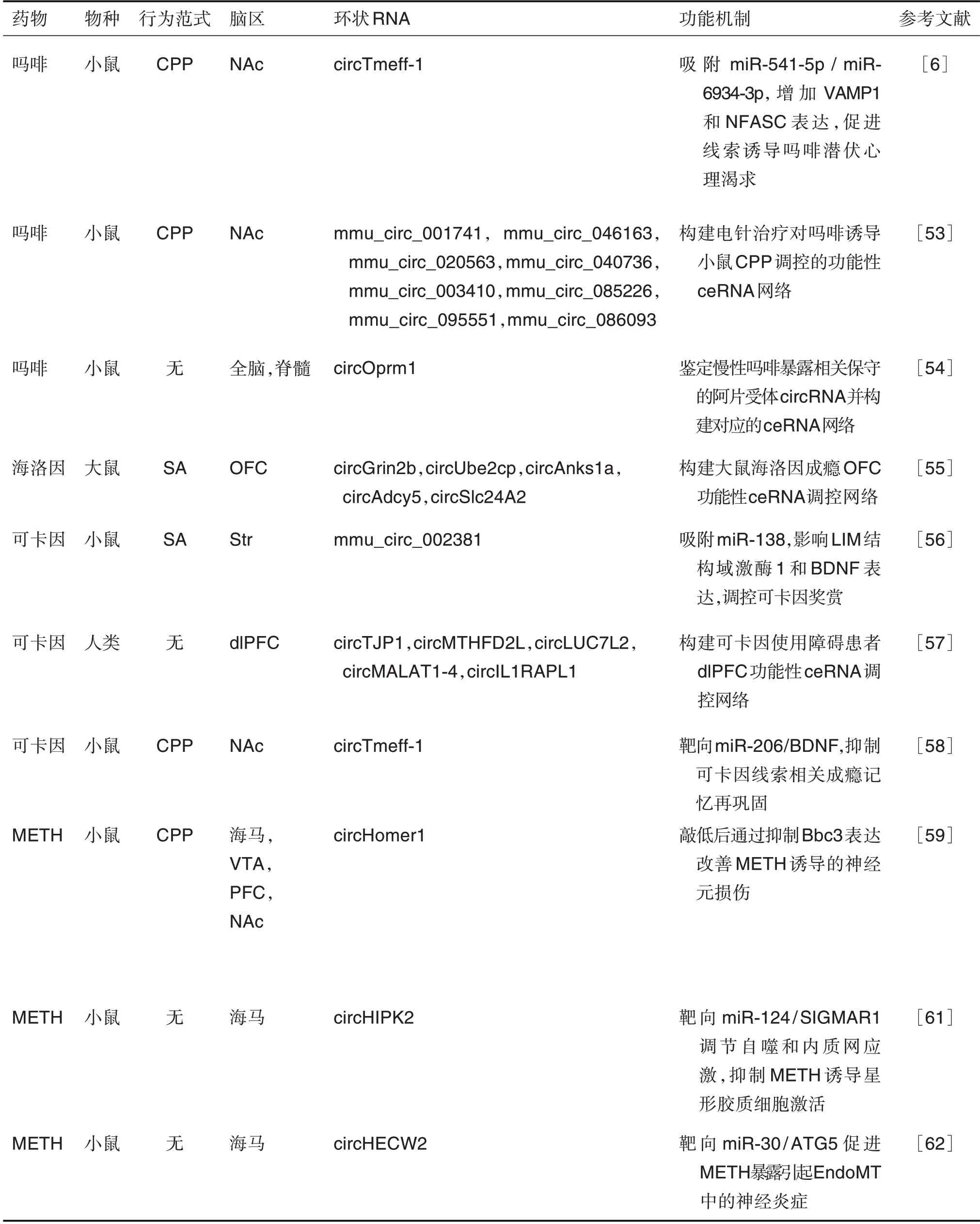
表1 環狀RNA在藥物成癮中的調控作用
3.1 環狀RNA與阿片類藥物成癮
采用條件性位置偏愛(conditioned place pref-erence,CPP)范式建立環境線索相關獎賞記憶模型,Zhang 等[53]首次檢測電針治療對嗎啡依賴小鼠NAc 中circRNA 表達譜的改變,并預測了關鍵差異circRNA 的潛在結合miRNA。Irie 等[54]在嚙齒動物和人類的大腦、脊髓和神經母細胞瘤細胞中均檢測到來源于μ 阿片受體基因Oprm1的circRNA(circOprm1)。在小鼠慢性嗎啡暴露后,circOprm1表達水平顯著增加。基因序列分析表明,circOprm1具有潛在的miRNA結合位點,可通過競爭性內源性RNA 網絡發揮調控作用。此外,其他阿片受體基因,如δ 阿片受體基因Oprd1,κ 阿片受體基因Oprk1和阿片類藥物相關傷害感受素受體基因Oprl1均產生類似的circRNA。Floris 等[55]從大鼠的OFC 中鑒定出海洛因相關的差異表達circRNA,其中circGrin2b,circUbe2cp,circAnks1a,circAdcy5和circSlc24A2 差異最為顯著,且不受其他精神興奮劑的調節,表現出對阿片類藥物的特異性反應。GO 分析和KEGG 通路富集分析表明,失調circRNA 的宿主基因主要富集到突觸可塑性相關通路,如內吞循環、長時程增強和谷氨酸能突觸傳遞等。Yu 等[6]發現,circTmeff-1 在嗎啡誘導CPP 戒斷后的NAc 核心中高表達,且與條件線索誘導的嗎啡潛伏心理渴求密切相關。在嗎啡長期戒斷后,circTmeff-1可作為miRNA的分子海綿,吸附NAc核心中的miR-541-5p和miR-6934-3p,促進下游靶分子囊泡相關膜蛋白1(vesicle associated membrane protein 1,VAMP1)和神經成束蛋白(neurofascin,NFASC)的表達,從而促進線索誘導的嗎啡潛伏心理渴求。
3.2 環狀RNA與可卡因成癮
Bu 等[56]利用circRNA 芯片研究可卡因自身給藥小鼠紋狀體circRNA 表達譜的變化,結果顯示,mmu_circRNA_002381 和mmu_circRNA_003834在給藥組中顯著上調,而mmu_circRNA_002520顯著下調。預測結合miRNA 進一步揭示,上述circRNA 均包含豐富的miRNA 應答元件,能夠與多種突觸可塑性和成癮相關的miRNA 結合,其中mmu_circRNA_002381 包含10 個miR-138 的miRNA應答元件,功能驗證發現mmu_circRNA_002381參與調節LIM 結構域激酶1 和腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)的轉錄,有助于可卡因誘導的神經可塑性的調節。Chen等[57]探究circRNA 在可卡因使用障礙患者dlPFC中的功能作用和調節機制。富集分析表明,可卡因誘導的差異circRNA主要在細胞反應、受體信號、蛋白修飾和軸突發生等相關通路富集。circRNAmiRNA-hub 基因調控子網絡進一步揭示了關鍵差異表達circRNA 的ceRNA 調控機制,為可卡因使用障礙的發病機制提供新見解。Shen 等[58]使用可卡因誘導的CPP 范式建立環境線索相關記憶再鞏固小鼠模型,可卡因誘導的記憶提取顯著增加NAc核心circTmeff-1 水平;進一步實驗證明,敲低circTmeff-1 通過釋放miR-206,抑制下游靶分子BDNF的表達,從而抑制可卡因相關記憶的再鞏固。
3.3 環狀RNA與甲基苯丙胺成癮
Li 等[25]揭示甲基苯丙胺(methamphetamine,METH)處理初級皮質神經元后的差異circRNA 表達譜,并在METH 誘導的成癮小鼠模型中篩選驗證了circHomer1 和circTlk1,首次揭示circRNA 在METH 誘導的神經元損傷和成癮中的作用。circHomer1 的宿主基因Homer1是中樞神經系統即刻早期基因編碼的突觸后致密物主要支架蛋白,廣泛表達于中樞神經系統。在METH 依賴小鼠腦內,circHomer1 表達顯著上調,且與CPP 分數密切相關,敲低circHomer1 可下調靶基因Bcl-2 綁定組件3(Bcl-2-binding component 3,Bbc3)表達,減輕METH 誘導的神經元損傷[59]。此外,Boroujeni等[60]發現,暴露于METH 會影響大鼠運動協調性并顯著改變小腦的circRNA 表達譜,基于宿主基因的功能分析揭示了差異circRNA 參與METH 誘導的神經毒性和運動活動缺陷。此外,Huang 等[61]研究發現源自同源結構域相互作用蛋白激酶2 的circHIPK2 與METH 誘導的星形膠質細胞活化密切相關。實驗證明circHIPK2 通過競爭性結合miR-124促進下游靶標Sigma非阿片細胞內受體1(sigma non-opioid intracellular receptor 1,SIGMAR1)的表達。特異性敲低海馬circHIPK2,通過靶向miR-124/SIGMAR1 軸調節自噬和內質網應激,明顯抑制METH 誘導的星形膠質細胞活化,為藥物濫用背景下神經炎癥的治療提供潛在靶點。在自噬相關蛋白5(autophagy related 5,ATG5)的研究中發現,circHECW2 與miR-30 的結合導致ATG5 的表達增加,以非自噬的作用途徑促進內皮-間充質轉化中的神經炎癥[62]。上述結果表明,circRNA 參與調控精神興奮劑誘導的神經病理學改變和介導成癮行為表型。
4 結語
隨著高通量測序技術的迅速發展和生物信息學分析的不斷創新,circRNA被揭示可通過ceRNA、結合蛋白質和翻譯多肽等多種功能機制廣泛參與神經系統疾病的調控。circRNA 的組織特異性、時空特異性、疾病特異性、及相對穩定性等特征,使其有望成為藥物成癮等神經精神類疾病診療的重要靶點。未來的研究方向包括對circRNA在各類疾病中的特殊定位、運輸、在活細胞中的降解以及在單細胞水平上的時空表達模式進行探究。在治療應用方面,隨著體外環化工藝的不斷提升,circRNA 作為核酸藥物開發領域的新興分子,有望克服mRNA 面臨的諸多挑戰,實現基因治療的精準遞送和特異調控。
目前,藥物成癮領域的circRNA 研究主要集中于不同成癮性藥物誘導的腦區差異表達譜分型,針對調控成癮機制的深入研究較少。借助于日趨成熟的體內外circRNA 表達調節手段,建立動物模型以探究circRNA 在成癮行為中的具體調控作用,并開發基于circRNA的治療策略是未來研究的重要方向。通過深入研究藥物成癮誘導的circRNA失調如何介導強迫性覓藥和戒斷后復吸等行為,可以更好地為藥物成癮的診療提供新思路和新方法。

