lncRNA TMPO-AS1通過PI3K/Akt信號通路對多囊卵巢綜合征大鼠性激素和卵巢功能的影響
何靜子,穆其琛,付東閣,王碧延
(1.延安大學,陜西 延安 716099;2.又石大學,韓國 全州565701;3.延安大學附屬醫院,陜西 延安 716099)
多囊卵巢綜合征(Polycystic ovarian syndrome,PCOS)多發于育齡期女性,發病后患者多會出現糖代謝異常、雄激素大量分泌等臨床特征,是導致女性不孕的常見病、多發病[1-2]。相關報道認為PCOS在育齡期女性中的發病率處于5%~10%,但其發病機制目前尚未完全明確[3]。長鏈非編碼RNA(long non-coding RNA,lncRNA)是一種參與到細胞代謝、增殖、分化等多種生物學過程的非編碼RNA,其長度超過200 bp,相關研究認為lncRNA異常與糖尿病、癌癥及PCOS等疾病的發生密切相關[4]。lncRNA TMPO antisense RNA1(TMPO-AS1)位于12q23.1上,在肺癌細胞增殖、凋亡、侵襲等調控中具有重要意義[5]。但TMPO-AS1在PCOS發生、發展的調控作用尚未明確,且目前國內外也缺乏相關研究。磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-kinase,PI3K)/蛋白激酶 B(Protein kinase B,PKB)(因PKB是一種相對分子量約為6.0×104的Ser/Thr蛋白激酶,與PKA、PKC均有很高的同源性,該激酶被證明是反轉錄病毒癌基因v-Akt的編碼產物,故又稱Akt),PI3K/Akt信號通路目前被認為在多種腫瘤和炎性反應的發生發展中均能發揮出一定作用。近幾年也有相關研究發現PI3K/Akt與PCOS的發生發展有關[6-7]。但TMPO-AS1是否調控PI3K/Akt信號通路而發揮作用尚未知。基于此,本文就lncRNA TMPO-AS1通過PI3K/Akt信號通路對PCOS大鼠性激素和卵巢功能的影響進行分析。
1 材料與方法
1.1 實驗動物 選擇30只SD雌性大鼠,體重180~220 g,購買于上海斯萊克動物實驗有限公司,實驗動物使用許可證SYXK(浙)2021-0012,正常條件下飼養1周,飼養條件:2~25 ℃,濕度70%,普通飼料喂養,自由攝食飲水、分籠喂養,每籠5只。
1.2 試劑、藥物與儀器 脫氫表雄酮(Dehydro epiandrosterone,DHEA)(美國IL公司);注射用芝麻油(上海羅輔醫藥科技有限公司,批準文號F20180001661);FA2004N電子天平(菁海儀器有限公司);mRNA反轉錄試劑盒(北京百奧萊博科技有限公司);熒光定量PCR(RT-qPCR)試劑盒(杭州主諾生物技術有限公司);ES-300組織包埋機(上海聚慕醫療器械有限公司);5424R微型冷凍離心機、Premium U570立式超低溫冰箱(德國 Eppendorf 公司);SH-2020全自動電泳系列[北京金桑特醫用儀器技術開發有限公司,京藥管械(準)字2003第1400072號] ;Trans Blot Cell蛋白轉印系統(美國Bio-Rad 公司);WD-9413A型凝膠成像分析系統(上海析域儀器設備有限公司);DK-S26恒溫水浴箱(上海精宏實驗設備有限公司);兔抗PI3K、Akt抗體(英國Abcam公司,批號ab191606、ab182651);羊抗鼠IgG二抗(武漢艾美捷科技有限公司,批號A1937);增殖細胞核抗原(Proliferating cell nuclear antigen,PCNA)(上海賽信通生物試劑有限公司,批號42140);Western洗滌緩沖液(TBST)(北京百奧萊博科技有限公司);睪酮激素(Testosterone,T)、雌二醇(Estradiol,E2)、促卵泡生成激素(Follicle stimulating hormone,FSH)、促黃體生成素(Luteinizing hormone,LH)酶聯免疫吸附試劑盒(北京博奧森生物工程有限公司);ELX800酶標儀(美國BioTek公司);蘇木素-伊紅(Hematoxylin-yihong staining,HE)染色試劑盒(貨號YT8991,北京伊塔生物科技有限公司);LEICA RM2135切片機(德國切片機Leica公司);OLYMPUS顯微鏡BX41型(日本Olympus公司)。
1.3 大鼠分組、模型制備及處理 參照文獻[8]的方法制備大鼠模型,給予所有大鼠60%高脂飼料喂養,于皮下注射DHEA(6 mg/100 g),連續注射21 d,從第16天開始連續4 d觀察大鼠陰道涂片,連續出現膠質細胞為造膜成功,成功后將大鼠分為模型組、si-NC組、TMPO-AS1-shRNA組。另選取10只正常大鼠作為空白對照組,普通飼料喂養,以等量豆油替代。
1.4 觀察指標
1.4.1 體重、卵巢重量、卵巢指數:最后一次注射1 h后于天平上稱每組大鼠的體重,并采用10%水合氯醛對所有大鼠進行麻醉,每100 g體重0.3 ml劑量麻醉,切除所有大鼠雙側卵巢,并將周邊脂肪組織剔除,于天平上稱重,并計算卵巢指數,卵巢指數=卵巢重量/體重。
1.4.2 RT-qPCR檢測卵巢組織TMPO-AS1、PI3K、Akt mRNA相對表達量:取卵巢組織,Trizol一步法提取組織總RNA,紫外分光光度計(Thermo 2000D)測定濃度和純度,逆轉錄為cDNA擴增,反應條件:95 ℃、30 s,95 ℃、5 s,60 ℃,擴增44 s,循環40個。內參為β-actin,2-ΔΔCt方法分析TMPO-AS1、PI3K、Akt相對表達量。TMPO-AS1上游引物:5’-TCAAACCCGTATTACCG-ATCCA-3’,下游引物:5’-ACCCTACATCCAAGGT-CTCCT-3’;PI3K上游引物:5’-CAAAGCCGAGAAC-CTATTGCGAG-3’,下游引物:5’-GTTTGACTTCG-CCATCTACCAC-3’;Akt上游引物:5’-GAGGTTG-CCCACACGCTTA-3’,下游引物:5’-GGCGTACTCCATGACAAAGCAG-3’。
1.4.3 Western blot檢測卵巢組織PI3K、Akt蛋白表達水平:根據大鼠卵巢重量加入相應劑量的裂解液,制成10%勻漿,冰上裂解30 min,于4 ℃環境下離心(1200 r/min,10 min,半徑9 cm),取上清液,根據相關說明書進行定量,確定上樣量后制備凝膠,上10 μl樣,跑膠,初始電壓80 V,跑開后調為120 V;轉膜(90 min),電流300 mA,封閉液封閉2 h;TBST洗膜10 min,重復3次;加一抗(PI3K稀釋1∶1000,Akt稀釋1∶10000),孵育過夜;重復洗膜3次,加二抗孵育2 h,重復洗膜3次,涂ECL發光液(A、B液1∶1)顯影。
1.4.4 血清性激素指標檢測:所有大鼠麻醉后通過腹主動脈穿刺法采集全血,于室溫靜至60 min后離心(1500 r/min,10 min,半徑9 cm),取上清液置于-80 ℃冰箱保存待用,采用酶聯免疫吸附法檢測血清T、E2、FSH、LH水平。
1.4.5 卵巢形態學觀察:剖開大鼠卵巢,置于10%甲醛溶液中固定(24~48 h),并行石蠟包埋,保存備用,隨后行HE染色(10 min),自來水洗滌,并采用1%煙酸乙酯分化2 s,自來水洗滌,氨水洗2 s,洗掉浮色,HE染色2 min,置于無水乙醇孵育2 s,常規透明、封片、切片,取5個切片,于光鏡下觀察黃體數、成熟卵泡數、顆粒細胞厚層。黃體:類球體,體積增大,殘留卵泡壁有明顯塌陷,卵泡膜結締組織進入顆粒層。成熟卵泡:有明顯卵丘,卵泡腔較大,卵泡內膜細胞與卵泡顆粒層貼近,與顆粒層間存在較多毛細血管,外膜細胞處于外層,與周邊結締組織無明顯界限。
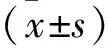
2 結 果
2.1 四組大鼠卵巢組織TMPO-AS1、PI3K、Akt mRNA表達水平比較 模型組與si-NC組TMPO-AS1、PI3K、Akt mRNA水平比較無統計學差異(均P>0.05)。與空白對照組比較,模型組、si-NC組TMPO-AS1、PI3K、Akt mRNA水平較低;與模型組、si-NC組比較,TMPO-AS1-shRNA組TMPO-AS1水平低、PI3K、Akt mRNA水平較高,差異有統計學意義(均P<0.05)。見表1。

表1 四組大鼠卵巢組織TMPO-AS1、PI3K、Akt mRNA表達水平比較
2.2 四組大鼠體重、卵巢重量、卵巢指數比較 模型組與si-NC組體重比較無統計學差異(P>0.05)。與空白對照組比較,模型組、si-NC組、TMPO-AS1-shRNA組體重、卵巢重量、卵巢指數較高;與模型組、si-NC組比較,TMPO-AS1-shRNA組體重、卵巢重量、卵巢指數較低,差異有統計學意義(均P<0.05)。見表2。

表2 四組大鼠體重、卵巢重量、卵巢指數比較
2.3 四組大鼠卵巢組織PI3K、Akt蛋白表達水平比較 模型組與si-NC組PI3K、Akt蛋白表達水平比較無統計學差異(均P>0.05)。與空白對照組比較,模型組、si-NC組、TMPO-AS1-shRNA組PI3K、Akt蛋白表達水平較低;與模型組、si-NC組比較,TMPO-AS1-shRNA組PI3K、Akt蛋白表達水平較高,差異有統計學意義(均P<0.05)。見表3。

表3 四組大鼠卵巢組織PI3K、Akt蛋白表達水平比較
2.4 四組大鼠血清性激素水平比較 模型組與si-NC組T、E2、FSH、LH水平比較無統計學差異(均P>0.05)。與空白對照組比較,模型組、si-NC組、TMPO-AS1-shRNA組T、LH水平較高,E2、FSH水平較低;與模型組、si-NC組比較,TMPO-AS1-shRNA組T、LH水平較低,E2、FSH水平較高,差異有統計學意義(均P<0.05)。見表4。

表4 四組大鼠血清性激素水平比較
2.5 四組大鼠卵巢形態學比較 模型組與si-NC組黃體數、成熟卵泡數、顆粒細胞厚層比較無統計學差異(均P>0.05)。與空白對照組比較,模型組、si-NC組、TMPO-AS1-shRNA組黃體數、成熟卵泡數、顆粒細胞厚層較低;與模型組、si-NC組比較,TMPO-AS1-shRNA組黃體數、成熟卵泡數、顆粒細胞厚層較高,差異有統計學意義(均P<0.05)。見表5。

表5 四組大鼠卵巢形態學比較
3 討 論
PCOS的發生發展可能與胰島素抵抗(IR)、內分泌代謝紊亂、血脂異常等因素有關,近幾年在我國的發病率呈逐年上升趨勢,盡早明確PCOS發生發展的分子機制,并確認其發病的直接靶蛋白,在尋找精確的PCOS治療方法方面意義重大[9]。lncRNA具有空間結構多樣、功能復雜、序列長等特點,在轉錄和翻譯中均具有重要作用,目前國內外有不少研究發現多種lncRNA與PCOS發生發展關系密切,其中李永樂等[10]就發現外周血lnc-NTF3-5在PCOS中表達上調,且通過影響PCOS患者體內炎性反應和性激素分泌的方式還能在IR中發揮重要作用。吳鑌莎等[11]也發現,包含顯著上調的11種lncRNA和顯著下調的8種lncRNA的數據集可以成功區分PCOS患者和健康人群。祁彥萍等[12]則表明,lncRNA GAS5過表達可通過靶向調控miR-21表達的方式對卵巢顆粒細胞增殖進行抑制,進而促使細胞凋亡。以上研究均為PCOS發生發展的診斷及治療提供了新方向。但目前仍有部分lncRNA在PCOS發生發展的作用尚未闡明,因此繼續挖掘lncRNA分子并探討其與PCOS生物學行為的相關性,對提升PCOS治療效果及改善預后等方面均具有重要意義[13]。
TMPO-AS1作為反轉錄本1,廣泛參與了調控細胞的增殖過程,相關研究報道lncRNA TMPO-AS1是一種與惡性腫瘤密切相關的lncRNA,在多種惡性腫瘤中均能充當癌基因[14]。但目前對于lncRNA TMPO-AS1在PCOS發生發展中的研究較為缺乏。本次研究通過RT-qPCR檢測發現,模型組、si-NC組TMPO-AS1、PI3K、Akt mRNA水平均比空白對照組低。這與ZHAO等[15]關于lncRNA TMPO-AS1在卵巢癌表達中上調,可促進LCN2轉錄活性并在卵巢癌中發揮致癌功能的研究相符。提示TMPO-AS1、PI3K/Akt可能在PCOS發生發展中發揮一定作用。而PI3K/Akt信號通路目前已被證實廣泛參與到細胞的增殖、分化和凋亡等過程中,是維持始基卵泡生長、發育和凋亡的重要機制,其在促進卵泡顆粒細胞增殖和凋亡方面也能發揮出一定作用[16]。一旦PI3K被激活,可促使依賴磷酸酰肌醇的激酶變構并激活,進而激活靶蛋白Akt,而胰島素能夠促進子宮內膜細胞和癌細胞增殖,一旦胰島素受體β亞基的酪氨酸激酶活化,胰島素受體底物將會被激活,并進一步激活PI3K通路,PI3K通路激活后,Akt多個殘基的磷酸化位點也會出現磷酸化并激活Akt,進而促進卵泡膜細胞增生,或出現卵泡發育異常、無排卵等PCOS臨床癥狀[17-18]。尹麗紅等[19]的研究也發現PI3K/Akt信號通路相關蛋白在PCOS伴IR大鼠中的表達異常,證實了PI3K/Akt信號通路過度表達參與了PCOS的發生發展過程,與本次研究結果一致。此外,PI3K/Akt信號通路與卵巢顆粒細胞自噬存在一定關聯,PI3K/Akt信號通路一旦受到抑制將無法調控卵巢顆粒細胞自噬過程,進而引起卵泡鎖閉,從而影響機體卵巢功能,導致性激素紊亂[20-21]。XIE等[22]的研究發現,通過PI3K/Akt途徑調節DHEA誘導的PCOS自噬,可在一定程度上改善卵巢功能障礙,揭示了PCOS的潛在藥物靶點,這為PCOS提供了新的治療方向。本次研究結果顯示,TMPO-AS1-shRNA組的體重、卵巢重量、卵巢指數和T、LH水平均比模型組、si-NC組低;PI3K、Akt、E2、FSH水平和黃體數、成熟卵泡數、顆粒細胞厚層均比模型組、si-NC組高。劉菏婧等[23]也發現上調PI3K/Akt信號通路在改善PCOS-IR大鼠性激素、多囊卵巢和胰島素抵抗狀態等方面具有重要意義,與本次研究結果相似。這說明PCOS可能導致局部卵巢組織PI3K/Akt信號通路相關重要信號傳導分子基因表達量紊亂,而lncRNA TMPO-AS1可重新上調PI3K、P-PI3K、Akt、P-Akt基因表達,有利于促使卵巢功能恢復正常,進而改善卵巢形態和性激素紊亂狀態[24-25]。但本次研究納入樣本量較小,且受地域、PCOS診斷等因素的影響,研究結果可能存在偏差,其具體調控機制還有待進一步深入研究。
綜上所述,lncRNA TMPO-AS1在PCOS發生發展具有重要意義,通過PI3K/Akt信號通路有利于調節PCOS性激素水平,并增強卵巢功能。

