雙重血漿分子吸附系統序貫血漿置換治療HBV感染相關慢加急性肝衰竭療效及對患者血清內毒素和炎癥因子水平的影響
范瀟月,劉建英,張 悅,洪 芹,陳琳琳
(德陽市人民醫院,四川 德陽 618000)
乙型肝炎病毒感染相關慢加急性肝衰竭(HBV-associated acute-on-chronic liver fail-ure,HBV-ACLF)是在慢性肝病基礎上發展而來的急性肝損傷,患者以高黃疸、嚴重凝血功能障礙為主要表現[1-2]。HBV-ACLF患者可伴有多器官衰竭,短期病死率高達60%~80%[3]。人工肝支持治療是目前控制病情,延緩患者生命的有效手段,主要包括血漿置換(Plasma exchange,PE)、雙重血漿分子吸附系統(Double plasma molecular adsorption system,DPMAS)等治療模式[4-5]。PE治療價格適中,療效明確,但存在血漿供應不足和過敏的風險[6]。DPMAS治療既可減輕血漿不足的壓力,又可提高對膽紅素的吸附能力,有效調節凝血功能[7]。近年來,DPMAS聯合PE治療逐漸獲得臨床醫患的認可,該療法可取長補短,充分發揮上述兩種療法的優勢,但關于其對患者血清炎癥因子、內毒素水平及存活率的影響,還需更多臨床資料支持[8]。故本研究選取92例HBV-ACLF患者為研究對象,分析DPMAS序貫PE治療的近期療效,現報告如下。
1 對象與方法
1.1 研究對象 92例HBV-ACLF患者來自德陽市人民醫院,收集時間為2019年3月至2021年7月。病例納入標準:經臨床血液生化等檢查明確診斷,符合中華醫學會感染學分會制定的《肝功能衰竭診療指南(2012年版)》[9]中急性肝衰竭的診斷標準:既往有慢性肝病基礎,黃疸加重、乏力、血清總膽紅素(TBIL)每日升高>17.1 μmol/L或高于正常值上限10倍,同時血漿凝血酶原活動度≤40%或者國際標準化比值≥1.5;年齡20~75歲的HBV感染者。排除標準:合并患有嚴重功能臟器障礙者;酒精性肝病或自身免疫性肝病者;患有甲、丙、丁、戊病毒性肝炎者;行肝臟移植或長期接受抗凝藥物治療者;惡性腫瘤者;無法配合研究者;哺乳及妊娠期婦女。根據非隨機同期對照研究及患者自愿原則分為DPMAS序貫PE組(n=45例)和PE組(n=47例)。所有患者簽署知情同意書。
1.2 治療方法 92例患者入院后需要嚴格臥床休息,嚴格監測生命體征,同時給予營養支持、補充血漿、白蛋白及口服抗病毒藥物等基礎治療,PE組另予以單純PE治療,DPMAS序貫PE組患者接受DPMAS序貫PE治療。
1.2.1 PE組:采用偉力血液凈化人工肝支持系統及相關血漿分離器(國械注準20163454896),使用PE模式連接管路,并用肝素鈉氯化鈉溶液進行預處理,接著給予患者塞米松5 mg靜脈注射,20 ml葡萄糖酸鈣(10%)混合葡萄糖氯化鈣(5%)靜脈滴注;以新鮮冰凍血漿作為置換液,置換2000~3000 ml新鮮血漿,流速設置為120~150 ml/min,分離速度設置為25~30 ml/min,置換1.5~2.0 h,治療次數2~3次,間隔3~5 d,以硫酸魚精蛋白(≤50 mg)進行肝素對抗,共治療12周,治療次數根據患者具體情況調整。
1.2.2 DPMAS序貫PE組:采用血液凈化人工肝支持系統、血漿分離器(國械注準20163454896),樹脂血液灌流器(國械注準20163451181)和血漿膽紅素吸附器(國械注準20163450373)進行DPMAS序貫PE治療;安裝體外循環通路,給予患者塞米松5 mg靜脈注射,20 ml葡萄糖酸鈣(10%)混合葡萄糖氯化鈣(5%)靜脈滴注,術前以0.9%氯化鈉溶液對柱體和管道行預沖洗,給予肝素鈉抗凝,術中流速設置為100~150 ml/min,吸附時間不少于150 min,血漿處理量約5000 ml;DPMAS治療結束后調整血漿泵流量,將動靜脈端和吸附柱端夾閉,并設置為單獨PE模式,補充800 ml新鮮血漿,血流速度設置為120~150 ml/min,分離速度設置為25~30 ml/min,置換0.5 h;治療間隔3~5 d,先給予DPMAS治療,再予以PE序貫治療,以硫酸魚精蛋白(≤50 mg)進行肝素對抗,共治療12周,治療次數根據患者具體情況調整。
1.3 觀察指標
1.3.1 治療4 周及12周存活率及好轉率:統計兩組治療4周及12周時的好轉率及存活率,治療好轉判定標準[10]:患者腹脹、乏力、腹水、黃疸等臨床癥狀體征好轉,TBIL水平在正常值5倍以下,國際標準化比值<1.6或凝血酶原活動度>40%。
1.3.2 血清炎癥因子與內毒素水平:于治療前、治療4周及12周時收集患者空腹靜脈血液樣本,采用ELISA法檢測兩組患者血清C反應蛋白(CRP)和白細胞介素6(IL-6)水平;中性粒細胞及淋巴細胞水平采用全自動血液分析儀測定,并計算中性粒細胞/淋巴細胞比值(NLR);采用鱟試劑動態比濁定量法檢測PE組及DPMAS序貫PE組血清內毒素(ET)水平。
1.3.3 終末期肝病(MELD)評分:比較兩組治療前及治療4周及12周時的MELD評分[11]以預測患者的病死率:MELD總分<15分為無需進行肝移植,20~30分的病死率>30%,30~40分的病死率>50%,總分40分以上的病死率>70%,評分越高表示患者的預后越差。
1.3.4 并發癥:統計兩組治療過程中并發癥發生情況。
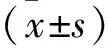
2 結 果
2.1 兩組一般資料比較 兩組性別、年齡等一般資料比較,無統計學差異(均P>0.05),見表1。
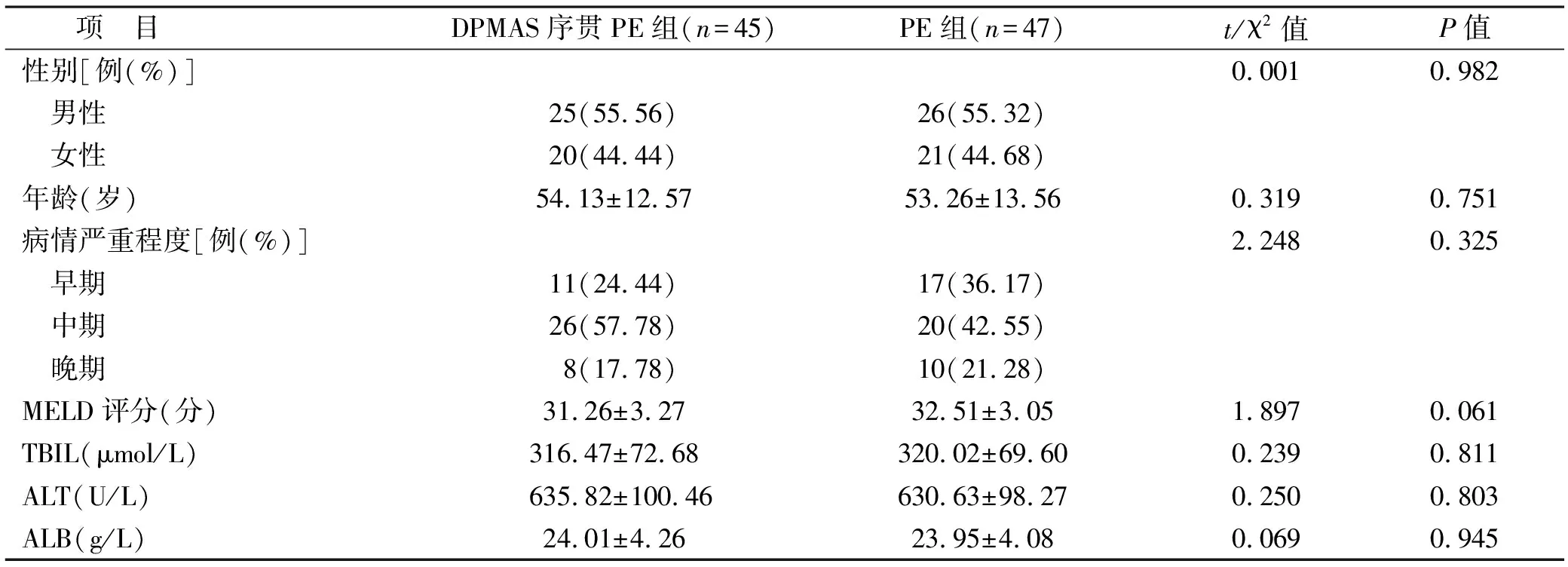
表1 兩組一般資料比較
2.2 兩組治療4 周及12周存活率比較 DPMAS序貫PE組治療4周及12周時的存活率與PE組比較無統計學差異(均P>0.05),見表2。
2.3 兩組治療4周及12 周好轉率比較 兩組治療4 周好轉率比較有統計學差異(P<0.05),治療12 周好轉率比較無統計學差異(P>0.05),見表3。

表3 兩組治療4 周及12 周好轉率比較[例(%)]
2.4 兩組血清炎癥因子與內毒素水平比較 治療4周及12周時,DPMAS序貫PE組血清CRP、IL-6、NLR及ET水平顯著低于PE組(均P<0.05),見表4。

表4 兩組血清炎癥因子與內毒素水平比較
2.5 兩組MELD評分比較 DPMAS序貫PE組治療4周時的MELD評分顯著低于PE組(P<0.05),兩組治療12周時的MELD評分比較無統計學差異(P>0.05),見表5。

表5 兩組MELD評分比較(分)
2.6 兩組并發癥發生率比較 兩組治療過程中,并發癥發生率比較無統計學差異(均P>0.05),見表6。

表6 兩組并發癥發生率比較[例(%)]
3 討 論
內科支持治療、人工肝治療及肝移植是HBV-ACLF的主要干預手段[12-13],其中人工肝治療形式多樣、療效確切,應用范圍較廣。在PE治療中,血漿被分離并補充凝血因子來進行置換,同時能夠清除內毒素及大分子免疫復合物,但在清除血漿水溶性毒素方面局限性明顯,且對血漿的需求量較大,還易引發過敏、感染等不良反應[14]。DPMAS治療可有效清除炎性介質、膽紅素及大分子蛋白,還可降低濾過過程中對血漿有益物質的破壞[15],但單一治療存在一定局限性[16]。本研究給予HBV-ACLF患者DPMAS序貫PE治療,獲得良好療效。
HBV-ACLF的致病機制一方面與HBV感染引發的原發性病理免疫損傷有關,另一方面與內毒素引起的炎性反應有關[17]。患者由于肝細胞損傷使內靜脈內毒素未經正常代謝而進入體循環,誘發內毒素血癥,而過量的內毒素又可進一步損傷肝細胞,刺激炎癥因子的分泌,并活化中性粒細胞,從而表現為血清CRP、IL-6、NLR水平升高[18]。本研究結果顯示,DPMAS序貫PE組與PE組血清炎癥因子及ET水平比較有統計學差異。說明DPMAS序貫PE治療與單純PE治療在清除血清炎癥因子方面效果更顯著。與黎春宇等[19]報道基本相符。這是由于,DPMAS中的陰離子交換樹脂吸附柱能夠特異性結合膽紅素,樹脂血液灌流器依托其大孔結構和大比例表面積,增強對IL-6、CPR等炎癥因子的吸附能力[20],同時序貫PE治療可補充血漿中丟失的凝血因子等活性成分,彌補DPMAS治療的不足,從而改善患者肝功能[21]。黃輝權[22]研究指出,給予急性重癥肝衰竭伴多器官功能障礙綜合征患者PE+DPMAS治療,不僅對電解質水平影響較小,還可改善肝功能,下調CRP等水平,改善患者臨床結局,這為本研究提供理論支持。另外,本研究發現,兩組治療期間并發癥發生率比較無統計學差異,證明DPMAS序貫PE治療,總體安全可靠[23]。
本研究還發現DPMAS序貫PE組患者的4周好轉率高于PE組,MELD評分低于PE組,而兩組治療12周時的總體存活率及MELD評分比較無統計學差異,且兩組治療4周好轉率及12周存活率差異主要集中在ACLF早期患者中。提示DPMAS序貫PE治療可有效提高ACLF早期患者的治療效果,但在改善整體生存率方面,還需進一步驗證[24]。但這與沈揚林等[25]報道的DPMAS序貫PE治療可提高HBV-ACLF患者90 d生存率有所不同,可能與不同研究中患者的病情嚴重程度不同有關。
綜上所述,給予HBV-ACLF患者DPMAS序貫PE治療可明顯提高ACLF早期患者的4周治療好轉率,有效清除血清內毒素及CRP、IL-6等炎癥因子。該療法安全有效,與單純PE治療比較,不會增加電解質紊亂、感染等并發癥發生率,但在提高中晚期患者12周生存率方面局限性明顯。本研究存在明顯不足,為單中心臨床設計,樣本量少,僅能使用較簡單的統計分析方法進行分析,控制混雜因素的方法較欠缺,后續有待擴大樣本量,控制混雜因素,以減小結果偏倚,且未對不同疾病階段HBV-ACLF患者的血清炎癥因子水平進行探究,期待后續補足。

